新冠病毒突变、牛津疫苗暂停,疫苗还会有效吗?
![]()
最近爆出来了牛津大学疫苗因为不良反应叫停,对新冠疫苗有什么影响呢?
牛津大学的疫苗是基因工程疫苗,采用的是一种人从未感染过的黑猩猩腺病毒作为载体,属于新技术。
目前中国的疫苗已经进入3期临床试验的有3家公司(康希诺、国药集团、科兴生物)的4款疫苗,并且都公布了前期临床试验结果。
康希诺的疫苗仅限于军队紧急使用,国药集团及科兴生物的疫苗已经也已获批在特殊人群中使用,如医务人员、防疫人员、边检人员以及保障城市基本运行人员等特殊人群。
我们这里主要讨论国药集团、科兴生物的3款疫苗,也是最近亮相服贸会的主角。它们采用的是灭活病毒技术,与牛津大学的疫苗属于完全不同的技术路线,因此两者之间不存在关联性。
目前出现过哪些不良反应呢?
国药集团和科兴生物的疫苗,都未发现3级不良反应(即严重不良反应),已发生的程度较轻,多可自行恢复。
接种疫苗的不良反应分为局部性的和全身性的:
(1)报告的局部不良反应中,以疼痛最常见,还有发红、肿胀、瘙痒、皮疹、硬结等。
(2)报告的全身不良反应中,国药集团的疫苗以发热最常见,科兴生物的以乏力最常见,其他的还有咳嗽、腹泻、头疼、恶心和呕吐、非接种部位的瘙痒和肌肉疼痛、急性过敏反应、皮肤和粘膜异常、食欲缺乏。
目前来看,短期不良反应是很轻且可接受的,长期不良事件还需要等待3期试验结果。
为什么需要接种2针或3针?
以国药集团的疫苗[1]为例,它进行的是1、2期合并的临床试验。
其中1期临床试验共接种了3针(0天、28天、56天);2期临床试验接种了2针,短间隔期组在0天和14天接种,长间隔期组在0天和21天接种。结果发现:
1期临床试验和2期的长间隔期组的患者都产生了抗体反应(100%),但2期的短间隔期组仅有85.7%的患者产生了抗体反应。
多次注射疫苗可以增加抗体滴度,并且较长的注射间隔时间(21天和28天)诱发的抗体反应比较短的间隔时间(14天)更高。
因此,在3期临床试验及紧急接种中,也就采取了接种2针或者3针的方案,既可以保证所有的人都产生抗体,也可以观察灭活疫苗的最佳注射间隔和加强注射次数。
新冠疫苗的效力
虽然在前期的动物实验中,疫苗都保护了恒河猴免于新冠病毒的感染,但目前没有任何一款疫苗完成了3期临床试验,即人通过接种疫苗产生的抗体,并未实际地去接受病毒感染的挑战。
所以尽管灭活疫苗引起强烈的抗体反应,但是否能保护个体免受新冠攻击仍是未知的,现在不能下这方面的结论。
新冠疫苗疗效与病毒突变
疫苗可以理解为病毒的替身,给免疫系统提供一次演习的机会,让免疫系统提前认识病毒,以便在真正遇到病原体时,免疫系统就可以直接、快速产生特异的抗体和或免疫细胞清除病原体,保护人体。
因此,只要关键识别信息(如人类的指纹、虹膜等)没有改变,其他的变异不会对疫苗造成根本性的影响。
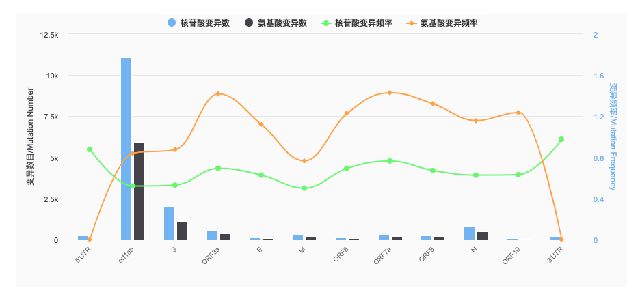
根据国家生物信息中心披露[3],病毒的突变并不是均匀分布的,而是某一些区域变异频率非常高,比如orf1ab。因此选择具有一定特异性,又相对稳定的片段,可有效降低突变对疫苗的影响。
图来源:国家生物信息中心
备注:核苷酸变异指病毒RNA发生了变异,氨基酸变异指病毒RNA变异导致合成了不同的氨基酸,进而变成不同蛋白质,影响功能。氨基酸是以病毒RNA为指导模板进行合成的,但部分核苷酸变化之后合成的氨基酸是一样的,所以两者存在差异。
目前,疫苗选取的都是S蛋白,之前网络上热议的D614G突变就是发生在这个区域,但是目前并无强力证据表明“这个突变已经影响了S蛋白的主要功能——与人体细胞结合”,即网上热议的“D614G突变毒株传染性更强”仍属于一个猜测,这个突变也不会影响到疫苗诱发的抗体识别病毒。
美国科学院报(PNAS)在8月31日刊登了一篇论文[5],对18514个正在流行的新冠病毒序列进行分析发现:新冠病毒的基因组多样性有限,并且由于SARS-CoV-2的传播速度比它的进化速度快,病毒种群正变得更加同质。因此研究人员认为单一的候选疫苗应该对当前流行的病毒有效。
疫苗更倾向于以早期版本的病毒为“替身”,比如流感H1N1年度疫苗仍使用自2009年以来的一种菌株,但仍对现在流行的H1N1病毒有效。因此我们使用的武汉早期流行的病毒株,足以覆盖现有的新冠病毒。
目前国产疫苗并未暴露出相关问题,但毕竟还处于临床试验阶段,如果不是高危人群(如医生、涉外工作人员等),大可再等一等3期临床试验数据。
目前世界上的疫苗研发进度
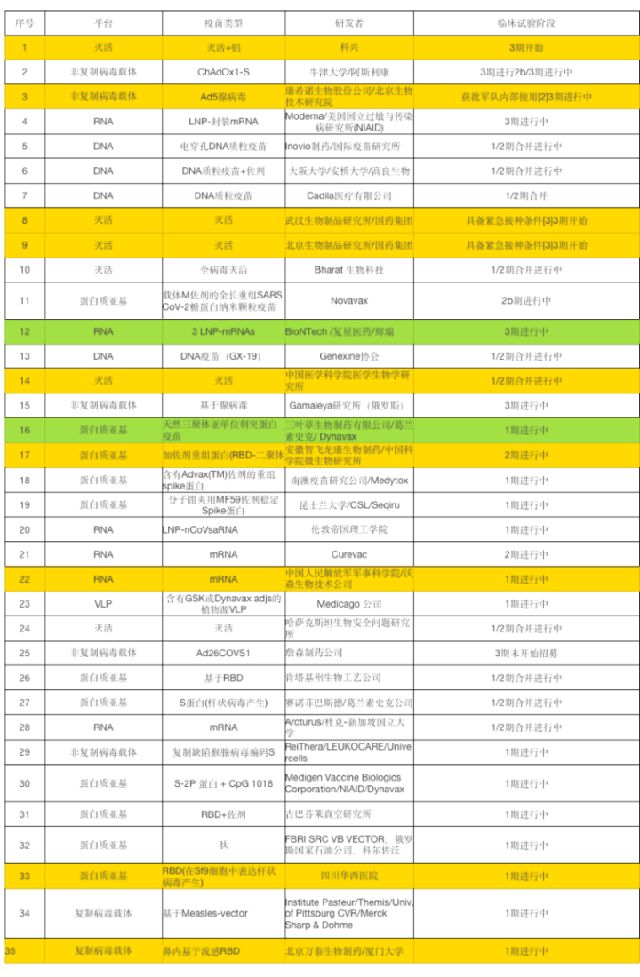
根据 WHO 总结[6],截至 2020 年 9 月 9 日,一共有 145 个疫苗在临床前阶段,35 个疫苗进入临床试验,共有 9 个疫苗进入 3 期临床试验,国产疫苗占 4 个:
参考资料:
[1] Xia S, Duan K, Zhang Y, et al. Effect of an Inactivated Vaccine Against SARS-CoV-2 on Safety and Immunogenicity Outcomes: Interim Analysis of 2 Randomized Clinical Trials.[J]JAMA. 2020:e2015543.
[2] Zhang YJ, Zeng G, Pan HX, et al. Immunogenicity and Safety of a SARS-CoV-2 Inactivated Vaccine in Healthy Adults Aged 18-59 years: Report of the Randomized, Double-blind, and Placebo-controlled Phase 2 Clinical Trial.[J] medrxiv. 2020 Aug 10.
[3] Zhao WM, Song SH, Chen ML, et al. The 2019 novel coronavirus resource.[J] Yi Chuan. 2020;42(2):212–221.
[4] Kai Kupferschmidt. The pandemic virus is slowly mutating. But is it getting more dangerous?[EB/OL] sciencemag.org. 2020.
[5] Dearlove B, Lewitus E, Bai H, et al. A SARS-CoV-2 vaccine candidate would likely match all currently circulating variants.[J] Proc Natl Acad Sci U S A. 2020:202008281.
[6] WHO. Draft landscape of COVID-19 candidate vaccines.
https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines
好想法、好创意、好线索,
请添加微信(ID:lubinxun2727)交流 一经采用 即奉酬劳50-5000元
小健说: 如果不想错过我们的推送,可以进入公众号,查看以往的文章列表; 如果有一天没有收到我们的推送,那可能因为微信改变了推荐方式,不是我们没有更新哟; 你可以在搜索框搜索“健康界”,进入公众号,阅读往期文章。