- GEO数据的下载和处理|GEO数据转换为Gene symbol|GEO注释文件提取symbol|查看样本标签|查看GEO数据疾病或正常|生物信息基础
Red Red
生信小技巧学习笔记生物信息r语言GEO数据库数据库
GEO数据的下载和处理|GEO数据转换为Genesymbol|GEO注释文件提取symbol|查看样本标签|查看GEO数据疾病或正常|生物信息基础数据的下载和处理首先在GEO数据库中通过GSEID找到相关数据,然后下载txt文件。数据读取与处理。#设置工作路径,也就是你的分析数据存放以及要保存到地方setwd(dir="C:\\Users\\LiaoMinzhen\\PycharmProjects
- 生物信息名词汇总|生物信息基础知识
Red Red
生信小技巧学习笔记
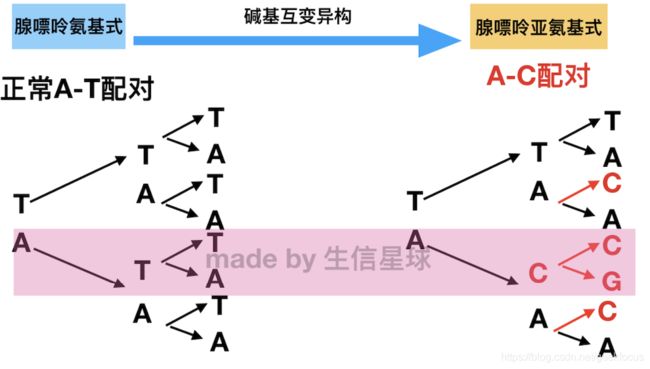
生物信息名词汇总|生物信息基础知识GWAS-Genome-wideassociationstudies,全基因组关联研究:用于识别遗传区域(基因组)和性状/疾病之间关联的方法。Predixcan:GWAS找到大量的SNP,可是可以解释生物学功能的SNP位点却是很有限的。gene-based关联分析软件——PredicXcan。PrediXcan包括两个步骤:-在具有可用基因型的队列中预测基因表达(
- 推荐一份生物信息学入门很好的参考材料
小明的数据分析笔记本
链接是https://bioinformatics.uconn.edu/resources-and-events/tutorials-2/这个是康涅狄格大学(UniversityofConnecticut)提供的一份教程,主要的内容包括1、生物信息学中经常用到的文件格式image.png2、linux操作系统和R语言的基础知识image.png3、转录组数据的处理流程image.png这里包括有参
- 【机器学习】朴素贝叶斯方法的概率图表示以及贝叶斯统计中的共轭先验方法
Lossya
机器学习概率论人工智能朴素贝叶斯共轭先验
引言朴素贝叶斯方法是一种基于贝叶斯定理的简单概率模型,它假设特征之间相互独立。文章目录引言一、朴素贝叶斯方法的概率图表示1.1节点表示1.2边表示1.3无其他连接1.4总结二、朴素贝叶斯的应用场景2.1文本分类2.2推荐系统2.3医疗诊断2.4欺诈检测2.5情感分析2.6邮件过滤2.7信息检索2.8生物信息学三、朴素贝叶斯的优点四、朴素贝叶斯的局限性4.1特征独立性假设4.2敏感于输入数据的表示4
- 零基础入门生信数据分析——导读
呆猪儿
生信之转录组——上游分析生信之转录组——下游分析学习方法r语言数据分析数据库数据挖掘需求分析大数据
零基础入门生信数据分析——导读生信数据分析,即生物信息学数据分析,是一个涵盖了生物学、计算机科学、数学和统计学等多个领域的交叉学科。它主要利用计算机算法和统计方法对生物学数据进行处理、分析和解释,以揭示生物分子、细胞、组织和生物体等各个层次的生物学规律和机制。本帖主要是为生信数据分析的各个分析点提供跳转链接(简单说就是提供了一个目录供大家选择自己想要的知识点可以直接跳转)关联的生信数据分析的分析点
- http://www.cnpop.org/portal.php,生物信息的84个新晋网红应用
weixin_39699163
Descriptionsofnewonlinedatabasesinthe2018NARDatabaseissueDatabaseURLBriefdescriptiona3DIVhttp://kobic.kr/3div3D-genomeInteractionVieweranddatabaseAAgMarkerhttp://bioinfo.wilmer.jhu.edu/AAgMarker/index
- NCBI BLAST+:分析生物内在编码的工具
belldeep
生物信息学Blast生物数据分析
在生物信息学的广阔领域中,NCBI(NationalCenterforBiotechnologyInformation,美国国立生物技术信息中心)开发的BLAST(BasicLocalAlignmentSearchTool,基本局部比对搜索工具)无疑是一把不可或缺的分析工具。NCBIBLAST+,作为其最新版本2.16.0+,为科研工作者提供了一套强大的序列比对和搜索功能,帮助解析生命现象背后的遗
- 【图论简介】
WA-自动机
图论深度优先算法架构后端前端面试
图论简介图论是一门数学分支,主要研究图(Graph)的性质、结构和应用。图论在计算机科学、网络理论、优化问题、生物信息学等多个领域都有广泛的应用。本文将简要介绍图论的基本概念、常见算法及其在实际中的应用。一、图的基本概念图(Graph):图是由一组顶点(Vertices)和连接顶点的边(Edges)组成的结构。可以表示为(G=(V,E)),其中(V)是顶点的集合,(E)是边的集合。根据边的不同属性
- 生信圆桌:专业生信服务器与平台服务的提供者
生信圆桌x生信云服务器
服务器人工智能运维
生信圆桌是一个专注于提供生物信息学(生信)服务器和平台服务的领先企业,致力于为全球科研机构、企业和独立研究者提供高性能的生信分析解决方案。随着生物信息学研究对计算资源的需求日益增加,生信圆桌凭借其先进的服务器技术和专业的服务团队,成为了生信领域中不可或缺的合作伙伴。访问生信圆桌,使用生信云。高效分析少走弯路www.tebteb.cc生信圆桌的核心服务高性能生信服务器定制:生信圆桌为客户提供定制化的
- 用Python实现生信分析——基序(Motif)识别详解
写代码的M教授
生信分析python开发语言
1.什么是基序(Motif)?在生物信息学中,基序(Motif)是指在生物序列(如DNA、RNA或蛋白质序列)中具有特定功能或结构的短序列片段。基序通常在生物进化中得到保留,因为它们在生物学功能中起着重要作用。例如,在DNA序列中,基序可能是一个转录因子结合位点;在蛋白质序列中,基序可能是一个具有特定功能的结构域。基序识别是指从一组生物序列中识别出保守的短序列片段,这对于功能预测、基因调控网络分析
- 数据结构与算法——动态规划
passion更好
数据结构C++动态规划算法
目录引言最优子结构重叠子问题打家劫舍(LeetCode198题)经典例题1.爬楼梯(LeetCode70题)2.斐波那契数列(LeetCode126题)3.最长公共子序列(LeetCode95题)引言动态规划(DynamicProgramming,简称DP)是一种在数学、计算机科学、经济学和生物信息学等领域广泛使用的算法设计技术。它通过把原问题分解为相对简单的子问题的方式,来求解复杂问题。动态规划
- 深度学习——概念引入
韶光流年都束之高阁
深度学习日记深度学习人工智能职场和发展
深度学习深度学习简介深度学习分类根据网络结构划分:循环神经网络卷积神经网络根据学习方式划分:监督学习无监督学习半监督学习根据应用领域划分:计算机视觉自然语言处理语音识别生物信息学深度学习简介深度学习(DeepLearning,DL)是机器学习领域中的一个新的研究方向,主要是通过学习样本数据的内在规律和表示层次,让机器能够具有类似于人类的分析学习能力。深度学习的最终目标是让机器能够识别和解释各种数据
- 考研调剂:中医生命科学
菌心说双脑论
科学网—考研调剂——欢迎研究生调剂到我们的招生专业方向“中西医结合基础”:中医药与肠道菌群、生物信息学等交叉学科-张成岗的博文http://blog.sciencenet.cn/home.php?mod=space&uid=40692&do=blog&id=1281078欢迎各位有志于从事中医生命科学、解码中医、中西医结合以及医学与数学、计算机科学等交叉学科研究的青年才俊加入我们的研究团队,共同见
- 2020-04-07
liuyang2020
学习小组Day2笔记--linux入门(刘阳)1.为什么学习linux大多数人用的是可视化界面,便捷的windows,linux用户量比较少,但是需要知道,linux的功能相当的强大,对于数据处理、程序运行方面的优势,那是其它的系统无法比拟的,生物信息学数据处理对电脑要求较高,因此学习linux,,嘿嘿,大势所趋。2.linux操作2.1登录远程登录linux服务器,好像有很多连接软件,今天尝试应
- Bioinformatic workflow
小潤澤
给大家推荐个网站:https://bioinformaticsworkbook.org/projectManagement/Intro_projectManagement#gsc.tab=0这个网站适合于刚入门的生物信息同学,里面涉及到一些NGS的流程软件介绍以获得原作者的授权:原推文链接:https://twitter.com/tangming2005/status/12401074132289
- Python在生物信息学中的应用:有序字典
简说基因-专业生信合作伙伴
python开发语言
我们知道,通过{}创建的字典是无序的。如何创建有序字典呢?解决方案可以使用collections模块中的OrderedDict类。当对字典做迭代时,它会严格按照元素添加的顺序进行。例如:from collection import OrderedDictd=OrderedDict()d['1st'] = 1d['2nd'] = 2d['3rd'] = 3d['4th']=4forkeyind:
- Python在生物信息学中的应用:同时对数据做转换和换算
简说基因-专业生信合作伙伴
python开发语言
我们需要调用一个换算(reduction)函数,例如sum()、min()、max()等,但首先得对数据做转换或筛选。解决方案一种优雅的方式能将数据换算和转换结合在一起,即在函数中使用生成器表达式。例如,要计算平方和,可以这样:nums=[1,2,3,4,5]s=sum(x*xforxinnums)更多的例子:#Determineifany.pyfilesexistinadirectoryimpo
- Python在生物信息学中的应用:列表推导式
简说基因-专业生信合作伙伴
pythonwindows开发语言
列表中有一些数据,我们想提取或删除某些值,该怎么办?解决方案最简单的方法是使用列表推导式(listcomprehension)。例如:>>>mylist=[1,4,-5,10,-7,2,3,-1]>>>[nforninmylistifn>0][1,4,10,2,3]>>>[nforninmylistifn>>列表推导式的使用需要注意其内存占用,当原始列表比较大时,其内存占用较高,可以使用生成器表达
- 最长公共子序列(LCS)
算法
定义(维基百科)在一个序列集合中(通常为两个序列)查找所有序列中最长的子序列。这与查找最长公共子串的问题不同的地方是:子序列不需要在原序列中占用连续的位置。最长公共子序列问题是一个经典的计算机科学问题,也是数据比较程序,比如Diff工具和生物信息学应用的基础。它也被广泛地应用在版本控制,比如Git用来调和文件之间的改变解决方案这类问题通常都是采用动态规划的思想来解决,核心就是构造出动态解决方程。以
- 自学生物信息学
gtt儿_生物信息学习
我是生物工程专业出身,在大三保研时选择了生物信息的道路,到现在为止已经在行业里摸爬滚打了6年的时间,在这6年的学习之路上疑惑过,也迷茫过,特此把我学习的过程以及遇到的问题总结出来以让大家避免出现同样的问题。在我学习生物信息过程的基础上带着大家顺畅的走一遍。在学习生物信息学之前,我们先来了解一下什么是生物信息学。生物信息学,顾名思义,生物学和信息学的结合。生物学,这个对大家比较简单,基本入生信行的同
- 我们能成为孩子的上帝吗—— 谁来管理非法行医的贺建奎
闲月农
贺建奎,原南方科技大学副教授,毕业于美国斯坦福大学,拥有多学科交叉的背景,并在基因测序仪研究,CRISPR基因编辑,生物信息学等多个领域取得研究突破。2018年11月26日,贺建奎“基因编辑婴儿”事件引发轩然大波。2018年12月19日,贺建奎入选《Nature》年度十大科学人物。2019年4月18日,上榜美国《时代》杂志(Time)2019年度全球百位最具影响力人物榜单。2019年12月30日,
- 2022-01-27
学习生信的小兔子
参考:生物信息学100个基础问题——第1~5题答案公布-知乎(zhihu.com)掌握FASTQ格式特点第2行就是测序得到的序列信息,一般用ATCGN来表示,其中N用于荧光信号干扰无法判断到底是哪个碱基时的代表符号;第3行以“+”开始,可以储存一些附加信息,但目前的测序fastq文件这一行一般是空的。第4行储存的是质量信息,与第2行的碱基序列是一一对应的,其中的每一个符号对应的ASCII值是经过换
- 金域医学:医检行业顶级学术委员会成立,钟南山院士任主席
里昂杰森
4位院士领衔23位顶级专家加盟,金域医学“最强大脑”助力中国医学检验2017年12月1日,国内第三方医学检验行业的开拓者和引领者广州金域医学检验集团在广州国际生物岛总部,召开金域医学学术委员会成立大会暨金域学术汇报会由呼吸系统疾病专家、中国工程院院士钟南山出任委员会主席,医学遗传学家、中国工程院院士曾溢滔,生物信息学家、中国科学院院士陈润生,以及我国著名肾脏病专家、中国科学院院士侯凡凡出任委员会顾
- 机器学习系列——(十九)层次聚类
飞影铠甲
机器学习机器学习聚类人工智能
引言在机器学习和数据挖掘领域,聚类算法是一种重要的无监督学习方法,它试图将数据集中的样本分组,使得同一组内的样本相似度高,不同组间的样本相似度低。层次聚类(HierarchicalClustering)是聚类算法中的一种,以其独特的层次分解方式,在各种应用场景中得到广泛应用,如生物信息学、图像分析、社交网络分析等。一、概述层次聚类算法主要分为两大类:凝聚的层次聚类(AgglomerativeHie
- 东南大学-生物信息学
wangchuang2017
http://www.lmbe.seu.edu.cn/chenyuan/xsun/bioinfomatics/Web/Index.html目录image第1章生物信息学引论第2章生物信息学的生物学基础第3章序列比较第4章生物分子数据库第5章基因组信息分析第6章系统发生分析第7章蛋白质结构预测第8章基因表达数据分析附录常用基本词汇表
- TCGA新版数据库表达矩阵提取
医学和生信笔记
本文首发于公众号:医学和生信笔记医学和生信笔记,专注R语言在临床医学中的使用,R语言数据分析和可视化。主要分享R语言做医学统计学、meta分析、网络药理学、临床预测模型、机器学习、生物信息学等。现在使用TCGAbiolinks下载转录组数据后,直接是一个SummarizedExperiment对象,这个对象非常重要且好用。因为里面直接包含了表达矩阵、样本信息、基因信息,可以非常方便的通过内置函数直
- R语言可视化学习笔记之ggridges包
生信宝典
R生物信息生物信息可视化
作者:严涛浙江大学作物遗传育种在读研究生(生物信息学方向)伪码农,R语言爱好者,爱开源。严涛老师的绘图教程还有:gganimate|诺奖文章里面的动图布局教程来了!!ggplot2学习笔记之图形排列R包ggseqlogo|置换序列分析图ggplot2高效实用指南(可视化脚本,工具,套路,配色)简介ggridges。主要包用来绘制山峦图产品尤其的英文针对时间或者空间分布****可视化。具有十分好的效
- microRNA数据库与预测、功能分析软件大全
Seurat_Satija
在microRNA的研究中,生物信息学发挥越来越重要的作用,以下是microRNA相关的数据库与预测、功能分析软件,绝对值得收藏。1.miRBase:http://www.mirbase.orgmiRBase序列数据库是一个提供包括已发表的miRNA序列数据、注释、预测基因靶标等信息的全方位数据库,是存储miRNA信息最主要的公共数据库之一。miRBase提供便捷的网上查询服务,允许用户使用关键词
- (悬疑 幻想)我 (28) 许益杰的行踪
梦幻泡影1980
魏虹话音刚落,张沃之和樊志滨都不约而同地惊呼道:“死者怎么可能会是王万杰?”“一定就是他!这回我绝不会弄错!上次,就是因为他的死而复生才使我的业务水准备受质疑!可谁能料想,一个被我和拘留所的王法医都鉴定为窒息身亡的犯人居然死而复生了!因此在事发之后,我特意保留了王万杰所有的生物信息。没想到这些数据还真和抛尸案的死者对上了号!”魏虹似乎很有把握。“沃之,这小子不是早就被你们释放了么?为什么他又能在近
- 从列表中删除元素|自学生信Python(第十六天)
天明豆豆
从列表中删除元素Python有从数据结构对象,如列表和字典中去除数据项的函数。写在前面的话:本人是一枚生物学的学生,由于对生物信息学特别感兴趣,于是想自学生物信息学(新手莫怪)。了解到生物信息学要有编程基础,尤其是要会一门编程语言,例如:R语言、Python、Perl等,还要熟悉Linux系统,作为生信小白,听说Python挺简单的,于是就自学了Python,花了两天时间了解了Python的基础语
- jsonp 常用util方法
hw1287789687
jsonpjsonp常用方法jsonp callback
jsonp 常用java方法
(1)以jsonp的形式返回:函数名(json字符串)
/***
* 用于jsonp调用
* @param map : 用于构造json数据
* @param callback : 回调的javascript方法名
* @param filters : <code>SimpleBeanPropertyFilter theFilt
- 多线程场景
alafqq
多线程
0
能不能简单描述一下你在java web开发中需要用到多线程编程的场景?0
对多线程有些了解,但是不太清楚具体的应用场景,能简单说一下你遇到的多线程编程的场景吗?
Java多线程
2012年11月23日 15:41 Young9007 Young9007
4
0 0 4
Comment添加评论关注(2)
3个答案 按时间排序 按投票排序
0
0
最典型的如:
1、
- Maven学习——修改Maven的本地仓库路径
Kai_Ge
maven
安装Maven后我们会在用户目录下发现.m2 文件夹。默认情况下,该文件夹下放置了Maven本地仓库.m2/repository。所有的Maven构件(artifact)都被存储到该仓库中,以方便重用。但是windows用户的操作系统都安装在C盘,把Maven仓库放到C盘是很危险的,为此我们需要修改Maven的本地仓库路径。
- placeholder的浏览器兼容
120153216
placeholder
【前言】
自从html5引入placeholder后,问题就来了,
不支持html5的浏览器也先有这样的效果,
各种兼容,之前考虑,今天测试人员逮住不放,
想了个解决办法,看样子还行,记录一下。
【原理】
不使用placeholder,而是模拟placeholder的效果,
大概就是用focus和focusout效果。
【代码】
<scrip
- debian_用iso文件创建本地apt源
2002wmj
Debian
1.将N个debian-506-amd64-DVD-N.iso存放于本地或其他媒介内,本例是放在本机/iso/目录下
2.创建N个挂载点目录
如下:
debian:~#mkdir –r /media/dvd1
debian:~#mkdir –r /media/dvd2
debian:~#mkdir –r /media/dvd3
….
debian:~#mkdir –r /media
- SQLSERVER耗时最长的SQL
357029540
SQL Server
对于DBA来说,经常要知道存储过程的某些信息:
1. 执行了多少次
2. 执行的执行计划如何
3. 执行的平均读写如何
4. 执行平均需要多少时间
列名 &
- com/genuitec/eclipse/j2eedt/core/J2EEProjectUtil
7454103
eclipse
今天eclipse突然报了com/genuitec/eclipse/j2eedt/core/J2EEProjectUtil 错误,并且工程文件打不开了,在网上找了一下资料,然后按照方法操作了一遍,好了,解决方法如下:
错误提示信息:
An error has occurred.See error log for more details.
Reason:
com/genuitec/
- 用正则删除文本中的html标签
adminjun
javahtml正则表达式去掉html标签
使用文本编辑器录入文章存入数据中的文本是HTML标签格式,由于业务需要对HTML标签进行去除只保留纯净的文本内容,于是乎Java实现自动过滤。
如下:
public static String Html2Text(String inputString) {
String htmlStr = inputString; // 含html标签的字符串
String textSt
- 嵌入式系统设计中常用总线和接口
aijuans
linux 基础
嵌入式系统设计中常用总线和接口
任何一个微处理器都要与一定数量的部件和外围设备连接,但如果将各部件和每一种外围设备都分别用一组线路与CPU直接连接,那么连线
- Java函数调用方式——按值传递
ayaoxinchao
java按值传递对象基础数据类型
Java使用按值传递的函数调用方式,这往往使我感到迷惑。因为在基础数据类型和对象的传递上,我就会纠结于到底是按值传递,还是按引用传递。其实经过学习,Java在任何地方,都一直发挥着按值传递的本色。
首先,让我们看一看基础数据类型是如何按值传递的。
public static void main(String[] args) {
int a = 2;
- ios音量线性下降
bewithme
ios音量
直接上代码吧
//second 几秒内下降为0
- (void)reduceVolume:(int)second {
KGVoicePlayer *player = [KGVoicePlayer defaultPlayer];
if (!_flag) {
_tempVolume = player.volume;
- 与其怨它不如爱它
bijian1013
选择理想职业规划
抱怨工作是年轻人的常态,但爱工作才是积极的心态,与其怨它不如爱它。
一般来说,在公司干了一两年后,不少年轻人容易产生怨言,除了具体的埋怨公司“扭门”,埋怨上司无能以外,也有许多人是因为根本不爱自已的那份工作,工作完全成了谋生的手段,跟自已的性格、专业、爱好都相差甚远。
- 一边时间不够用一边浪费时间
bingyingao
工作时间浪费
一方面感觉时间严重不够用,另一方面又在不停的浪费时间。
每一个周末,晚上熬夜看电影到凌晨一点,早上起不来一直睡到10点钟,10点钟起床,吃饭后玩手机到下午一点。
精神还是很差,下午像一直野鬼在城市里晃荡。
为何不尝试晚上10点钟就睡,早上7点就起,时间完全是一样的,把看电影的时间换到早上,精神好,气色好,一天好状态。
控制让自己周末早睡早起,你就成功了一半。
有多少个工作
- 【Scala八】Scala核心二:隐式转换
bit1129
scala
Implicits work like this: if you call a method on a Scala object, and the Scala compiler does not see a definition for that method in the class definition for that object, the compiler will try to con
- sudoku slover in Haskell (2)
bookjovi
haskellsudoku
继续精简haskell版的sudoku程序,稍微改了一下,这次用了8行,同时性能也提高了很多,对每个空格的所有解不是通过尝试算出来的,而是直接得出。
board = [0,3,4,1,7,0,5,0,0,
0,6,0,0,0,8,3,0,1,
7,0,0,3,0,0,0,0,6,
5,0,0,6,4,0,8,0,7,
- Java-Collections Framework学习与总结-HashSet和LinkedHashSet
BrokenDreams
linkedhashset
本篇总结一下两个常用的集合类HashSet和LinkedHashSet。
它们都实现了相同接口java.util.Set。Set表示一种元素无序且不可重复的集合;之前总结过的java.util.List表示一种元素可重复且有序
- 读《研磨设计模式》-代码笔记-备忘录模式-Memento
bylijinnan
java设计模式
声明: 本文只为方便我个人查阅和理解,详细的分析以及源代码请移步 原作者的博客http://chjavach.iteye.com/
import java.util.ArrayList;
import java.util.List;
/*
* 备忘录模式的功能是,在不破坏封装性的前提下,捕获一个对象的内部状态,并在对象之外保存这个状态,为以后的状态恢复作“备忘”
- 《RAW格式照片处理专业技法》笔记
cherishLC
PS
注意,这不是教程!仅记录楼主之前不太了解的
一、色彩(空间)管理
作者建议采用ProRGB(色域最广),但camera raw中设为ProRGB,而PS中则在ProRGB的基础上,将gamma值设为了1.8(更符合人眼)
注意:bridge、camera raw怎么设置显示、输出的颜色都是正确的(会读取文件内的颜色配置文件),但用PS输出jpg文件时,必须先用Edit->conv
- 使用 Git 下载 Spring 源码 编译 for Eclipse
crabdave
eclipse
使用 Git 下载 Spring 源码 编译 for Eclipse
1、安装gradle,下载 http://www.gradle.org/downloads
配置环境变量GRADLE_HOME,配置PATH %GRADLE_HOME%/bin,cmd,gradle -v
2、spring4 用jdk8 下载 https://jdk8.java.
- mysql连接拒绝问题
daizj
mysql登录权限
mysql中在其它机器连接mysql服务器时报错问题汇总
一、[running]
[email protected]:~$mysql -uroot -h 192.168.9.108 -p //带-p参数,在下一步进行密码输入
Enter password: //无字符串输入
ERROR 1045 (28000): Access
- Google Chrome 为何打压 H.264
dsjt
applehtml5chromeGoogle
Google 今天在 Chromium 官方博客宣布由于 H.264 编解码器并非开放标准,Chrome 将在几个月后正式停止对 H.264 视频解码的支持,全面采用开放的 WebM 和 Theora 格式。
Google 在博客上表示,自从 WebM 视频编解码器推出以后,在性能、厂商支持以及独立性方面已经取得了很大的进步,为了与 Chromium 现有支持的編解码器保持一致,Chrome
- yii 获取控制器名 和方法名
dcj3sjt126com
yiiframework
1. 获取控制器名
在控制器中获取控制器名: $name = $this->getId();
在视图中获取控制器名: $name = Yii::app()->controller->id;
2. 获取动作名
在控制器beforeAction()回调函数中获取动作名: $name =
- Android知识总结(二)
come_for_dream
android
明天要考试了,速速总结如下
1、Activity的启动模式
standard:每次调用Activity的时候都创建一个(可以有多个相同的实例,也允许多个相同Activity叠加。)
singleTop:可以有多个实例,但是不允许多个相同Activity叠加。即,如果Ac
- 高洛峰收徒第二期:寻找未来的“技术大牛” ——折腾一年,奖励20万元
gcq511120594
工作项目管理
高洛峰,兄弟连IT教育合伙人、猿代码创始人、PHP培训第一人、《细说PHP》作者、软件开发工程师、《IT峰播》主创人、PHP讲师的鼻祖!
首期现在的进程刚刚过半,徒弟们真的很棒,人品都没的说,团结互助,学习刻苦,工作认真积极,灵活上进。我几乎会把他们全部留下来,现在已有一多半安排了实际的工作,并取得了很好的成绩。等他们出徒之日,凭他们的能力一定能够拿到高薪,而且我还承诺过一个徒弟,当他拿到大学毕
- linux expect
heipark
expect
1. 创建、编辑文件go.sh
#!/usr/bin/expect
spawn sudo su admin
expect "*password*" { send "13456\r\n" }
interact
2. 设置权限
chmod u+x go.sh 3.
- Spring4.1新特性——静态资源处理增强
jinnianshilongnian
spring 4.1
目录
Spring4.1新特性——综述
Spring4.1新特性——Spring核心部分及其他
Spring4.1新特性——Spring缓存框架增强
Spring4.1新特性——异步调用和事件机制的异常处理
Spring4.1新特性——数据库集成测试脚本初始化
Spring4.1新特性——Spring MVC增强
Spring4.1新特性——页面自动化测试框架Spring MVC T
- idea ubuntuxia 乱码
liyonghui160com
1.首先需要在windows字体目录下或者其它地方找到simsun.ttf 这个 字体文件。
2.在ubuntu 下可以执行下面操作安装该字体:
sudo mkdir /usr/share/fonts/truetype/simsun
sudo cp simsun.ttf /usr/share/fonts/truetype/simsun
fc-cache -f -v
- 改良程序的11技巧
pda158
技巧
有很多理由都能说明为什么我们应该写出清晰、可读性好的程序。最重要的一点,程序你只写一次,但以后会无数次的阅读。当你第二天回头来看你的代码 时,你就要开始阅读它了。当你把代码拿给其他人看时,他必须阅读你的代码。因此,在编写时多花一点时间,你会在阅读它时节省大量的时间。
让我们看一些基本的编程技巧:
尽量保持方法简短
永远永远不要把同一个变量用于多个不同的
- 300个涵盖IT各方面的免费资源(下)——工作与学习篇
shoothao
创业免费资源学习课程远程工作
工作与生产效率:
A. 背景声音
Noisli:背景噪音与颜色生成器。
Noizio:环境声均衡器。
Defonic:世界上任何的声响都可混合成美丽的旋律。
Designers.mx:设计者为设计者所准备的播放列表。
Coffitivity:这里的声音就像咖啡馆里放的一样。
B. 避免注意力分散
Self Co
- 深入浅出RPC
uule
rpc
深入浅出RPC-浅出篇
深入浅出RPC-深入篇
RPC
Remote Procedure Call Protocol
远程过程调用协议
它是一种通过网络从远程计算机程序上请求服务,而不需要了解底层网络技术的协议。RPC协议假定某些传输协议的存在,如TCP或UDP,为通信程序之间携带信息数据。在OSI网络通信模型中,RPC跨越了传输层和应用层。RPC使得开发