Nature:中科院先进院发现空间扩展生境定殖的进化稳定性策略
文章目录
- 一种生物扩张栖息地的进化稳定策略
-
- 导读
- 摘要
- 正文
-
- **图1.基于位置选择的实验进化**
- 两株菌在空间上的竞争
- **图2.空间中的竞争扩张**
- 竞争扩张的动力学建模
- **图3.三株菌间的竞争与稳定距离**
- 进化稳定的策略
- **图4.竞争动力学的稳定基线**
- 稳定性准则的验证
- **图5.进化稳定性线的验证**
- 方法
-
- 培养基与生长条件
- 菌株和质粒构建
- 进化实验过程
- 扩张速度测量
- 生长速度测量
- 竞争试验
- 实时定量RT–PCR
- 单细胞追踪
- 全基因组测序和分析
- 竞争动力学和进化的数值模拟
- Reference
- 猜你喜欢
- 写在后面

一种生物扩张栖息地的进化稳定策略
An evolutionarily stable strategy to colonize spatially extended habitats
Nature [IF:43.07]
6 November 2019 Article
DOI: https://doi.org/10.1038/s41586-019-1734-x
第一作者:Weirong Liu(刘为荣)1,2,Jonas Cremer3,4
通讯作者:Terence Hwa(华泰立)([email protected])3* & Chenli Liu( 刘陈立)([email protected])1,2*
合作作者: Dengjin Li(李登进)
[外链图片转存失败,源站可能有防盗链机制,建议将图片保存下来直接上传(img-SzGux0DE-1575167742479)(http://210.75.224.110/Note/MaTengFei/191106Nature/author.jpg)]
由左至右:李登进(共同作者) 刘陈立(通讯作者) 刘为荣(共同第一作者)
主要单位:
1 中国科学院深圳先进技术研究院(CAS Key Laboratory of Quantitative Engineering Biology, Shenzhen Institute of Synthetic Biology, Shenzhen Institutes of Advanced Technology, Chinese Academy of Sciences, Shenzhen,
People’s Republic of China)
2中国科学院大学(University of Chinese Academy of Sciences, Beijing, People’s Republic of China)
3美国加州大学圣地亚哥分校(Department of Physics, University of California San Diego, La Jolla, CA, USA)
导读
世间万物究竟是造物主的杰作,还是物竞天择的结果?一个受精卵分裂出的40万亿细胞是如何有序形成各个组织器官,并最终发育为完整人体的?同一片森林里的上百种生物是如何抢占生存空间,以构成复杂而稳定的生态系统的?尽管进化论指出了生命的演化规律和发展方向,但多细胞生物的“按需制造”原理尚未知晓,“物竞天择”也难以解释同一环境下的物种多样性。中国科学院深圳先进技术研究院、深圳合成生物学创新研究院刘陈立研究员实验室,与加州大学圣地亚哥分校华泰立教授团队合作,用一个公式“算”出了这一生命发展的本质规律。
摘要
一个物种定殖于新栖息地的能力对其整体适应能力至关重要。一般来说,运动性和快速扩张被认为有利于定殖,因此有利于生物体的适应性。在此,我们应用一个进化方案来研究趋化细菌在扩张过程中对定殖不同大小栖息地的表型需求。与直觉预期的‘越快越好’相反,我们证明了对于给定大小的栖息地,存在一个最优扩张速度。我们的分析表明,这种效应来自于不断扩大的种群前端先锋细胞之间的相互作用,并揭示了对于在特定大小栖息地进行定殖的一种简单的、进化上稳定的策略:以生长速度和栖息地大小的乘积的速度扩张。这些结果表明,在复杂的生态过程中,稳定性入侵是选择表型的一个强有力的原则。
正文
当有机体遇到无人居住的栖息地时,它通过生长和扩张来定殖于栖息地。最近一项研究定量研究了细菌趋化作用,结果表明种群扩展主要是由种群前端存在的一群先驱性细胞主导;这些先驱者向外移动,复制,并留下后代(定居者)来成长和占领所经过的区域 (补充图1a, b, 补充视频 1)。为了了解前端后方定殖的决定因素,我们修改了常用的实验进化方案选择了从靠近前端到最初接菌点之间不同距离的细胞,然后接种在半固体胰蛋白酶培养基(TB)琼脂平板中心,给予时间使其向外扩张并在整个平板上定殖。接种后24小时,当整个板子被细菌长满后,在离中心相同距离的地方采集取一定半径的小块琼脂(约含7.4×106个细胞),直接转移到新鲜平板中心(图1a)。这个过程重复了50次
(约600代)。在离原点5个不同的距离产生了5个这样的系列(补充图1c中的位置A–E)。
[外链图片转存失败,源站可能有防盗链机制,建议将图片保存下来直接上传(img-EyH18Qie-1575167742480)(http://210.75.224.110/Note/MaTengFei/191106Nature/1.jpg)]
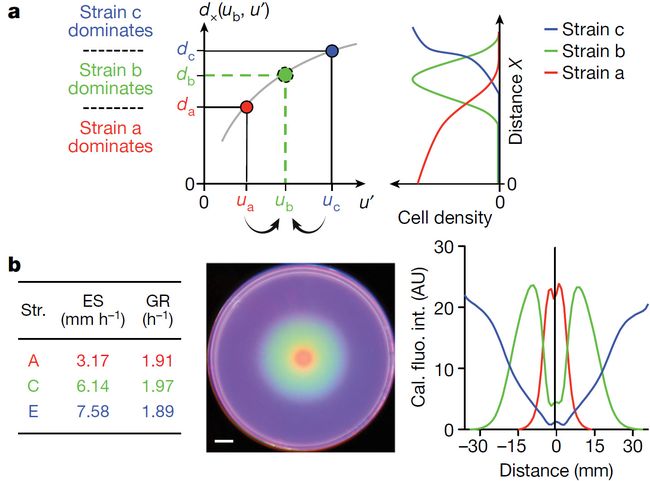
图1.基于位置选择的实验进化
Fig 1: Experimental evolution with position-dependent selection.
a:进化实验的示意图。在0.25% TB的琼脂平板中心接种指数生长期大肠杆菌CLM细胞28(祖先);37℃培养24小时后,细菌在整个培养皿中定殖。在距离板子中心X的距离取2-μl 细胞-琼脂混合物并将其接种到一个新板子的中心(详见材料方法)。在24小时后,按照上一周期相同的距离X采集样本,重复该周期。b:从第一代开始,五个不同位置采集的大肠杆菌细胞展现了不同的扩张速度。实验重复三次,结果相似(见 补充图2)。c:在第50个周期,从种群样本中分离出300个单克隆(来自五个距离的继代细胞,每种60个)的扩增速度。每个系列的直方图用相应的颜色表示。不同细胞在第50个循环时混合种群的平均扩展速度(E补充图 1d)以虚线表示,以供比较。在第50个周期分离得到6个突变株(株A、B、B、C、D、E)及其祖先的扩增速度明显差异。祖先扩展速度类似混合种群的平均扩张速度。
我们首先评估了采集在不同周期和位置的细胞的生长和扩张特性。当接种在新的TB板上时,进化后的种群仍稳定地向外扩张(补充图1d), 且细胞扩展速度与细胞采集距离有明显的依赖关系(图1b)。在整个进化过程中,从外径收集的种群扩张速度稳定的增加,而从内径收集到的样本扩张速度稳定降低,选子中间距离的细胞(位置C,距离Xc = 15mm),在此范围内,进化种群的扩张速度在祖先速度附近(约6mm h-1)上下波动。这些结果在重复及补充有不同的氨基酸培养基中具有很高的可重复性(Extended Data Fig. 2a–c)。得到的进化扩张速度的发散模式(图1b)不是简单地权衡细胞生长速度的结果,随着分批培养的进行,在TB中进化的菌株的生长速率变化不大 (Extended Data Fig. 1e)。在酪蛋白氨基酸(CAA)中进化的菌株通常表现出比祖先更高的生长速度(补充图1f, g);但是,根据它们的选择位置,它们的扩展速度的变化仍然遵循发散的模式(补充图2c)。相比之下,无论菌株在甘油和无趋化剂的培养基中的选择位置如何,其扩张速度都会加快 (Extended Data Fig. 2d), 说明趋化性对于图1所示的发散进化现象是重要的。
对来自5个进化系列的第50个周期的300个菌株进行了3个重复的检测,结果显示,通过对之前混合种群样品的测试,可以很好地反映单个菌株的扩散速度分布(图1c)。此外,扩张速度的变化与从单细胞分析得到的进化细胞运动特征的变化是一致的(补充图1h, i),并与基因组序列分析鉴定的突变一致。每个进化序列第50个周期的种群样本测序产生了大量的突变(补充表格1)。几个显性突变被单独引入到祖先菌株中;研究发现,这些基因改变了祖先菌株向衍生出突变进化菌株的扩展速度(补充图1j)。
两株菌在空间上的竞争
Two-strain competition in space
为了理解潜在的进化过程,我们首先比较了单克隆种群的扩张动态。我们选择了几个在第50个周期分离出的突变株,它们表现出一定的扩张速度,但生长速度相似(A, B, B′, C, D,和 E 图1c; see Supplementary Table 2)。我们用GFP标记菌株,并通过直接细胞计数校准它们的荧光强度(Extended Data Fig. 3a–c)。这使得可以直接观察每个菌株密度分布的时空动态 (Extended Data 图4a–c 分别为祖先菌,突变菌株B,突变菌株D)。显然,扩展速度更快的菌株在所有位置和时间都表现出更高的丰度。
接下来,我们将每个突变株与祖先株进行竞争。我们用GFP的非荧光突变基因同样标记了这些菌株,确保每个菌株都具有与荧光GFP相同的生长速率和扩张速度 (Extended Data Fig. 3a–f)。将突变株和祖先菌株两两组合分别均匀混合接种于琼脂平板中心,并对其时空丰度模式进行了描述(见方法)。图2a显示了接种12小时后D突变体与祖先竞争的结果。值得注意的是,这两种菌株主导不同的区域:祖先(紫色)主导了内部,而突变体D(青色)主导了外部。而突变体B与祖先之间的竞争过程(图2b)却出现了相反的情况,B菌株主导了内部,而祖先控制主导了外部。如图2c, d 中着色实线所示,校准后荧光强度的比值,与细胞计数得到的进化细胞密度相对于祖先的比值W(突变株相对适应度的直接量度)(图2c, d中的圆圈)吻合较好 (Extended Data Fig. 4f) 。在经过大约24小时的竞争过程后,突变株相对适应度是稳定的。(Extended Data Fig. 4g–j)。
[外链图片转存失败,源站可能有防盗链机制,建议将图片保存下来直接上传(img-2jJiNdJB-1575167742481)(http://210.75.224.110/Note/MaTengFei/191106Nature/2.jpg)]
[外链图片转存失败,源站可能有防盗链机制,建议将图片保存下来直接上传(img-QfuLuzfL-1575167742482)(http://210.75.224.110/Note/MaTengFei/191106Nature/2b.jpg)]
图2.空间中的竞争扩张
Fig 2 : Competitive expansion in space.
**图a, b,**扩张速度和增长率(上),代表祖先(anc.;紫色)和突变株(str.),D (a,青色)和B(b,橙色)中的两株荧光衍生物竞争的合成伪彩色图像(中)和细胞密度剖面(下)。Cal. fluo. int.:校准的荧光强度。合并前的原始图像和荧光强度曲线见扩展数据图4d, e,方法中有竞争实验的详细说明。菌株详情见补充表2。标尺,10毫米。在0.25% TB琼脂平板中心,将两种竞争菌株的相同初始混合物共接种12小时后采集数据。数据显示了三次生物重复的平均值。图c, d, 菌株的相对适应度Wi i = {D, B} (相对于祖先),在这里定义为细胞密度在不同位置的比率。彩色实线作为荧光密度谱的比值被显示在补充数图4d, e(下)。开放的圆圈表示直接细胞计数的比率(Extended
Data Fig. 4f)。彩色虚线表示突变体和祖先之间的荧光比率,彩色虚线表示突变体与祖先在同一琼脂平板的中心上分别接种后12小时后的荧光比值;结果源于扩展数据图4b。**图e,**圆圈表示祖先与五个进化株竞争的交叉距离(Extended Data Fig. 4k–m),根据各自的扩张速度绘制(exp. sp.) (Extended Data Fig. 3b)。虚线垂直线表示祖先的扩展速度。在菌株C与祖先的竞争中,它们的扩展速度非常接近,其相对适应度难以确定(Extended Data Figs. 3b, 4k–m)。交叉距离上下区域的背景颜色表示祖先(蓝色)或突变体(mut.;绿色)占主导地位。f,白线表示两株扩张速度为u和u’的竞争扩张模型(补充模型)的交叉距离,u(祖先速度)固定(虚线垂直线),u’(竞争突变速度)变化。背景色再次显示了两个菌株的优势区域。菌株主导的区域根据一个简单的规则即当X > dx时由快的菌株主导,当X < dx由慢的菌株主导。
菌株B比祖先扩张得慢,而菌株D扩张得快(图1c),竞争结果表明,更慢的菌株主导内部,更快的菌株主导外部。这与单菌株扩张动力学中细胞密度的比例形成了鲜明的对比(图2c, d中的彩色虚线,引自图4b中的补充数据),这显示出了更快扩张的菌株优势。因此,只有当较慢的菌株存在时,较快的菌株才会在内部处于不利地位,这表明了潜在进化过程的“游戏”性质。也就是说,一个菌株在一个地方的适合度取决于竞争菌株的存在和能动性。
竞争扩张的动力学建模
Modelling competitive expansion dynamics
为了更深入地了解竞争动力学,我们建立了一个细菌种群扩张的数学模型,根据已经明确的分子互作指标评估随机和定向移动效应在细胞生长过程中的作用。(补充图5a)。该模型定量准确地描述了平板上单个菌株的扩张动力学(补充图5b, c)。我们扩展了这个模型来描述两个菌株之间的竞争,假设它们对相同的趋化剂做出反应,并以速率生长相同(补充图6a),通过表征趋化性的不同参数来模拟不同的扩展速度(参见补充模型细节和补充视频2中例 dynamics)。该模型捕捉了长时间后观察到的慢菌株和快菌株的空间优势格局(补充图 6b),以及交叉距离dx的时间依赖性(补充图6c)。有利于慢速菌株在更小距离上占优势的因素是由于来自种群前端的前缘细胞的生长、前进和反向繁殖之间的平衡转移(补充图7, 补充分析 1)。利用这种竞争性扩张模式,我们系统地计算了在两种菌株相等的初始混合物之间的竞争结果,改变一个菌株(突变体,速度为u,)的扩展速度,而保持另一个菌株(祖先品系,速度为u)的扩展速度不变。图2f为从竞争中获得的交叉距离d×(u, u’)及结果相图,与实验观察结果相似 (图2e, Extended Data Fig. 3m)。
利用竞争扩张模型探讨了三种菌株的空间优势依赖关系.考虑三株(a, b, c)中单株的扩张速度ua, ub, uc,使ua < ub < uc。在三个菌株的竞争中,找出菌株b的优势区域。分别来自菌株a-b和b-c之间的两株菌的交叉距离da = dx(ub, ua)和dc = dx(ub, uc)。图3a中的插图清楚地表明菌株b将在da
< d < dc)区域占主导地位。这是通过以不同扩张速度直接竞争的三株菌在实验中得到了验证的(即图3b菌株A、C、E)。因此,从两对菌株竞争的结果中可以正确地预测三株菌竞争的结果(尤其是以交叉距离的形式)。接下来,我们证明这个简单的结果可以推广到预测(如图1所示的)进化实验的结果。
图3.三株菌间的竞争与稳定距离
Fig 3 : Three-strain competition and stability distance.
a,具有u和u,速度的两个竞争菌株的交叉距离dx(u, u,)编码了关于竞争扩展动态的重要信息。我们通过考虑三个菌株(a、b、c)的单菌株扩展速度ua、ub、uc来说明这一点。为了观察菌株b的优势扩张区域,我们画出了交叉距离dx(u, u,)对u,其中(u = ub)。红点表示菌株a与b的交叉距离da, da = dx(ub, u,= ua)。同理,蓝点表示菌株b与菌株c的交叉距离dc = dx(ub, u,= uc)。根据交叉距离的定义,菌株a(比菌株b慢)在d < da处占主导,菌株c(比菌株b快)在d>dc处占主导。因此存在菌株b主导的区域da
进化稳定的策略
An evolutionarily stable strategy
为了与这些进化实验联系起来,这些实验可能涉及到许多具有连续扩张速度的菌株,让我们先考虑一下理论上的极限ua→ub 与 uc→ub(图3a中的黑色箭头)。在这种情况下,菌株b占主导地位的区域会被挤压,并在一个特殊的距离附近狭窄地分布,db=limu’→ubdx(ub, u,),速度为ub的菌株以这样的距离优于其他菌,即使它们的速度存在的差异小。由于菌株b和它的速度没有不同,这种考虑提出了一个更普遍的结果:即对于具有单菌株扩展速度为u的菌株,存在一个具体的距离
[外链图片转存失败,源站可能有防盗链机制,建议将图片保存下来直接上传(img-2NJvRW3t-1575167742484)(http://210.75.224.110/Note/WenTao/sup1.png)]
在这个距离上没有其他速度不同的菌株可以主导。
鉴于图4a所示的交叉距离形式,由式(1)定义的对角线d*(u)(粉色虚线)与u呈线性关系,如图4b所示。这个简单的结果得到了更详细的数学分析的支持(补充分析1, 2), 进一步预测,d* 对于u的斜率将与增长率λ成反比:
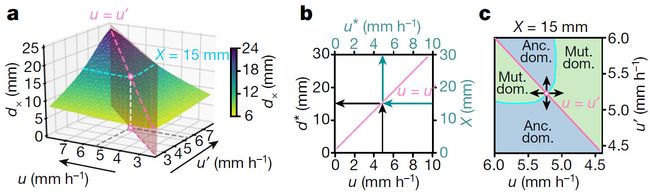
图4.竞争动力学的稳定基线
Fig 4 : Stability line of the competition dynamics.
在生长-扩张模型下,膨胀速度(u, u , )成对组合的竞争结果 (补充图5, 6).a,交叉距离为d x(u,u,)时,两种菌株同样丰富(绿色表面)。图3a中表明,对角线(u=u,处的粉色虚线)给出了具有祖先速度u 菌株的稳定距离d* 。b, d*(u)是线性关系,被称为稳定线。这条线有一个正交的解释:顺着绿色箭头,它给出了将在X位置选择的扩展速度u*。为了验证这个正交视图,我们注意到,在给定的距离,例如,X = 15mm,有一组扩展速度组合,其交叉距离对应于这个距离(d x = X, a中的青色线)。这组中有一个不同的速度u *用白色表示,对应的是两个竞争菌株的膨胀速度接近dx的极限值,数学上定义为db=limu,u’→u *dx(u, u,)。c,具有这种特殊扩展速度u *(X)的菌株在距离X处对不同速度的突变体是稳定的,根据菌株优势模式显示:正如图2f中的那样,平板中不同的区域以相同的方式分布。对于u
u’,‘祖先菌株’在a中低于X的绿色表面占主导地位,“突变体”占据了X以上的绿色表面区域;对于u < u,,反之亦然。膨胀速度u *(X)位于相界(青色线)与对角线相交处。在这里,如果一个菌株的速度增加或减少(箭头),那么当另一个菌株占主导地位时,就选择它。通过对不同生长速度下竞争扩张模型的数值模拟,验证了这种形式(E补充图6d, e)。
到目前为止,方程(1)和(2)表示菌株与竞争菌株在它的50:50初始混合物中的优势度。为了将这些多菌株竞争的结果应用到进化动力学中,其中突变可能以非常低的概率产生,对于较低概率的竞争菌株,需要重新计算交叉距离dx(u, u,)。然而,正如我们在扩展数据图8中所示,对于两个具有相似扩展速度的菌株,它们的交叉距离与竞争对手的频率无关。因此,(2)式可以应用于包含任意小频率菌株的竞争,包括自发突变。因此,式(1)和式(2)描述了一个演化稳定性判据,由式(2)可知,在d* (u)位置,扩张速度为u的菌株在不同扩张速度突变体的入侵下是稳定的。因此,我们称d**为稳定距离,称d* *(u)为稳定线。
实际的选择实验(图1)与刚刚描述的进化稳定性判据略有不同:在给定的选择距离X下,什么速度u *(X)最合适?是(2)式的数学反演:
u * X ( ) ∝ Xλ (3)
这一结果可以通过检查图4a的交叉景观切片得到,对于dx(u u ,) = X,如图4c所示。选择的稳定速度为dx(u u ,) = X (青色线)与对角线(u = u ,,粉色线)的交点,由圆表示,为速度偏离交点的菌株(黑色箭头);详见图例。在稳定线图中(图4b),我们添加了茶色的二级轴:在给定的距离X下,选择的速度u*(X)是通过遵循蓝绿色箭头得到的,而对于给定速度u的菌株,其稳定距离是通过遵循黑色箭头得到的。
稳定性准则的验证
Validation of the stability criterion
为了测试预测的稳定性线(方程(2),(3)),我们设计了两套额外的进化实验,用于提供改变祖先扩张速度和生长速率的生长条件。首先,我们使用相同的生长培养基(TB),但不同的琼脂密度,重复图1a所示的进化方案。这改变了细胞的有效扩散常数,在不影响生长速度的情况下,产生了一个范围内的扩张速度(紫色方块,图5a)。5种琼脂密度、5个选择距离和不同重复的进化结果具有很高的可重复性 (补充图9a)。从进化的扩展速度,我们确定了每个琼脂密度的稳定选择距离(补充图9b,
c)。正如预测的那样,得到的稳定距离与预测的祖先的扩张速度呈线性关系(图5b)。
[外链图片转存失败,源站可能有防盗链机制,建议将图片保存下来直接上传(img-TIYk3oF6-1575167742486)(http://210.75.224.110/Note/MaTengFei/191106Nature/5.jpg)]
图5.进化稳定性线的验证
Fig 5 : Validation of the evolutionary stability line.
a,通过在0.2-0.3%范围内改变琼脂密度,可以改变祖先菌株的扩增速度。结果表明,TB和CAA均为营养源。b,扩展数据图9b, c中为不同琼脂密度下的稳定性距离d *的估计值;展示三个重复的结果。粉色线,线性拟合。c-e,每五个进化周期的扩张速度(图1b)绘制在每个选择距离(XA,…,XE)上,琼脂密度为0.3% ©, 0.25% (d)和0.2% (e)。粉色线是b中获得的进化动力学的期望稳定吸引因素。f,为对于三次重复中的每一个在CAA中对于每个琼脂密度的稳定距离估计。棕色线,线性拟合。斜率比粉色线(从b开始对于TB)更陡,正如预测那样CAA的增长率更慢。在a中,n = 3个的生物学上独立重复的平均值被显示出来(s.d.误差线比符号小)。c-e实验独立重复三次,结果相似(补充图9)。
接下来,我们用图5c-e中三种不同琼脂浓度数据的稳定线绘制了不同进化周期的扩张速度(扩展数据图9a中的数据)。将稳定线解释为对应选择距离X处的稳定扩张速度*u**(X)(图4b),每个进化系列的数据
(相同颜色的符号)被视为接近预测的最终稳定值。
然后我们在不同的选择距离和琼脂浓度下,在支持大约50%的慢生长培养基中再次重复所有的进化实验(CAA;棕色方块
扩展数据图9d)。进化菌株的扩展速度(扩展数据图9e)显示了类似与在TB中获得的变化模式(补充图 9a)。不同祖先扩张速度下得到的稳定距离(图5f)也与预测的线性关系一致,斜率增加约70%,与式(2)中细胞生长速度的依赖性一致。
为了探讨稳定扩张速度的一般性及其与线性尺寸的相关性,我们利用竞争扩张模型的多菌株泛化研究了生物信息学中的另一种选择模式(补充分析 5)。在这种选择模式下,在一定大小的栖息地中,一小部分细胞被重复地繁殖到下一个周期;参见扩展数据图10a。仅仅经过几个周期的模拟,种群的平均扩张速度就根据栖息地的大小而不同,更大的或更小的栖息地分别由扩张速度更快或更慢的物种决定。(补充图 10b)。这与我们在固定距离的进化实验中观察到的选择趋势一致(图1),尽管二维加权和边缘效应的存在使得较慢的物种需要更多的周期来主导更小的栖息地 (补充图10c, d)。因此,这里研究的空间竞争和进化场景的结果对选择过程的具体实施具有鲁棒性,并且可能适用于资源斑块有限的环境中的种群(例如,营养的热区或受限制的物理地形)。
依赖于种群组成的适应性效应在自然进化中是普遍存在的。由这些效应产生的复杂动力学在早期就以简单进化博弈的形式进行了理论研究;最近的实验研究也考虑了合成微生物种群的合成依赖繁殖后果(补充图 8)。正如于图4c所示的主导模式类似于游戏的收益矩阵,即扩张速度是玩家所采取的策略。青色稳定线可以看作是这个游戏的共存点集合。值得注意的是,这种涉及空间选择和适应度组成依赖关系的高度复杂的博弈可以随着对不同环境中所选择的表型定量预测通过确定复杂动力学的稳定平衡进行定量细节地阐明。由于没有固定的适应度景观用来“攀爬”,从绝对意义上说,进化过程的赢家并不是最适者生存的,而是最简单的那些抗突变体入侵的稳定基因。这为解决自然界中其他复杂的进化问题提供了一个新的视角,在这些问题中,依赖成分的效应无处不在。
方法
Methods
培养基与生长条件
Media and growth conditions
TB培养基每升含有10克蛋白胨和5克氯化钠。M9补充培养基基于Knight实验室的配方:1×M9盐,0.2%酪氨酸,2 mM MgSO4, 0.1 mM CaCl4,碳源为0.4% (v/v)甘油。将M9盐制备为5×M9盐原液(1L):Na2HPO4 30 g, KH2PO4 15 g, NH4Cl 5.0 g, NaCl 2.5 g。本研究中使用的Luria-Bertani (LB)培养基每升含有2.5 g酵母提取物、5g蛋白胨和5g NaCl。在所有的扩张实验中,将bacto-agar (BD, 214010)加入生长培养基中,琼脂浓度变化范围在0.2% ~ 0.3% (w/v)之间。为制备半固体琼脂,上述生长培养基用0.1 M HEPES (ph8.0)缓冲至pH8.0, pH变化小于0.3。然后,将上述培养基中的10毫升加入不同浓度的琼脂,倒入90毫米的培养皿中,在室温下冷却90分钟。除非另有说明,其他试剂均来自Sigma。所有的实验都是在37°C条件下进行。质粒添加100μg/ml氨苄青霉素,50μg /ml卡那霉素、25μg/ml氯霉素,或50μg/ml大观霉素保存。
菌株和质粒构建
Strains and plasmid construction
本研究使用的大肠杆菌CLM菌株的祖先是由A.
Danchin (AMAbiotics、法国)提供。本研究使用的所有菌株列于补充表2。菌株可用。所使用的寡核苷酸列于补充表4。
cheZ-titratable菌株WL1(ΔcheZ, Δlac, bla:Ptet-tetR-cheZ at attB
site)如前所述被构建。总之,bla:Ptet-tetR-cheZ 反馈回路通过使用引物PR29和PR30从pMD19-T0-Amp-T1-Ptet-tetR-cheZ被扩增并在pSIM5的帮助下重新组合从而插入到CL1(ΔcheZΔlac)染色体的attB位点。为了构建cheZ滴定菌株WL2 (ΔcheZ, Δlac, bla:Ptet-tetR-cheZ at attB
site),首次构建了质粒pMD19-T0-Amp-T1-Ptet-tetR-cheZ。简而言之,通过插入来自QL5的带有XhoI和HindIII限制性位点的pcr扩增的Plac - lacl到相应的pMD19-T0-Amp-T1-Ptet-tetR-cheZ 的限制性位点来构建质粒,最后,Ptet-tetR被Plac - lacl - lacl 取代。然后从质粒中扩增出bla:Ptet-tetR-cheZ 反馈回路并通过重新组合插入到attB位点。
衍生出的clpX (G371S, 425Q, P67S)、rcsD (G656V)、cheB (D37E)、mutH (R136C)等位基因使用基于双质粒的CRISPR-Cas9 系统导入到祖先株中,并进行了少量修饰。简而言之,目标轨迹首先通过λ-Red被bla*基因取代,然后通过针对bla基因的CRISPR-Cas9引入进化的等位基因。等位基因交换的程序如下。首先,包含 cas9, λ-Red and sacB的 pCASsac 质粒通过电穿孔进入祖先体内并选择耐卡那霉素的菌株。然后,从pMD19-T0-bla-T1-Ptet-tetR质粒中扩增出含有与T0-PEM7-bla-T1盒每侧目标位点同源的~50 bp序列PCR产物.纯化后的DNA片段用pCASsac通过电穿孔进入祖先株。在源自pCASsac 的λ-Red帮助下将T0-PEM7-bla-T1盒集成到目标位点并选择了抗氨苄青霉素的克隆株。这些细胞经菌落PCR鉴定。使用pTargetF上的引物PCC35和PCC36通过自连接反向PCR,获得靶向bla区域的携带N20的pTargetF- ampr质粒(与靶区互补的20 bp区域)。含有进化等位基因的PCR产物从进化菌株中扩增出来,引物列于附录中表4。携带sgRNA、lacIq-Ptrc启动子的pTargetF-AmpR质粒引导pTarget的PMB1复制以及携带进化等位基因的PCR片段插入携带T0-PEM7-bla-T1盒的目标位点与pCASsac质粒的祖先体内。用菌落PCR和DNA测序方法鉴定了在含卡那霉素和高光霉素的LB琼脂上培养的细胞。最后,构建的菌株均含有pTarget-AmpR和pCASsac质粒。pTarget-AmpR首先通过第二轮基因组编辑被修饰。选择那些能在加有卡那霉素的LB琼脂上生长且未能在加有大观霉素的LB琼脂上生长的细胞。这些细胞被挑选出来置于2 ml含5g/
了葡萄糖的LB培养基中过夜培养;以能在含5g/L葡萄糖和10g/L蔗糖的LB琼脂上生长的细胞为最终菌株。荧光质粒PZA31-Ptet-M2-GFP来自Hwa实验室。为了构建一个功能缺失的非荧光GFP突变体NFP,通过重叠PCR将第66个氨基酸Y突变为C。简而言之,用一对互补引物GFP-Y66C-f和GFP-Y66C-r反向扩增PZA31-Ptet-M2-GFP。PCR产物纯化后,经DpnI处理、凝胶纯化、结扎、然后转化进入DH5α-competent细胞中。通过测序验证质粒。
进化实验过程
Evolution experiment procedures
首先,将祖先菌株划线于琼脂板上,在37°C条件下培养过夜。挑选3-5个单菌落置于2ml相应的生长培养基中,37℃培养过夜。第二步,将过夜的菌液于第二天早上稀释到1:100比例的2毫升预温的新鲜生长培养基中。后将细菌培养到对数生长期(OD600约为0.2-0.3),然后将2μl祖先菌株接种到半固体琼脂板的中心37°C孵化24小时。随着细胞生长和迁移,占据了整个半固态琼脂平板(标记为周期0)。我们从板子的A,B, C, D, E位点挑选2μl 琼脂-细胞混合物(距离接种物半径分别为5、10、15、20、25毫米),然后直接接种到新鲜半固体琼脂板上(相应标记为A、B、C、D或E系列),37℃孵育24小时,标记为周期1。然后挑选2μl 琼脂-细胞混合物(A点从A板,B点从B板,C点从C板,D点从D板,E点从E板),接种到新鲜半固体琼脂板的中心,37℃孵育24小时,标记为周期2。这个过程重复了50个周期。A’、A、B、C、D、F位点(距离接种体半径分别为3、5、10、15、20或35毫米)的细菌在补充了甘油和酪氨酸的M9贫培养基(M9 +甘油+ CAA)中按上述方法传代40~50个周期。对于在半固态LB琼脂平板中进行的进化实验,从位点A’,D,F(半径分别为离半固态琼脂平板中心5、20或35毫米)中挑选2μl细胞琼脂混合物转移到新鲜的半固体琼脂板上。考虑到该培养基中细胞生长速度和扩张速度较快,培养周期缩短到12小时。在添加甘油的M9贫培养基中进行的进化实验,A’、D、F(半径分别为离半固态琼脂平板中心3mm、20mm、35mm)每隔72h转移一次,这个过程重复了30个周期。进化群体的样品在将指定部位的琼脂细胞混合物与40% (v/v)甘油等体积混合后,储存在- 80°C。所有的进化实验都至少进行了三次重复。5×103倍的日生长相当于~12.3(log2[5×103])代翻倍。每一周期的细胞数量通过流式细胞仪计数估计如下:半固体琼脂中迁移24小时后,TB培养基中的细胞密度约为3.54×109/ml, M9 +甘油+ CAA培养基中的细胞密度约为1.93×109/ml。初接种时TB培养基中的细胞密度为7.43×105 / ml, M9 +甘油+ CAA培养基中的细胞密度为4.94×105 / ml。
扩张速度测量
Expansion speed measurement
如之前所述,半固体琼脂平板由一个带着灯箱的圆形白色LED灯排从下照亮,每隔30分钟或1小时使用佳能EOS600D数码相机进行拍摄。图像分析使用ImageJ以及使用MATLAB通过一个自定义的图像分析脚本。将每个图像中的一个圆拟合到最大强度,并确定拟合圆的面积(A)。菌落的半径®通过r = (A/π)1/2计算。最大膨胀速度是通过对至少四个时间点的滑动窗口的线性拟合计算出来的(符合r2大于
0.99)。
生长速度测量
Growth rate measurement
在37°C, 150rpm下,在装有20 ml相应生长培养基的100 ml烧瓶中测定进化菌株的生长速度。过程如下。首先,将从-80°C取出的细菌划线到琼脂平板上,在37°C条件下培养过夜。第二,取3-5个单菌落,接种于相应的2ml生长培养基中,培养过夜。第二天早上,将过夜的培养物稀释至1:100比例的2ml预温培养基中,培养至对数期。将对数期的培养物依次稀释至20 ml预热的生长培养基中,最终的OD600大约是0.02-0.05。使用分光光度计每12分钟(TB)或15分钟(M9)测量一次OD600。至少记录了三次重复。最大生长速率是使用至少五个时间点的滑动窗口的指数拟合来计算的,要求拟合的r2大于0.99。
竞争试验
Competition assay
用一对相互竞争的菌株观察趋化竞争,要么是祖先菌株和一个进化菌株之间的竞争,要么是两个由aTc或IPTG诱导的cheZ-titratable菌株之间的竞争(补充图3) 。为了便于荧光显微镜观察,我们制备了携带表达GFP或NFP质粒的菌株 (补充图 3)。两种质粒组合的每个竞争都被重复(例如,在竞争中执行祖先对A,观察祖先株的生长和扩张通过执行AncG对AN以及执行AncN对AN。通过测定不同位置和不同时间点的每对竞争菌株的荧光强度和细胞数量来表征半固体琼脂中细胞的竞争力。祖先与进化株的竞争实验如下:将分离出的进化株和GFP/ NFP标记的祖先的3~5个单菌落分别培养至对数期(OD600约为0.20)。制备两种混合菌株:有GFP标记的菌株与AncN混合,而有
NFP标记的菌株与AncG以1:1的比例混合。接下来,2μl两种类型的合并后的混合物分别接种到事先准备好半固体琼脂板的中心,使其在37°C条件下生长扩张。扩增后用配备10个相位对比物镜(NA = 0.30)的尼康Ti-E显微镜和anor Zyla 4.2 s CMOS相机对来自这两个板子上扩增后的进化菌株或带GFP报告标记的祖先的荧光强度进行扫描。用荧光强度表征半固体琼脂中的细菌密度。在扩张前后也采集了样品。从半固态琼脂中细菌荧光恒定的固定平面Z轴位置采集图像。每幅图像在平板水平方向1毫米的高度处采集,共采集100幅图像。荧光强度采用ni - elements AR 4.50软件计算。在生长培养基和半固体琼脂中加入不同浓度的aTc和IPTG,按照相同的方法进行不同cheZ-titratable菌株之间的竞争。
荧光强度作为细胞密度的函数校准如下。将AncG、AG、B,G、BG、CG、DG和EG菌株在TB培养基中培养至对数中期;每个菌株的OD600约为0.20。收集共200 ml培养物,并对于每一菌株在含卡那霉素2 mg/ml的TB培养基中将其浓缩至1.6 1010个细胞/mL。然后,用将上述浓缩样品连续稀释至含有2mg/ml卡那霉素的TB培养基中。将稀释后的样品与含2mg/ml卡那霉素的0.277% (w/v)TB琼脂按1:9的比例混合;将10ml细胞-琼脂混合物倒入9厘米的培养皿中,室温固凝固90分钟,并且将100μl cell-agar混合物用流式细胞分析仪进行细胞计数。用荧光显微镜测定上述细胞-琼脂混合板的荧光强度,用于两株菌的竞争实验。然后绘制半固态琼脂中细胞荧光强度与细胞密度的关系。
采用流式细胞仪计数两组细胞的初始和最终比值 (Beckman,Cyto-FLEX)。简而言之,样品首先用预冷细胞计数缓冲液固定(0.9% NaCl, 0.12%甲醛)。随后,在流式细胞仪分析前,根据需要用过滤缓冲液(含DAPI 0.1μg /mL的细胞计数缓冲液)稀释固定样本。最后用流式细胞仪对过滤的样品计数。流速是30μl/分钟,至少收集50000个细胞。将DAPI染色的颗粒视为细菌细胞,通过FITC通道将DAPI阳性的细胞分为两组(GFP和NFP)。菌株i的适应度Wi(相对于祖先)被定义为距离d处的密度(和足够长的时间t)与初始接种密度之比,ρx (d, t) /ρx(0,0),对于祖先相对于相同的比例:LWi(d) = [ρx(d,t)/ρx(0,0)]/[ρanc(d,t)/ρanc(0,0)]。
实时定量RT–PCR
Quantitative real-time RT–PCR
将每个条件下的体积1ml对数期的细菌(OD600 ~ 0.2),立即与2ml RNA保护菌试剂混合(Qiagen)。根据制造商的说明书,使用RNeasy Mini kit (Qiagen)提取总RNA。用NanoDrop 2000c分光光度计检测RNA的产量和纯度(Thermo Scientific),并通过PCR检测,证实了基因组DNA不存在污染。根据制造商的说明,使用带有gDNA Eraser 的PrimeScript RT试剂盒(Takara),逆转录了大约500ng的RNA。没有逆转录酶的反应也被做,将其作为qPCR反应的对照。然后,用pcr专用水按照1:25将cDNA样品稀释,保存在-20℃,直到使用。采用SYBR Premix Ex Taq (Tli RNaseH plus) (Takara)对cDNA进行qPCR扩增。然后将5μl稀释cDNA样品,200nM正向和反向qPCR引物,10μl SYBR Premix Ex Taq,和适量 PCR-grade水混合进入96孔PCR板的孔里至20μl (BIO-RAD)。非模板对照(NTC)(用无菌水代替cDNA模板)用于在每次qPCR实验中检测试剂的纯度。每个反应重复三次。qPCR反应采用Bio-rad CFX connect实时系统,程序如下:95 ℃ 30秒,变性(95℃5 秒)、退火和延伸(60℃30秒)
共进行40个训循环。数据是在延伸步骤结束时获得的。在40个循环结束时进行熔化曲线测试,以检查累积产物的特异性。为计算PCR效率,以连续稀释的cDNA样品为模板,对目标基因进行标准曲线绘制。使用16S rRNA作为参照基因用以标准化表达水平。
单细胞追踪
Single-cell tracking
单细胞追踪按先前描述的方式进行,只做了少许修改。使用自定义MATLAB脚本通过MicroManager界面控制显微镜(Nikon Ti-E)的自动化阶段。使用Andor Zyla 4.2 sCMOS相机以10帧/秒的速度,通过10×相位对比度目标(NA = 0.30), 1024像素×1024像素,持续1分钟,以连续地获取动画。单细胞追踪进行如下:首先,把挑选处来的进化菌株的三到五个单菌落或5μl存储在−80°C的进化细胞-琼脂混合物置于 37°C的2ml生长培养基中,150 rpm过夜。第二步,将过夜培养物按1:100比例稀释至2ml预热生长培养基中,37℃培养至OD600为0.2~0.3。然后重复这个步骤,将细胞稀释到15ml预热的生长培养基中。直到OD600达到0.2,收集细菌。第三,将收获的样品用预热的生长培养基稀释至最终细胞密度OD600 = 0.05。然后,5μl稀释的样本用移液器吸取到一个显微镜载玻片(25毫米×75毫米),在样品的顶部放置一个盖玻片(18 mm ×
18 mm) (慢慢地,小心地避免气泡的形成)。随后,为了避免蒸发,盖玻片的侧面用热蜡密封。用0.05% (w/v) PVP 40000补充用于单细胞追踪的生长培养基,以保护鞭毛。每个菌株准备两到三张载玻片,并获得5个1分钟长的视频。录像采集时温度保持在37℃。
全基因组测序和分析
Whole-genome sequencing and analysis
利用Illumina平台进行全基因组测序,获得平均>100×覆盖率。直接从0.25%琼脂中的TB进化实验中采集的样品用于测序。简而言之,这些分离出的克隆在之前描述的生长培养基中生长,并在稳定期收集。对于种群样本,来自第50个周期的100μl冷冻cell-agar的混合物在3ml生长培养基中培养,第10小时收获。根据制造商的说明用基因组DNA纯化试剂盒提取细胞DNA。全基因组文库由华大基因在Illumina HiSeq X10上制备并测序。大肠杆菌str. K-12 substr. MG1655 (NCBI:
NC_000913.3) 的基因组序列被用作参考序列。所有测序数据使用Python支持的BRESEQ pipeline42进行分析。使用Sanger测序对一个子集的已识别的突变进行重新测序以进行确认。
竞争动力学和进化的数值模拟
Numerical simulations of competition dynamics and evolution
对生长-扩展模型(扩展数据图5)进行了扩展,以分析扩展过程中的竞争和进化动态,介绍和定义偏微分方程(PDE)见扩展数据图6,以及数学细节的补充模型。利用Python 2.7和PDE求解器模块FiPy,采用隐式格式对偏微分方程进行数值求解。随时间积分通常以时间步长dt = 0.25 s,和一个网格分辨率dx = 10μm的间隔。使用定制的Python代码进行模拟,该代码可通过GitHub在https://github.com/jonascremer/chemotaxis_simulation上获得。使用的参数集在补充文件simulationparameters.txt中提供,见补充模型5。
编译:马腾飞 南京农业大学
责编:文涛 南京农业大学;刘永鑫 中科院遗传发育所
Reference
Weirong Liu, Jonas Cremer, Dengjin Li, Terence Hwa & Chenli Liu. An evolutionarily stable strategy to colonize spatially extended habitats. Nature. 2019, 575: 664-668. doi:10.1038/s41586-019-1734-x
腾讯新闻:先进院合成所刘陈立团队发现空间扩展生境定殖的进化稳定性策略 https://new.qq.com/omn/20191107/20191107A08K3R00.html
BioArt: 专家点评Nature | 刘陈立/华泰立合作利用迁徙进化实验揭示合成生物建构原理 https://mp.weixin.qq.com/s/DPYpMUgFMpUQj625O_KpiA
猜你喜欢
- 10000+: 菌群分析
宝宝与猫狗 提DNA发Nature 实验分析谁对结果影响大 Cell微生物专刊 肠道指挥大脑 - 系列教程:微生物组入门 Biostar 微生物组 宏基因组
- 专业技能:生信宝典 学术图表 高分文章 不可或缺的人
- 一文读懂:宏基因组 寄生虫益处 进化树
- 必备技能:提问 搜索 Endnote
- 文献阅读 热心肠 SemanticScholar Geenmedical
- 扩增子分析:图表解读 分析流程 统计绘图
- 16S功能预测 PICRUSt FAPROTAX Bugbase Tax4Fun
- 在线工具:16S预测培养基 生信绘图
- 科研经验:云笔记 云协作 公众号
- 编程模板: Shell R Perl
- 生物科普: 肠道细菌 人体上的生命 生命大跃进 细胞暗战 人体奥秘
写在后面
为鼓励读者交流、快速解决科研困难,我们建立了“宏基因组”专业讨论群,目前己有国内外5000+ 一线科研人员加入。参与讨论,获得专业解答,欢迎分享此文至朋友圈,并扫码加主编好友带你入群,务必备注“姓名-单位-研究方向-职称/年级”。技术问题寻求帮助,首先阅读《如何优雅的提问》学习解决问题思路,仍末解决群内讨论,问题不私聊,帮助同行。
![]()
学习扩增子、宏基因组科研思路和分析实战,关注“宏基因组”
![]()
![]()
点击阅读原文,跳转最新文章目录阅读
https://mp.weixin.qq.com/s/5jQspEvH5_4Xmart22gjMA