作者:biofan
审稿:童蒙
编辑:amethyst/angelica
引言
随着科技发展,肿瘤的治疗也取得了显著的进展。然而由于肿瘤异质性的存在,导致靶向治疗或者免疫疗法上存在着许多难题。最近热门的ecDNA也许为解释肿瘤的异质性打开了一扇新的大门,对未来肿瘤检测和治疗都有深远的意义。
2019年末两篇关于ecDNA的大作背靠背发表,在朋友圈一阵狂风大作、满屏皆是。惊觉肿瘤细胞还有这样的神操作,感觉进入了一个崭新的世界,又惊又喜。于是一顿恶补,发现在2018年的《Nature Genetics》( IF:25.45)还有一篇相关的经典文章,题为《Discordant inheritance of chromosomal and extrachromosomal DNA elements contributes to dynamic disease evolution in glioblastoma》。
在这里和大家看一下这篇文章的内容,给大家分享一下研究思路,说不定下个发NG的就是你!
研究背景
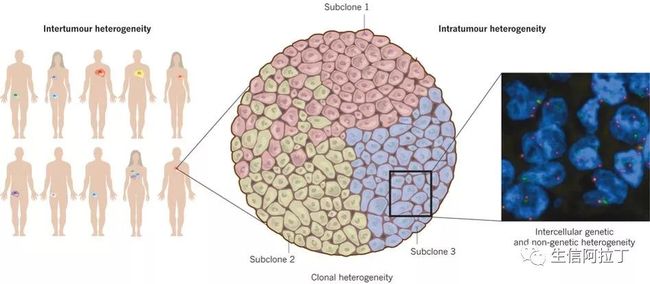
ecDNA 是一系列能够编码原癌基因的小片段环状DNA,它们在肿瘤细胞中非常常见,而在正常的细胞中几乎没有,这可能是导致肿瘤异质性的根本性原因。
肿瘤异质性是恶性肿瘤的特征之一,是指肿瘤在生长过程中,经过多次分裂增殖,其子细胞呈现出分子生物学或基因方面的改变,从而使肿瘤的生长速度、侵袭能力、对药物的敏感性、预后等各方面产生差异。
整体思路
肿瘤异质性也被认为是癌症治愈的“拦路虎”。以恶性胶质瘤(glioblastoma,GBM)为例,是其中最常见且最具攻击性的脑癌,常规治疗疗效不良,两年生存率仅为15%。为了探寻GBM异质性的原因,杰克逊实验室(Jackson Laboratory,JAX)专门对患者治疗前后以及异种移植(PDX)小鼠模型肿瘤细胞进化过程中的基因组变化进行了研究。
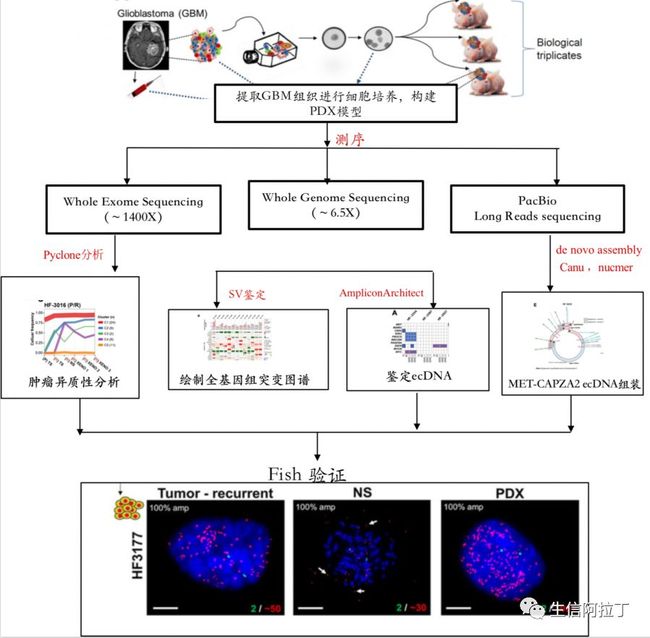
作者利用全基因组测序、高深度全外显子测序和三代长读长测序,分析ecDNA和肿瘤克隆进化的相关特征,对肿瘤异质性的潜在原因进行了多方面研究,并用FISH实验进行验证。
整体实验方案如下图,相关涉及软件我们也进行了贴心标注。
材料和方法
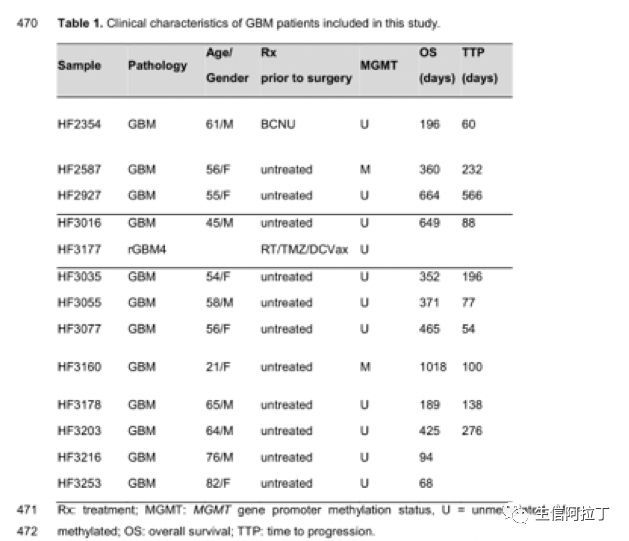
本文选取了12个新鉴定为胶质瘤和1个复发的胶质瘤样本,样本信息如下,其中HF3177为复发的胶质瘤样本。
作者从胶质瘤样本提取神经球细胞,培养并移植到小鼠体内构建颅内肿瘤模型(PDX),每个样本构建3个重复,如下图。
结果展示
1.全基因组基因拷贝数突变图谱构建
对胶质瘤原癌组织、原癌细胞(提取胶质瘤神经球细胞进行培养)以及颅内肿瘤移植模型(PDX)进行低深度的全基因组测序(6.5X)后,构建全基因组分子变异特征谱(如下图)。研究发现组织水平、细胞层面以及移植模型均在拷贝数扩增上有着很大的异质性,例如MYC基因在原癌组织中并未检测到扩增,然而在PDX却发现有大量的扩增。
2.胶质瘤中存在大量的ecDNA
1. 使用AmpliconArchitect检测ecDNA
基于全基因组测序结果,作者利用AmpliconArchitect(Deshpande, V., et al.,)算法(专门用于寻找基因组来源的ecDNA,主要原理是基于全基因组测序的数据比对结果,自动检索基因组断裂点和其他基因组扩增子的区域,结合CNV和SV的结果,形成ecDNA完整序列的报告)共鉴定出了74个来源于21个基因位点的ecDNAs(如下图)。
2. 使用FISH对ecDNA进行验证
随后作者设计了探针,通过FISH荧光杂交对这些ecDNA进行了验证。发现这些ecDNA在同种样本的不同层面(原癌组织,原癌细胞,移植模型)均有很大的异质性,并且在颅内移植模型有大量增多的现象(如下图B)。
3.异质性研究
1.MET_ecDNA标记不同细胞亚群
MET也称c-Met或肝细胞生L因子(Hepatocyte Growth Factor,HFG)受体,是一种酪氨酸激酶(Tyrosine kinase)。MET一般在上皮细胞组织表达。MET的激活机制有多种,比如过度表达、基因扩增、基因变异、自源性或旁源性的HGF激活等。有肿瘤遗传学证据表明MET的变异可以致癌,且多见于多发性髓样瘤和脑胶质瘤。
MET抑制剂作为抗癌药的开发也有很多挑战,如果MET激活是由基因扩增造成,抑制MET蛋白可能进一步激活其基因的表达,产生更多的MET。“真是野火扑不尽,随风吹又生”。针对MET基因的研究,作者着重研究了样本HF3035两个不同的时期(p5,p7),对于样本HF3077取了同一时期(p11)进行了研究,通过荧光原位杂交FISH发现MET不仅在同一样本不同时期差异很大,而且在同一样本同一时期不同细胞也有很大的差异(如下图A)。
2. 使用全外显子测序推断亚克隆结构
针对全外显子测序(~1400X)数据,作者使用PyClone来推断肿瘤纯度及肿瘤内部亚克隆结构,发现不管是不同时期还是同一时期原癌组织,原癌细胞以及移植模型都有着很大的异质性(如下图C)。
3.通过CNV预测MET-Capza2可能形成环状结构
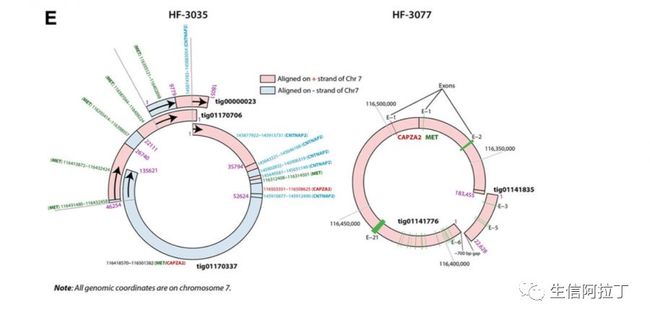
通过拷贝数变异发现,MET的拷贝越过间区横跨到Capza2(如下图B),暗示MET-Capza2可能形成环状结构。
4.使用三代数据对ecDNA进行分析
随后文章作者通过三代测序对上述“MET-Capza2可能形成环状结构”的猜测进行了验证。
针对三代的数据,作者通过Canu(Berlin K, et al.)进行了从头组装,并将组装好的contig利用nucmer(Delcher AL, et al.)比对到人的参考基因组上,对融合的contig进行筛选(two contigs were considered to be connected only if they shared a sequence fragment which was at least 5,000 bp long with the minimum 99% identity)发现3个contig都比对到了MET,Capza2区域,并且3个contig之间的overlap超过了5k(如下图),从而进一步证实MET-Capza2的环状结构。
5.多个ecDNA元件在患者GBM及其移植模型系统中纵向保留
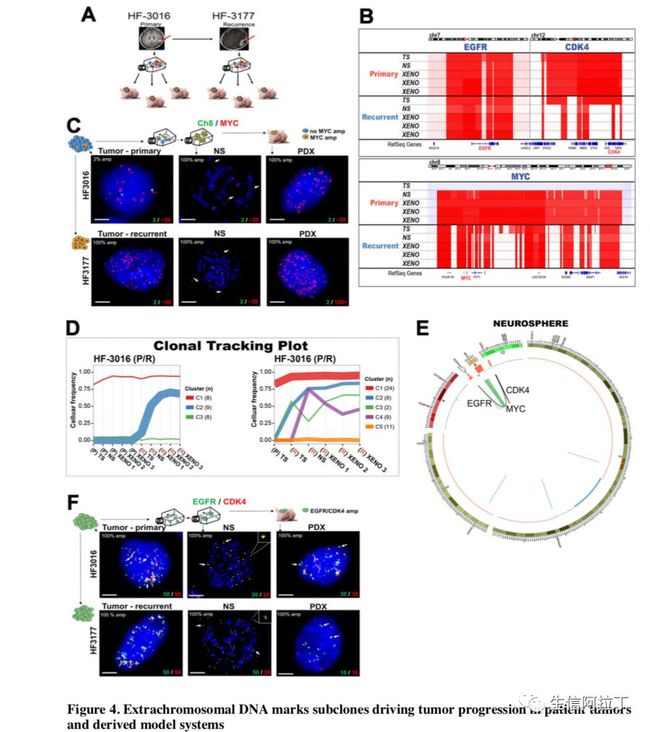
相对于原发的样本,复发样本的Myc_ecDNA比例显著增多(下图C),同时Myc周围共扩增的区域发生了变化,部分区域纵向保留(如下图D,相同样本的原癌组织,原癌细胞以及移植模型有相同的扩增)。
原癌基因EGFR和CDK4则发生了共拷贝(下图B)现象,暗示它们可能处于同一个ecDNA环,而进一步的荧光原位杂交FISH通过共定位则证实了这一结论(下图F),从而揭示了ecDNA不仅仅有单个驱动基因组成,也有可能由多个驱动基因组成。
结论
近年来多篇文献证实癌基因存在于 ecDNA,这无疑给癌症治疗领域带来了崭新的希望。ecDNA可变剪接的异质性,ecDNA扩增的异质性以及ecDNA随机分配的异质性深入地揭示了癌症异质性、耐药性的本质。
然而,关于ecDNA的研究目前还有很多重要的科学问题没有得到很好的解答,例如ecDNA到底是如何形成的?是否存在ecDNA的拼接热点?ecDNA对基因组DNA有何影响,能否结合液相分离来探寻其在细胞间的传递机制?随着技术的进步,我们也会逐渐找到答案。
参考文献
- Ana C. deCarvalho1,et al.Discordant inheritance of chromosomal and extrachromosomal DNA elements contributes to dynamic disease evolution in glioblastoma
- Deshpande, V., et al., Exploring the landscape of focal amplifications in cancer using AmpliconArchitect. Nat Commun, 2019. 10(1): p. 392
- Berlin K, et al. Assembling large genomes with single-molecule sequencing and locality-sensitive hashing. Nat Biotechnol. 2015; 33:623–30.
- Delcher AL, et al. Alignment of whole genomes. Nucleic Acids Res. 1999; 27:2369–76.
作者|biofan
审稿|童蒙
编辑|amethyst/angelica