一.研究背景
众所周知,TP53突变是肝细胞癌(HCC)中最常见的突变,它影响着HCC的进展和预后。尽管TP53突变在HCC患者预后中的致病作用已被充分证实,但其对HCC免疫谱的特异性影响尚未得到彻底研究。那么今天小编给大家带来的这篇文章就是通过构建TP53相关的HCC免疫预后模型来研究其调节免疫表型的机制以及其对预后的影响。该文章于2019年发表在EbioMedicine杂志上 ,影响因子6.183。好啦,长话短说,让我们一起来看一看作者都做了哪些研究吧~
二.主要方法和数据
数据:
(1)RNA测序数据:作者收集了364个HCC样品的体细胞突变状态以及374个HCC样品的基因表达数据并从TCGA中下载了相应的临床数据。作者从诊断为HCC的患者中收集手术切除样本,对具有RNA测序数据和TP53突变信息的359个HCC样品进行分析,使用Illumina HiSeq_RNA-Seq和Illumina HiSeq_miRNA-Seq平台获得序列数据。
(2)微阵列数据:作者从GEO中下载了三套基因表达谱数据集,分别是GSE54236基于平台GPL6480(包括78个HCC样品和77个相邻非癌样品),GSE76427基于平台GPL10558(包括115个HCC样品和52个相邻非癌样品),GSE14520基于平台GPL571(包括225个HCC样品和220个相邻的非癌样品)。作者将这三个具有生存信息的数据集整合到meta-GEO-HCC队列中,以验证IPM。
(3)北京HCC患者的收集:从2004年到2015年,101名接受手术并在北京协和医院诊断为HCC的患者按照规定参与了本研究。
方法:
(1)免疫组化(IHC)
(2)基因集富集分析(GSEA)
(3)差异表达基因(DEG)分析
(4)构建和验证免疫相关的预后模型
(5)估计免疫细胞类型分数
(6)功能富集分析
(7)诺模图的构建和评估
三.结果展示
1:免疫表型与HCC中TP53突变之间的关联
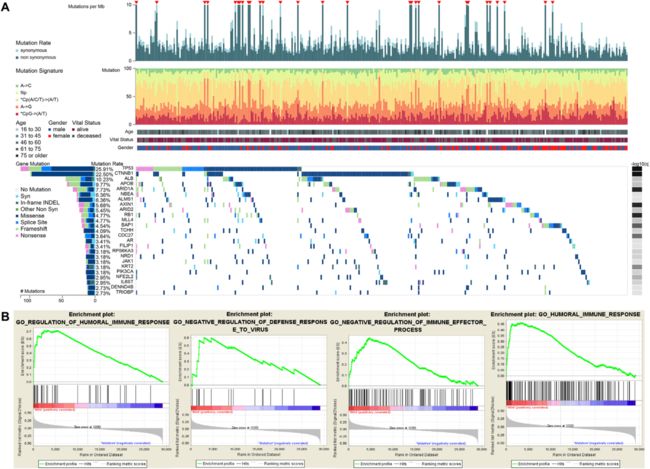
作者首次利用TCGA中HCC患者的基因表达数据和临床信息,找到与TP53状态相关的免疫相关生物学过程。对没有TP53突变和具有TP53突变的HCC样品进行GSEA分析。结果显示,不具有TP53突变的 HCC在414个生物过程中显著富集,这里选择了4个免疫相关生物过程。相反,TP53 突变型 HCC在任何免疫相关的生物过程中都没有富集。
图1:TCGA数据集中TP53的遗传富集分析。(A)HCC的基因组景观和TCGA数据集中的突变特征,这些特征在FireBrowse平台上进行了测定。 (B)与具有TP53 突变HCC患者相比,不具有TP53突变的 HCC患者中免疫相关表型的显著富集的通路。
2:鉴定具有和不具有TP53突变的HCC样品之间差异表达的免疫相关基因
为了确定TP53状态和免疫相关过程之间的相关性,作者从免疫相关过程中获得312个免疫相关基因。在所研究的312个免疫相关基因中,37个基因在两者之间差异表达(FDR <0.05和| log 2 FC | > 1)。
3:构建IPM并评估其在TCGA HCC队列中的预测能力
作者试图评估DEGs的预测能力,通过单变量Cox回归分析显示37个DEGs中的7个与OS显著相关。为了找到具有最大预后价值的基因,作者使用了基于LASSO
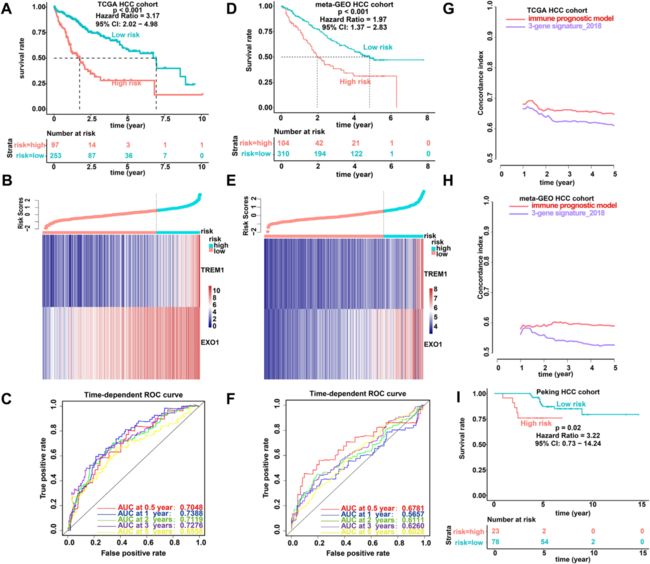
估计的Cox比例风险回归分析,并选择了TREM1和EXO1这两个基因。为了获得统一的临界值,作者将患者分为高风险组和低风险组,对TCGA,meta-GEO和北京HCC队列中TREM1和EXO1的表达水平进行了标准化,最后通过将每个免疫基因的归一化表达水平加权到多变量Cox回归分析的回归系数,作者建立了风险评分模型来预测患者的存活率。结果如图2所示:
图2:IPM的预测分析。对于TCGA HCC群组(A-C)和meta-GEO HCC群组(D-F),IPM的Kaplan-Meier存活率,风险评分和时间依赖性ROC曲线。结果显示(A和D)低风险评分组的OS显著高于高风险评分组。(B和E)显示了风险评分和两种预后免疫基因的表达之间的关系。(C和F)显示IPM的时间依赖性ROC曲线分析。(G-H)通过计算TCGA和meta-GEO HCC队列中的C指数,评估生存预测的预后性能。(I)通过使用免疫组织化学,得到北京HCC队列的IPM的Kaplan-Meier生存曲线。
4:验证和评估meta-GEO HCC队列和北京HCC队列中的IPM
为了确定IPM是否稳健,作者在包含414例HCC患者的meta-GEO-HCC队列中评估了TCGA-hcc队列中IPM的表现。结果表明IPM在不同的分子水平,平台和数据集中是稳健的。
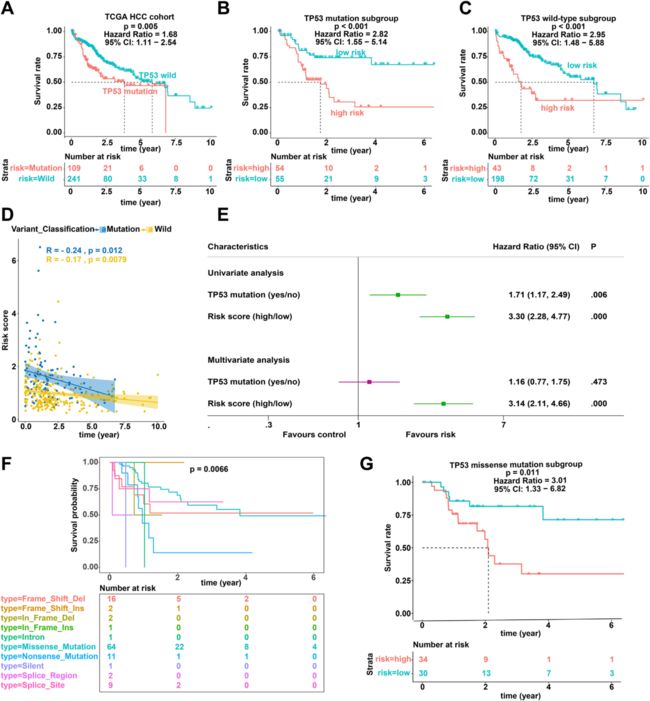
5:根据TCGA HCC队列中TP53状态对IPM的OS进行分层分析
与IPM一致,TP53状态也与HCC患者的预后显著相关(图3A)。作者进行了分层分析以测试IPM的预后值是否独立于TP53状态,根据TP53状态将TCGA HCC队列中的患者分成两组。分层分析结果表明IPM与不具有TP53突变和TP53 突变TCGA HCC队列中的OS显著相关(图3B和C)。此外,相关性分析表明风险评分与不具有TP53突变和TP53 突变TCGA HCC队列中的OS显著负相关(图3D)。此外,单变量和多变量Cox回归分析显示,IPM对HCC患者OS的预测能力与TP53状态无关(图3E)。
由于TP53突变类型影响TP53功能,作者对不同TP53突变类型进行了分层分析,发现TP53突变类型影响HCC患者的预后(图3F)。
为了测试IPM的预后价值是否独立于TP53突变类型,作者进行了TP53错义突变亚组的预后分析,其在各种TP53突变类型中具有最大比例。正如预期的那样,IPM能够将患者分为TP53错义突变亚组内的高风险和低风险组(图3G)。
6:低风险显示了局部免疫表型增强
作者通过对TCGA HCC队列中的253名低风险和97名高风险HCC患者进行GSEA分析。GSEA显示,低风险HCC患者与三种免疫过程相关:
HUMORAL_IMMUNE_RESPONSE,HUMORAL_IMMUNE_RESPONSE_MEDIATED_BY_CIRCULATING_ IMMUNOGLOBULIN,以及REGULATION_ OF_HUMORAL_IMMUNE_RESPONSE)。相反,高风险HCC仅与一个免疫过程相关:SOMATIC_DIVERSIFICATION_OF_IMMUNE_ RECEPTORS。因此,作者认为局部免疫特征可能在低风险组中赋予强烈的免疫表型,在高风险组中赋予弱化的免疫表型。
7:低风险和高风险HCC患者之间的免疫景观
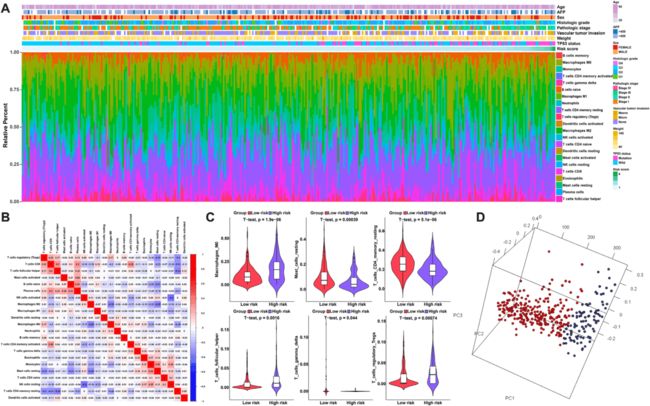
作者使用CIBERSORT方法结合LM22特征矩阵,估计了低风险和高风险HCC患者中22种免疫细胞类型的免疫浸润差异。图4A总结了从350名HCC患者获得的结果。在组内和各组之间,HCC中免疫细胞的比例变化(图4A)。此外,肿瘤浸润性免疫细胞的不同亚群的比例呈微弱至中度相关(图4B)。小提琴图可视化高风险和低风险患者之间显着不同的免疫细胞(图4C)。此外,基于上述细胞亚群,基于主成分分析,作者将高风险HCC患者和低风险HCC患者的样品清楚地分成两个不连续的组(图4D)。因此,这些结果表明,HCC中的异常免疫浸润和免疫浸润的异质性可以作为免疫治疗的预后指标和靶标,并且可能具有显著的临床意义。
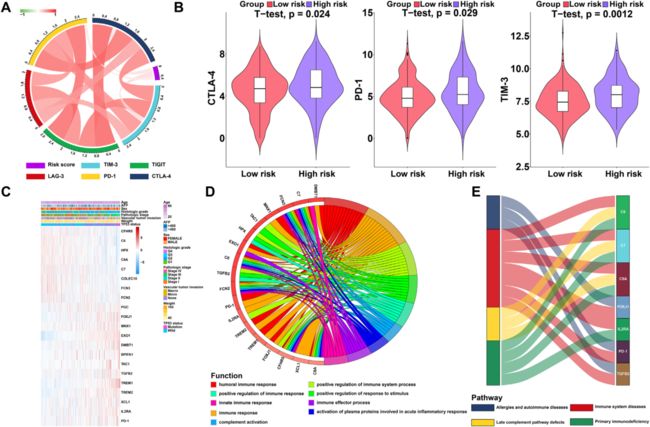
研究表明,免疫检查点的表达已成为选择HCC患者进行免疫治疗的生物标志物。因此,作者评估了患者风险评分与关键免疫检查点(CTLA-4,PD-1,TIM-3,LAG-3和TIGIT)表达之间的相关性,发现风险评分与CTLA -4,PD-1和TIM-3的表达显着相关(图5A)。此外,作者调查了低风险和高风险HCC患者之间CTLA-4,PD-1和TIM-3的表达。结果显示高危肝癌组CTLA-4,PD-1和TIM-3的表达显著高于低危肝癌组,表明高危肝癌患者预后不良,部分归因于免疫抑制微环境(图5B)。
8:改变高风险和低风险组患者的通路
作者鉴定了21个免疫基因(图5C)并进行GO和 KEGG分析以鉴定这些基因的潜在生物学功能和通路( 图5D和E)。结果表明与TCGA HCC数据集中的中心相关的基因主要富集在体液免疫应答和免疫系统疾病通路中(图5D和E)。
9:IPM独立于传统的临床特征
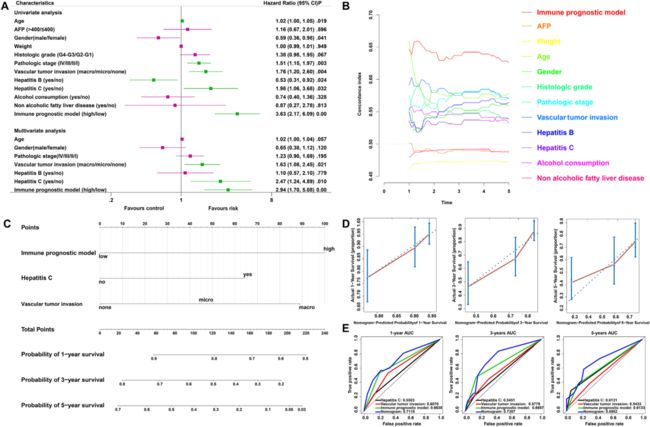
作者进行了单变量和多变量Cox回归分析以探讨IPM的预后价值是否独立于TCGA HCC队列中的其他临床因素。作者在通过调整临床特征后,IPM仍然是一个独立的预后因素,从而证实了其独立预测HCC预后的稳健性(图6A)。多变量Cox回归分析表明,IPM与生存信息和最高中位风险评分显著相关。此外,作者比较了IPM与传统临床特征之间的C指数,在11个存活预测因子中,IPM具有比常规临床特征更高的平均C指数(图6B)。总之,这些结果表明IPM与常规临床特征无关,并且在生存预测方面的表现优于常规的临床特征。
10:基于IPM构建和验证诺模图
为了向临床医生提供预测HCC患者预后的定量方法,作者构建了整合IPM和独立临床危险因素的诺模图(图6C)。在基于多变量Cox分析的该列线图中,与先前的Cox多变量回归结果一致。这表明预测和观察之间具有良好的一致性(图6D)。作者还将该列线图的预测准确性与丙型肝炎,血管肿瘤侵袭和IPM的预测准确性进行了比较,诺模图性能优于丙型肝炎,血管瘤侵袭和IPM。AUC也是诺模图中最大的(图6E)。总之,这些研究结果表明,诺模图是预测HCC患者短期或长期生存的比单个预后因素更好的模型。
四.结论
简单来说,作者研究了不同人群和平台中TP53突变状态和RNA表达,并建立了基于免疫相关基因的免疫预后模型(IPM),这些基因在不具有TP53 突变和TP53突变型HCC样本之间差异表达。然后,作者综合分析了IPM对HCC免疫微环境的影响。
好啦,这篇文章就介绍到这里了,总体来说内容还是很丰富的,感兴趣的童鞋可以认真研读~
往期分享
21-Deep learning (DL)一种基于多组学构建肝癌患者分型的新算法
22-从DNA损伤修复以及分析亚型角度分析膀胱癌中的免疫调节
23-基于代谢基因进一步识别和PTC相关的预后模型
25-多组学分析鉴定腺癌突变与免疫预后的关系