肠道是人体最大的免疫器官,肠道菌群被称为“人类第二基因组”。肠道菌群可调节宿主的免疫反应,参与人体各系统重要的生理功能,肠道菌群的失调影响各疾病的发生发展机制。全球人类肠道微生物数据库构建日益完善,对挖掘肠道菌群的作用机制提供了重要依据。宏基因组测序可用于解析环境微生物的群落结构、物种组成、系统进化、基因功能和代谢网络等,已经广泛应用于肠道微生物的研究。
一、构建人肠道微生物组的参考基因集
宏基因组测序技术可对人体肠道内粪便微生物的序列进行拼接和分箱(Binning),从而构建微生物组的参考基因集。该技术扩充了人类肠道微生物的已知物种数据库,为挖掘大量不可培养的微生物及新物种提供了可能,为宿主与微生物互作研究提供了基因库,为后续宏基因组研究中实现快速定量和功能挖掘奠定基础。据不完全统计,利用宏基因组测序在全球2万多人类肠道菌群中已经发现约1.7亿个蛋白序列、20多万个非冗余基因组、14多万种噬菌体及4644个原核物种。目前中国人最大的宏基因组参考基因集仅由2338个样本构建,13亿中国人的肠道菌群基因集还有很大的挖掘空间!
案例一:最大规模的中国人群肠道菌群宏基因组基因集
文章名称:Sex-and age-related trajectories of the adult human gut microbiota shared acrosspopulations of different ethnicities
发表期刊:Nature Aging
发表单位:北京大学人民医院等
发表时间:2021年1月
材料方法:
2338名北京平谷成年人(26-76岁)的粪便样本进行宏基因组测序分析,并与中国、以色列及荷兰近3000例人肠道宏基因组基因集进行比较分析。
研究结果:
1. 88种表型因素中,性别因素对平谷人群肠道菌群的影响最强,男女肠道菌群显著差异;
2. 中外多种族女性比男性具有更高的菌群多样性。女性比男性显著富集阿克曼氏菌(Akkermansiamuciniphila)、沙氏别样杆菌 (Alistipes shahii)等多种代谢保护菌;
3. 中外多种族人群中,性激素在建立和维持性别相关的肠道菌群中起重要作用;
4. 中外多种族人肠道菌群具有共性的衰老特征。相较青年人群,老年人群具有更高的菌群多样性、更丰富的代谢保护菌。
二、肠道菌群在疾病中的作用机制
近年来,国内外肠道菌群与疾病及其发病机制的研究日益火热。肠道菌群失调不仅可以影响肠炎性疾病,还利用“肠-脑轴”、“肠-肝轴”、“肠-肺轴”及“肠-肾轴”等调控机制在精神性疾病、肝脏疾病、呼吸道疾病及慢性肾病等研究中均取得了突破性的进展,为全球开展肠道菌群的研究及相关治疗提供新思路及新靶点。
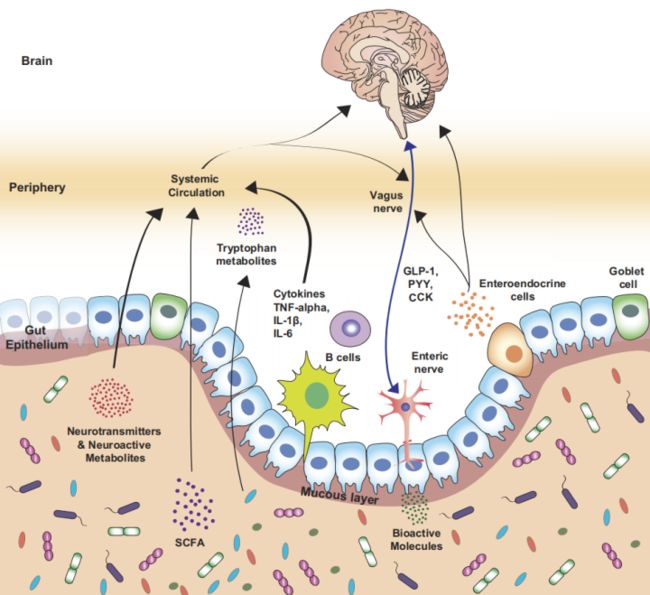
肠道微生物群通过“肠-脑轴”调控脑功能
肠道菌群与脑通过自主神经、肠神经、免疫系统、长内分泌信号、神经递质、支链氨基酸、胆汁酸、锻炼脂肪酸、脊髓、下丘脑-垂体-肾上腺轴、肽聚糖等途径和介质进行双向交流。中风、癫痫、自闭症、肠易激综合征、阿尔兹海默症等多种疾病均与肠道菌群紧密相关。
案例二:精神分裂症肠道微生物组特征的宏基因组关联分析
文章名称:Metagenome-wideassociation of gut microbiome features for schizophrenia
发表期刊:Nature Communications
发表单位:西安交通大学第一附属医院等
影响因子:11.880
发表时间:2020年3月
材料方法:
90名无药物治疗精神分裂症患者、81名健康对照者和90名精神分裂症患者治疗3个月后的38例样本进行宏基因组关联分析,将S. vestibularis移植到小鼠模型中进行验证试验。
研究结果:
1. 健康对照者和精神分裂症患者中差异mOTU 83个,差异KEGG模块579个和差异KEGG途径323个,并且精神分裂症患者的口腔微生物与肠道微生物之间存在密切联系;
2. 差异的肠道菌群可能与精神分裂症患者血清中色氨酸和KYNA的水平变化有关;
3. 抗精神病药物的治疗会影响肠道菌群,但并不能完全恢复因精神分裂症而改变的菌群;
4. Streptococcus vestibularis(精神分裂症中比较富集的细菌)的移植会引起小鼠的社交行为缺陷,并改变小鼠外周组织中神经递质的水平。
2. 肠道菌群通过“肠-肝轴”调控肝脏功能
肠-肝轴”是指肝脏和肠道经胆管、门静脉及体循环进行双向交流,肝脏产物影响肠道菌群组成和屏障完整性,肠道因子调控肝脏的胆汁酸合成和糖脂代谢。肝脏和肠道中的促炎性变化介导了肝纤维化、肝硬化和肝细胞癌的发展。酒精性和非酒精性脂肪肝患者存在肠道菌群失调、通透性增加,胆汁酸、乙醇和胆碱代谢物水平改变等特征。研究菌群与肝病的因果机制对深入理解“肠-肝轴”双向交流有重要意义。
案例三:肠道微生物的标志物预测肝硬化
文章名称:AUniversal Gut-Microbiome-Derived Signature Predicts Cirrhosis
发表期刊:Cell Metabolism
发表单位:加州大学圣地亚哥分校医学系,索尔克生物研究所
影响因子:21.567
发表时间:2020年3月
材料方法:
163名健康和NAFLD肝硬化患者及其家庭成员的宏基因组测序和非靶向代谢组测序。
研究结果:
1. 与对照组相比,NAFLD肝硬化组的肝脏脂肪含量和肝脏硬度显著升高;
2. 与对照组相比,NAFLD肝硬化患者的a-多样性显著降低且与临床参数相关,NAFLD肝硬化患者肠道菌群中Negativicutes丰度增多和Clostridia丰度减少;
3. 利用随机森林机器学习算法识别NAFLD-肝硬化中的19种关键差异物种,Faecalibacterium prausnitzii是区分NAFLD肝硬化和对照组的最关键的有益物种;
4. 血清天冬氨酸氨基转移酶水平在肝硬化患者中升高,使得肝硬化与早期纤维化的区分成为可能;
5. 微生物芳香族氨基酸(aromatic aminoacids,AAAs)和支链氨基酸(branched chain amino acids,BCAA)合成的失调可能会影响肝脏生物功能。
3. 肠道菌群通过“肠-肺轴”调控肺部疾病和呼吸道感染相关功能
肠道菌群通过“肠-肺轴”调控肺部疾病和呼吸道感染相关功能。据报道,肠道中双歧杆菌属细菌的减少和梭菌属细菌的增加与生命早期哮喘有关。使用抗生素部分清除肠道菌群可以影响小鼠肺部疾病和过敏性炎症。使用新霉素清除敏感的肠道细菌会导致肺部对流感病毒感染的易感性增加。同时,肺部菌群的变化也会影响肠道菌群的组成。给小鼠肺部急性灌注脂多糖会导致肺部菌群失调,同时也会引起肠道菌群紊乱。因此,肠和肺之间存在复杂的相互作用,影响着彼此的稳态平衡。
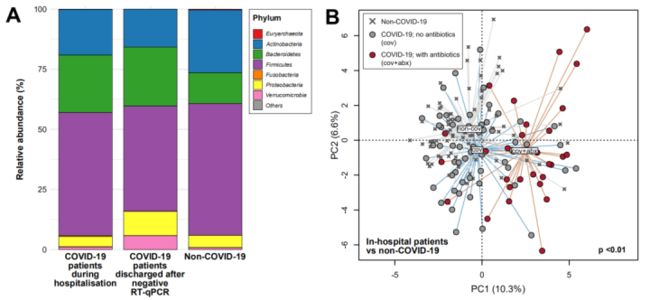
案例四:新冠肺炎患者肠道菌群组成反映疾病严重程度和免疫功能紊乱
文章名称:Gutmicrobiota composition reflects disease severity and dysfunctional immuneresponses in patients with COVID-19
发表期刊:Gut
发表单位:香港中文大学等
影响因子:19.819
发表时间:2021年1月
材料方法:
从100名患者中的27名采集了系列粪便样本和78例非新冠肺炎患者粪便样本(共274份)进行宏基因组测序。
研究结果:
1. 与非新冠肺炎个体相比,新冠肺炎患者肠道中活泼瘤胃球菌、和多氏拟杆菌的丰度更高,并且能影响免疫系统反应的物种确很少;
2. 炎性细胞因子、趋化因子和组织损伤标志物的血浆浓度与肠道微生物群组成相关;
3. 肠道微生物群可能通过调节宿主免疫应答而调控新冠肺炎严重程度;
4. 清除SARS-CoV-2后,肠道菌群失调持续存在。
4. 肠道菌群通过肠-肾轴调节肾脏功能
在肠道和菌群失衡时,大脑中小胶质细胞被活化,促进神经炎症和认知缺损,促进高血压和肾病发生。高血压、慢性肾病往往伴发,表现为免疫失调、代谢紊乱和交感神经激活等,与肠道失衡及宿主-菌群互作的改变有关。肠道与肾脏之间通过代谢依赖性和免疫两种路径构成“肠-肾轴”,肠道对肾脏疾病起到基础性作用。
案例五:异常肠道菌群改变宿主代谢组并影响人类和啮齿动物的肾衰竭
文章名称:Aberrantgut microbiota alters host metabolome and impacts renal failure in humans androdents
发表期刊:Gut
发表单位:中国农业大学等
影响因子:19.819
发表时间:2020年4月
材料方法:
该研究对223名ESRD患者(肾小球肾炎(n=76)、糖尿病肾病(n=73)和其他(n=74))和69名健康对照者的粪便样本进行宏基因组测序,血清和粪便样本进行代谢组研究,临床表型与微生物和代谢物的相关性研究,将ESRD患者的肠道微生物移植到无菌小鼠或经抗生素治疗的肾损伤的大鼠体内进行验证试验。
研究结果:
1. ESRD患者富集的微生物与患者的临床变量密切相关;
2. 除肾脏功能外,肠道微生物是宿主粪便和血清代谢的重要决定因素;
3. 参与尿毒症毒素和次级胆汁酸(SBA)产生的微生物可作为ESRD的诊断标志物;
4. 将ESRD患者的肠道微生物移植到无菌小鼠或经抗生素治疗的肾损伤的大鼠体内比对照组更能诱导血清尿毒症毒素的产生,并加重肾纤维化和氧化应激。
目前肠道菌群与疾病的研究仍有很多未解之谜,这需要科研工作者们进一步深度挖掘和探索。宏基因组测序技术,可研究样本中物种组成,通过特定物种作为预测某种疾病的标志物;可研究样本中功能基因组成,从而研究功能基因的代谢途径及作用机制;可深入拓展到细菌基因组,并找出与疾病相关条件致病菌及预测该菌功能。
参考文献:
1. Özkurt, E. & Hildebrand, F. Sex- and age-relatedtrajectories of the adult human gut microbiota shared across populations ofdifferent ethnicities[J]. Nature Aging, 2021.
2. Cryan J F, O'Riordan K J, Cowan C S M, et al. TheMicrobiota-Gut-Brain Axis[J]. Physiological Reviews, 2019, 99(4):1877-2013.
3. Zhu F, Ju Y, Wang W, et al. Metagenome-wide association ofgut microbiome features for schizophrenia[J]. Nature Communications, 2020,11(1):1612.
4. Anupriya, Tripathi, Justine, et al. The gut-liver axis andthe intersection with the microbiome[J]. Nature Reviews Gastroenterology &Hepatology, 2018.
5. Oh T G, Kim S M, Caussy C, et al. A UniversalGut-Microbiome-Derived Signature Predicts Cirrhosis[J]. Cell Metabolism, 2020.
6. Mjösberg Jenny, Rao Anna,Lung inflammation originating in thegut[J] .Science, 2018, 359: 36-37.
7. Yeoh Y K, Zuo T, Lui C Y, et al. Gut microbiota compositionreflects disease severity and dysfunctional immune responses in patients withCOVID-19[J]. Gut, 2021:gutjnl-2020-323020.
8. Yang T, Richards E M, Pepine C J, et al. The gut microbiotaand the brain–gut–kidney axis in hypertension and chronic kidney disease[J].Nature Reviews Nephrology, 2018.
9. Wang X, Yang S, Li S, et al. Aberrant gut microbiota altershost metabolome and impacts renal failure in humans and rodents[J]. Gut,2020:gutjnl-2019-319766.