前言
之前花了7个小时精读了一篇单细胞文章之后,感觉自信心大增,因此再精读一篇看起来类似的文章,看一下思路和研究方法有何不同。
选文
原文链接:Cell Research (2019) 0:1 – 14; https://doi.org/10.1038/s41422-019-0195-y
文章标题可见热点
(1) single-cell RNA-seq (scRNA-seq):略
(2) heterogeneity:简而言之,龙生九子各有不同,同一个肿瘤里面不同的肿瘤细胞的形态几个方面表现或有不同,不同病人的肿瘤之间也会有差异,这种被称之为异质性。
(3) malignant progression:略
文献阅读框架:
- Background
- Question/Gap
- Hypothesis
- Aims, Novelty/Significance
- Approaches (major)
- Predicted results (major results)
- Pitfuls & alternative approaches/remaining questions
1. Background and gap
胰腺导管腺癌(PDAC)具有很高的肿瘤内异质性且预后很差,目前肿瘤内异质性对于PDAC恶性进展的影响极其机制未知。
Pancreatic ductal adenocarcinoma (PDAC) is the most common type of pancreatic cancer featured with high intra-tumoral heterogeneity and poor prognosis. The mechanism of PDAC intra-tumoral heterogeneity for PDAC progression still unclear.
2. Hypothesis
Introduction:
第一段:概述PDAC情况
第二段:引出genomic and transcriptomic对研究肿瘤基因突变和信号通路变化作出的贡献,引出目前研究结果,alteration of epigenetic pathways is an emerging mechanism of PDAC progression,然而因对于这些研究的认知不足,无法应用于临床,提示需要进一步探清alteration of epigenetic pathways在PDAC进展中的作用。PDAC的异质性太强,使用bulk-seq无法还原真实情况,single-cell resolution势在必行。
第三、四段:
先介绍scRNA-seq在肿瘤研究中做出的贡献,再介绍目前PDAC的研究进展,结果简介本文研究成果。
基于以上introduction,我给出的hypothesis为:scRNA-seq reveals the role and mechanism of intra-tumoral heterogenity in PDAC malignant progression.
3. Aims,略
4. Major approaches
(1)PDAC patient samples
(2)Tissue dissociation and cell purification
在病理医生的监控下正确的收集样本(非常重要),将新建样本泡在冰的RPMI-1640培养基中运输。冰PBS冲洗三次后冰上剪碎,使用鸡尾酒酶解法解离样本,使用的解离液为:1 mg/ml型胶原酶,2 mg/ml型蛋白酶抑制剂,1 mg/ml胰蛋白酶抑制剂和1unit/ml DNase I溶解在含5%FBS的PBS中。
肿瘤组织:37℃,50 rpm 匀速震荡摇晃40 min。每隔20 min收集一次,以增加细胞的产量和生存能力。
control组织:切碎后使用同样的酶解液浸泡,37℃放置但不震荡摇晃,10 mini收集一次细胞。
细胞悬浮液过40 μm尼龙筛,红细胞(RBC)被含有1 unit/mLDNase I的红细胞裂解缓冲液去除。用含0.04% BSA的PBS清洗细胞,逐步下降离心速度和增加的时间洗涤。细胞用台盼蓝染色确认过活性后,用0.04% BSA的PBS稀释至1*10的6次方个/mL,送样测序。
(3)10× library preparation and sequencing
(4)Single cell RNA-seq data processing
(5)Identification of cell types and subtypes by nonlinear dimensional reduction (t-SNE)
(6)Cluster markers identification
值得注意的是,他们的一部分数据分析使用了网页工具
(7)DEG analysis of pseudo-bulks sequencing:自制bulk-seq,有点像内标法
(8)CNV estimation:Copy number variation拷贝数变异
(9)Constructing single cell trajectories in PDAC
(10)Identification of malignancy associated TFs
(11)TCGA data analysis:公共数据库验证
(12)Immunohistochemistry staining
(13)Quanti fi cation of Immunohistochemical staining of CD3D and Ki67 expression
(14)Proliferation assay
小结:从本文使用的实验方法来看,本文重点在于数据分析,后面从TCGA开始都是相应的验证工作。而前一篇我精读的文章,则是数据分析+实验验证双侧重,但为啥那篇文章发了NC,而这篇是cell research呢?
5. Major results
结果框架
(1)Single-cell expression atlas and cell typing in PDAC tumors and control samples
(2)CNV landscape distinguishing malignant ductal cells in PDACs
(3)Distinct subgroups in malignant ductal cells
(4)Gene expression pattern analyses in TCGA PAAD samples based on malignant ductal marker
(5)Inactivation of T cells in PDAC patients with high abundance of
proliferative ductal markers
(6)Distinct subtypes of immune cells and fibroblasts in PDAC
(1)Single-cell expression atlas and cell typing in PDAC tumors and control samples
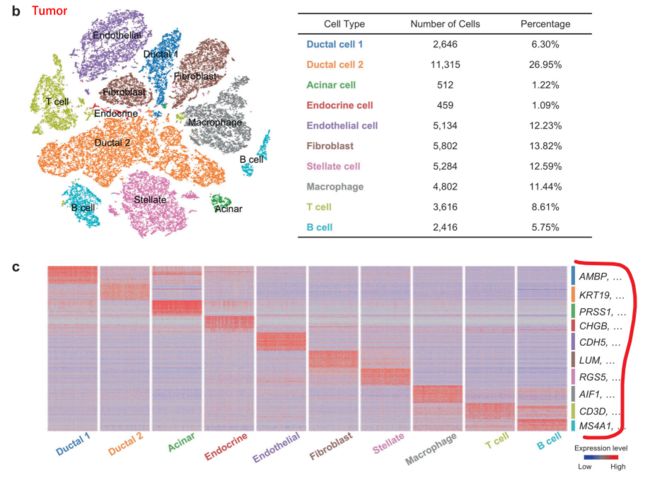
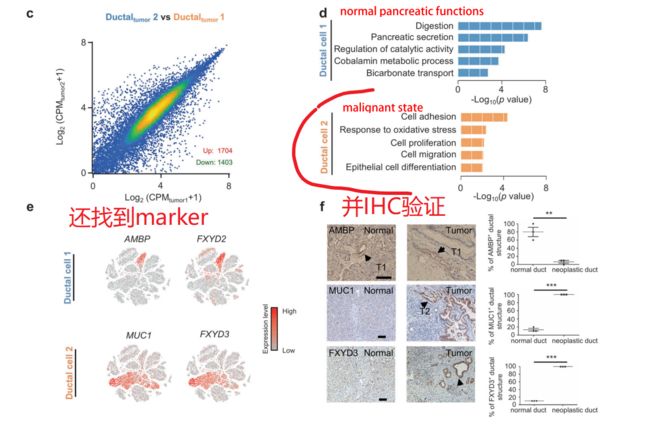
常规操作:将tumor单细胞数据进行cluster,并根据已有的marker对每个cluster进行定义(如下图)
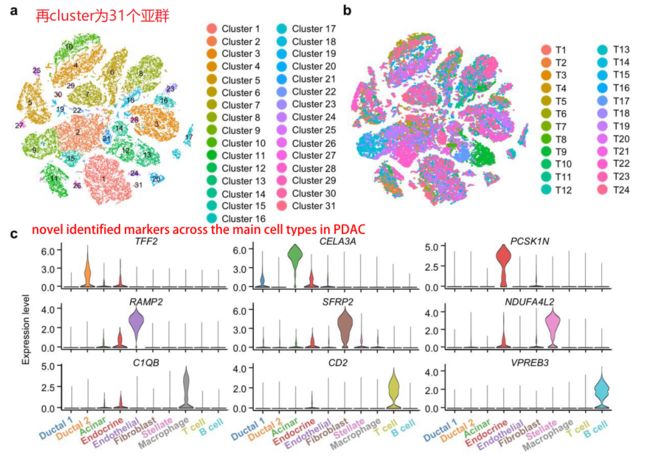
细分再细分,发现新的marker
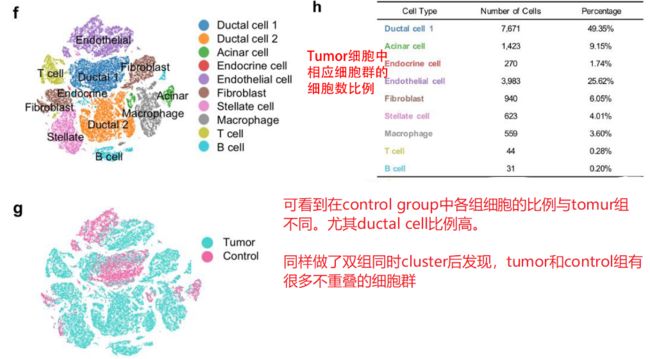
小结:第一部分给了相当多的信息,从常规上做了cluster,定义每个cluster,并且做了两个组的合并cluster,看到不同组别的specific cluster。
(2)CNV landscape distinguishing malignant ductal cells in PDACs
见上面对肿瘤异质性的介绍可知:
Tumour heterogeneity describes the observation that different tumour cells can show distinct morphological and phenotypic profiles, including cellular morphology, gene expression, metabolism, motility, proliferation, and metastatic potential. 因此,对于测序数据来说,能用于分析tumor heterogeneity的方向则是:gene expression上的差异。
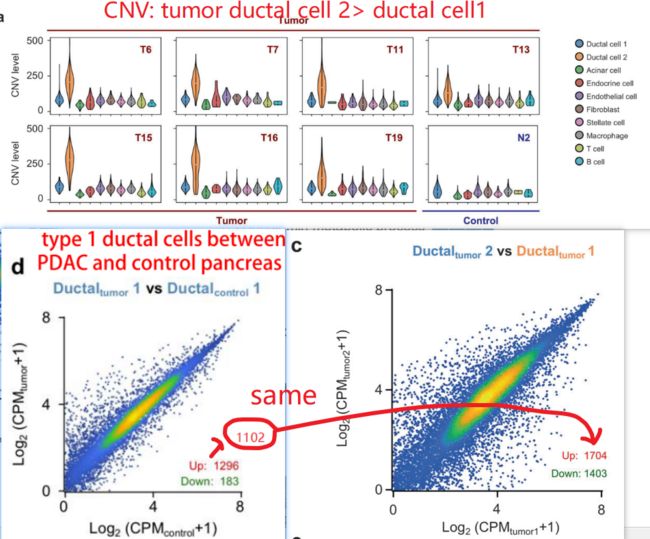
根据上述结果,已知在control和tumor两个组别中,它们的ductal cell的比例差别很大。PDAC中存在两种不同类型的导管细胞,作者使用大规模染色体拷贝数变异(CNV)来定义它们的恶性状状态,最后结果是 CNV情况:tumor ductal cell 2> tumor ductal cell 1, control group dectal cells
通过分析后发现,ductal 1 相对于control ductal 1上调的1296个基因中,有1102个也在ductal 2 vs ductal 1的上调基因中。说明,有1102个基因的表达,是在control ductal1 < tumor ductal1< tumor ductal 2,说明有一系列的基因,在control ductal 1 到tumor ductal 1--再到tumor ductal 2的进展过程中,非常重要。
小结:从CNV 图谱分析,gene expression 分析还有GO分析结果来看,tumor ductal 2 cells 是具有最高的CNV 分数,高表达基因GO富集在malignant 相关形状,因此type 2 ductal cells are the major source of malignant cells in PDACs.
(3)Distinct subgroups in malignant ductal cells
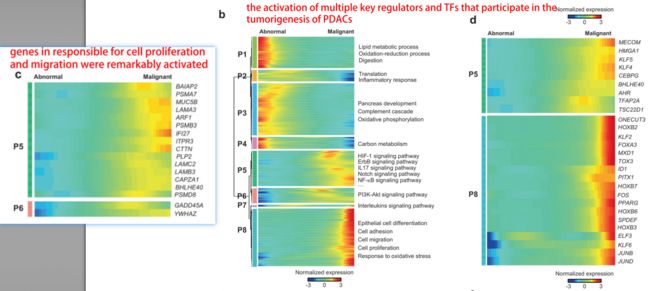
还是老套路,既然这control ductal 1,tumor ductal 1,tumor ductal 2存在有上千个基因表达的连续性变化,势必要做一个拟时序分析,看看它们之间有没有前后关系。
另外,既然找到了malignant cluster,肯定是要再cluster分为多个亚群,以解释tumor heterogeneity,并且还要给出每个不同亚型的marker,猜想如果有条件的话还要查看他们与肿瘤进展等等的响应关系。
关于拟时序分析粪便malignant cell的来源
在这里,同样他们还做了一个详细的基因随PDAC进展的展示图
关于对malignant cells的在分类:作者分辨出subgroup 3 是common在大多数病人中的, 1,2,4,5,6则是specific for individual patients,而subgroup 7则是在大部分病人中的比例都很低。
(4)Gene expression pattern analyses in TCGA PAAD samples based on malignant ductal marker
找公共数据库验证:样本量大
image.png
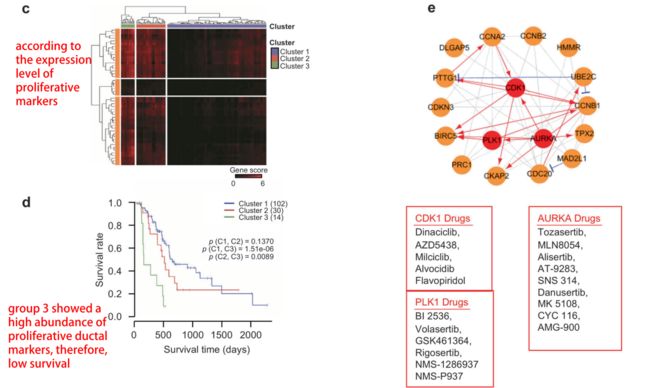
cluster 1-3的marker gene验证出来是PDAC,而cluster 4则是其他的胰腺癌亚型,则进一步将在分类的ductal 2相关基因联系上PDAC,范围划更小。之后采用无监督非负矩阵因子(NNMF)聚类,根据增殖标志物的表达水平将PDAC患者分为3个亚组,利用这些结果做了一些用药指导(如下图),并实验验证(略)
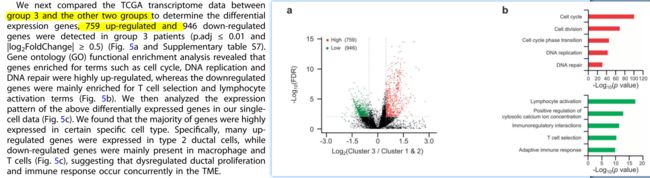
如下图,将PDAC三个亚组中恶性程度最高的从cluster3和1/2对比,查看差异基因以及功能变化。
结果发现,下调基因主要和免疫相关,上调基因则与细胞周期等增殖相关功能。因此,顺着这个线索走,下一步则focus在免疫上。
(5)Inactivation of T cells in PDAC patients with high abundance of proliferative ductal markers
我的思路:根据上文结果提示免疫学方面值得一探,但从我不成熟的角度来看,我大约只会把各种免疫细胞的比例拿来互相对比一下,再结合两组的信息来综合比较,简单评估免疫激活情况,对于免疫学不熟悉的我,只能想到这些。
作者思路:生信数据想要大放异彩,脱离不了扎实的生物学背景和绝妙的idea。(1)作者前期已经发现了malignant cell cluster是ductal2,还做了拟时序分析得到 control ductal1--tumor ductal 1--tumor ductal2 的细胞变化轨迹。此外对tumor ductal 2进行了再cluster,发现了common 组和individual组,并且发现subgroup7是一个特殊的群组。(2)单细胞数据分析结束后,作者这边还找了TCGA公共数据库验证,用单细胞数据分析得到的malignant ductal marker来对TCGA样本分类成为4类,可以比较好的将PDAC从其他胰腺癌分类出来。将分类出来的PDAC 按照the expression
level of proliferative markers 进行再分类,发现高 proliferative ductal markers,病人预后更差,说明proliferative ductal markers是和病人预后相关的,因此针对这些marker找到了PDAC治疗靶点。(3)作者将PDAC进行组与组之间的比较发现恶性程度强的cluster3的下调基因主要几种在免疫学相关,提示PDAC恶性进展相关免疫学状况可以进一步研究。(4)接下来才是这一节的内容:
TCGA中PDAC样本有较高proliferative ductal markers (预后差)相反有更低的T cell markers表达(下图d),在单细胞数据中也表现出同样结果(下图a)。以CD8 T cell activation score为标准,发现在high proliferative ductal cell 表现出显著低的CD8 T cell activation score(下图e)
image.png
Distinct subtypes of immune cells and fibroblasts in PDAC
这部分结果作者没有放在正文里面,是一个稍微延伸的部分,原因如下
主要的思路还是分类后查看maker,并做一个拟时序分析。猜测如果想说有异质性,那答案是肯定的,每一个细胞都不一样。
总结
结果:PDAC瘤块具有高度异质性,由多种恶性细胞和基质细胞类型组成。
此外,恶性导管亚型可通过特征基因表达谱进行区分,并包含高度增殖和迁移的亚群。作者进一步鉴定发现了一系列新的基因表达变化,这些变化影响了几个已知的癌变途径,并抑制了与肿瘤相关的与临床病理特征相关的T细胞活化。
这篇文章使用的样本是临床样本,这是加分点之一,另外也做了实验验证。此外,选用TCGA数据样本量大,不仅仅是验证,也是一种延伸,并且给出了用药指导。