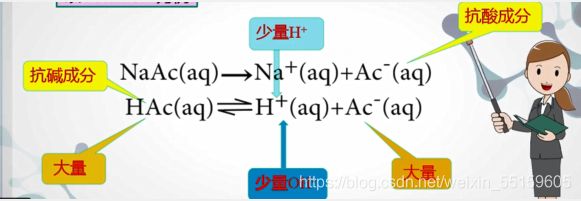
- 计算机在高分子材料与工程中的应用,计算机技术在高分子材料工程中的应用.doc...
宇宙探奇
计算机技术在高分子材料工程中的应用计算机技术在高分子材料与工程中的应用化112-2201169502225田新计算机技术在高分子材料与工程中的应用田新烟台大学化学化工学院摘要:介绍了计算机信息系统、计算机辅助系统、计算机控制系统在高聚物研究中的应用概况,详述了计算机仿真技术在此领域中的应用及其研究进展。计算机技术在材料科学研究中应用领域。探讨计算机在材料科学研究领域中的具体应用。借助于计算机可推动
- 计算机在高分子材料中的应用软件,计算机技术在高分子材料工程中的应用(10页)-原创力文档...
密之山人
计算机在高分子材料中的应用软件
计算机技术在高分子材料与工程中的应用化112-2201169502225田新计算机技术在高分子材料与工程中的应用田新烟台大学化学化工学院摘要:介绍了计算机信息系统、计算机辅助系统、计算机控制系统在高聚物研究中的应用概况,详述了计算机仿真技术在此领域中的应用及其研究进展。计算机技术在材料科学研究中应用领域。探讨计算机在材料科学研究领域中的具体应用。借助于计算机可推动材料研究、开发与应用。关键词计算机
- 016.3月夏令营:数理类
力学AI有限元
保研
016.3月夏令营:数理类:中国人民大学统计学院:http://www.eeban.com/forum.php?mod=viewthread&tid=386109北京大学化学学院第一轮:http://www.eeban.com/forum.php?m...6026&extra=page%3D1香港大学化学系夏令营:http://www.eeban.com/forum.php?mod=viewthr
- 【AIDD】AI药物研发学前基础--团队大佬
静静喜欢大白
医疗影像人工智能团队AIDD
目录1、简介2、团队1)AI+药物研发中科院上海药物研究所蒋华良教授中科院微生物研究所王军教授团队中科院深圳先进技术研究院袁曙光课题组北京大学高毅勤教授团队中国药科大学陈亚东课题组伊利诺伊大学/清华大学彭健教授团队清华大学交叉信息研究院曾坚阳加拿大蒙特利尔学习算法研究所唐建团队阿卜杜拉国王科技大学/中国人民大学高欣教授北京大学前沿交叉学科研究院裴剑锋团队北京大学化学与分子工程学院来鲁华课题组北京大
- AbMole|精准肿瘤识别:通过变构纳米感应圈实现亲和力编程
AbMole
生物科研学习笔记试剂
近年来,精准医疗的发展对肿瘤的早期诊断和靶向治疗提出了更高要求。然而,传统肿瘤识别探针在实现“靶向肿瘤、避开正常组织”方面仍面临诸多挑战。为了克服这一难题,研究者们不断探索新的识别策略,其中基于肿瘤微环境(TME)响应的纳米材料展现出巨大潜力。来自湖南大学化学化工学院分子科学与生物医学实验室的LiliAi,QianqianZuo,YoushanLi等多名研究人员发表了题为《ProgrammingA
- 青禾赤子,“疫”尘不染实践队:服务群众,共渡难关
小郭早睡觉
为了贯彻党的十六届四中全会的精神,促进农村建设,密切党群、干群关系,联系当下社会民情,2022年七月曲阜师范大学化学与化工学院学院“青禾赤子,“疫”尘不队”成员张晴在山东省新泰市谷里镇北谷里村进行了社会实践。当前,新冠肺炎疫情仍在全球蔓延,国内零星散发病例和局部暴发疫情的风险仍然存在,疫情防控形势依然严峻复杂。不久前召开的中央经济⼯作会议要求,疫情防控要毫不放松,我们要巩固拓展疫情防控和经济社会发
- 青禾赤子,“疫”尘不染实践队:在社区服务中实现自我价值
www_4407
导语:2022年7月,曲阜师范大学化学与化工学院“青禾赤子,‘疫’尘不染实践队”队员张晨东在山东省泰安市新泰市朝阳社区进行社会实践,主要深入社区内部,帮助社区工作人员开展防疫相关工作,积极向群众科普防疫相关知识。为响应曲阜师范大学2022年大学生暑期文化科技卫生“三下乡”社会实践活动的号召,我与同学院的同学组成一队,在对应社区进行社会实践,希望能为社区奉献自己的力量。还在学校时我就已经联系了我所在
- 青春志行,“疫”路生花
氧化亚硼
为贯彻落实习近平总书记关于青年工作的重要思想,深入学习习近平总书记在庆祝中国共产主义青年团成立100周年大会上的重要讲话精神,提高当代青年积极参与基层治理的能力,7月20日,曲阜师范大学化学与化工学院“青禾赤子,‘疫’尘不染”实践队队员李世奇前往聊城市茌平区滨湖社区进行了社区志愿服务活动。在实践前期准备活动中,实践队员积极与社区工作人员进行沟通,协商工作内容,最终决定前往核酸检测队和疫情消杀队进行
- 恶意和爱意
曼珠沙桦
回顾今天是朱令48岁的生日,相信这个名字已经慢慢被世人所淡忘了,1995年清华大学化学系三年级的女生朱令被确诊为铊中毒,其剂量令人震惊。随后,朱令父母选择报案,警方也介入调查。1997年,朱令的一位大学室友曾被警方传讯,但随后获得释放,之后,这位同学移居海外、且更换了姓名。至今,“朱令案”仍由于证据不足而未能告破。在长达半年的昏迷之后,朱令苏醒,但铊毒已经严重地损害了她的神经系统,曾经的学霸不得不
- 大学化学比较好的搜题软件?完整适配大学课程的搜题工具 #其他#媒体#学习方法
天空很蓝33
媒体学习方法
下面,我将为您介绍几款备受大学生欢迎的搜题软件,希望能够帮助您更好地完成学业和提升学习效果。1.找题哥这是一个网站找题哥-分享考试题库与题目资料,找题哥,包含各类考试试卷试题与答案、在线搜题与练习,分类有医卫题库、职业资格考试、建筑工程试题、财会真题等。2.题小聪这个是公众号支持多种搜题方式:拍照搜题、语音搜题、文字搜题适用于不同的场景下方附上一些测试的试题及答案1、《道德经》讲"无为",又讲"为
- 叶永烈的影响
二三如六
2020年5月15日,著名作家叶永烈逝世,享年80岁。他毕业于北京大学化学系,但文理兼修。一生著作等身、领域广泛。作品共3500万字,其中既有一系列历史纪实文学;更有启发和伴随一代中国孩子成长的《十万个为什么》《小灵通漫游未来》等科普作品,点燃了许多孩子的好奇心和科幻梦。上中学时,在语文课本里学过叶永烈先生的一篇文章《首先要做“马”》,记得其中心思想是鼓励青年面对逆境,首先要自立自强,先成为“千里
- 景泰一中今日“双研会”
电场线
展示课安排胥生杰,男,中学二级教师。2013年7月毕业于陕西师范大学化学本科专业,同年8月参加工作。参加工作以来,勤奋刻苦,认真踏实,在《新教育时代》发表论文一篇,辅导学生获得化学奥林匹克市级一等奖。在白银市优秀教学案例评选中获得二等奖,在学校“双研会”中也多次获奖。精彩课堂评委听课罗伊灵,女,2016年毕业于天水师范学院英语系,现任景泰一中英语教师。在2017至2018学年度景泰一中青蓝工程汇报
- 青岛农业大学赴临沂小分队:走入革命老区,助力乡村振兴
Chihiro_0abf
宇宙山河浪漫,生活点滴温暖,一群志同道合的青年共赴乡村支教,以抒山河热爱之情。青岛农业大学化学与药学院赴临沂小分队一行15人于7月11日到达临沂市沂南县马牧池乡常山庄社区开展暑期支教活动。以趣味化学实验,折纸手工,党史宣传,游戏互动等形式为常山庄村的小朋友们带来丰富有趣的暑期义教课堂。支教第一幕——招生经过将近5个小时的车程,实践队员一行人到达了常山庄社区,在稍作调整之后,暑期招生在常山庄社区中如
- 《远方有我》——《那些年 那些人 那些事》
远方文学曹县课程中心
“本文选自远方文学优秀学员作品集——《远方有我》。作者车赛,毕业于复旦大学化学系,高中就读于唐山一中,初中就读于华北油田井下学校。”那些年那些人那些事车赛复旦大学化学系老寇当爸爸了。从远方毕业这么多年了都没和老寇有过什么联系,说起来确实惭愧,前一段时间从寇头的人人主页上得知了这一重磅消息时,着实小震惊了一下。老寇正式完成了从当年为人师表的文艺青年到现在身负重任的超级奶爸的华丽转变,看着照片里抱着小
- 上海交通大学考研专业课资料大全
元九23
[全套]上海交通大学媒体与设计学院《334新闻与传播专业综合能力》[专业硕士]考研题库【名校考研真题+指定教材课后习题+章节题库】[全套]上海交通大学《827材料科学基础》考研全套资料[全套]上海交通大学人文学院《835西方哲学史》考研全套资料[全套]上海交通大学化学化工学院《808无机与分析化学》考研全套资料[全套]上海交通大学化学化工学院《622物理化学》考研全套资料[全套]上海交通大学《80
- 青岛农业大学化学与药学院赴临沂小分队三下乡活动
wd王淑婷
2021年的这个夏天,青岛农业大学化学与药学院在临沂市马牧池乡常山庄社区开设公益暑托班丰富社区孩子的暑期生活。从7月11日开班以来,到今天也已经开展了九天的支教活动了。志愿者老师为小朋友带来各种兴趣课程,培养小朋友各方面的才能,让他们有一个难忘而收获颇丰的暑期。一天都是新的开始,都有满满的收获和感悟。在上午的地理课程中,志愿者刘宇带领同学们领略地理的奥秘。“火星”“地球”......同学们在轻松愉
- 2022-08-07
青禾赤子疫尘不染实践队
不忘“苯”心,“疫”尘不染(通讯员史亚鹏)2022年7月5日21时,曲阜师范大学化学与化工学院“‘疫’尘不染,青禾赤子”暑期社会实践队召开线上会议,会上队长李淑娴阐述了团队成员发扬当代大学生乐于奉献的精神积极深入社区志愿服务和志愿实践的主旨,同时也对暑期社会实践的具体开展形式做出了相关安排。与会成员均为团队成员,来自曲阜师范大学化学与化工学院2021级各师范和公费师范生专业,暑期社会实践地点分布在
- 在不务正业的道路上越走越远~~~
dony_uck
一直在不误正业得道路上越走越远~~~大学化学专业,大学期间主要时间却在谈恋爱,打游戏,踢球毕业后找了物流行业,干了半年专岗干统计分析工作,又半年转调度岗位,又半年转业务管理岗,又半年,转流程需求分析岗,干了2年后。。。当当当当~~~到了现在离职找了系统分析员~~~只想问问没有扎实的正业。。。现在慌得一匹的我。。。怎么让自己保持一个比较骚气的心态?
- 青岛农业大学化药临沂小分队三下乡活动
wd王淑婷
7月19日,青岛农业大学化学与药学院赴临沂社会实践小分队进行为期两周的支教活动已经过去一半。“欲知平直,则必准绳;欲知方圆,则必规矩。”自古以来,规矩就是一种尺度,一种标准;就是一种约束,一种准则;更是一种责任,一种境界。于是,志愿者于晓龙针对立规矩成大器开展主题课堂。课堂上,于晓龙通过播放图片、举例子等轻松简单的方式讲解了什么是规矩,强调作为学生的我们应该严守纪律,时刻记住无规矩不成方圆,随后,
- 化院本科生教育教学思考
Sciurus
我们有很多种教育方式,但是其中并没有完美的一个。不仅如此,其中绝大部分距离完美还有很远。当我们提出问题的时候,往往解决问题的关键在背后的社会经济问题,而非教育者和政策制定者本人。提出这些问题,不意味着我们可以很快找到解决它们的办法,也不意味着对这一客体整体意义的负面评价。但是,我们仍然应该继续提出问题,因为它们意味着前进的动力和方向。北京大学化学与分子工程学院(简称“化院”)是北京大学理学部一所享
- 立足黄河流域,推进生态保护
7c769bedc29d
7月7日,青岛农业大学化学与药学院推动黄河流域生态保护社会实践团在山东省东营市黄河流域入海口开展社会实践活动。山东省东营市黄河入海口,有着黄河入海口的黄河三角洲国家级自然保护区,总面积15.3万公顷,拥有我国暖温带最完整的湿地生态系统。本次社会实践活动旨在贯彻习近平总书记关于黄河流域生态保护和高质量发展的重要指示要求,把黄河流域生态环境保护放在首要位置,深入推动黄河流域生态环境保护,响应号召身体力
- 青农云宣讲:抗疫最美逆行者
杨松一
青岛农业大学春蕾:抗疫最美逆行者宣讲进行中2021年1月13日下午3:00,青岛农业大学化学与药学院药学专业2002班姚莉娜同学于兰陵县第九中学对学生进行抗疫最美逆行者的宣讲活动。其中,该班级班主任老师与学生一同参与了此次活动。宣讲活动开始,姚莉娜同学简单介绍了此次宣讲活动的简要内容和重要意义。接着,姚莉娜同学就寻找最美逆行者、学习抗疫精神、抗击疫情从我做起三个方面对这次的2020年末发生的新冠肺
- “希望我们在书中相遇。”老师的话点亮了他前进的方向,而今90后的他已是博导
春风十里木有一路桃花
昨天,我被一则消息震到了,当时第一感觉就是我是不是要躺平一会儿,来缓缓自己受惊但没被吓的心灵。华中科技大学绿色合成与催化团队实验室一片忙碌,一身蓝色实验服、头戴护目镜的唐从辉正带着学生们做实验。崭新的通风橱内,装着各种颜色反应液的烧瓶摆放整齐,橱窗上写满化学反应方程式,一旁的旋转蒸发仪有序运转。这个开头没啥呀?!客官,别急,继续往下看。唐从辉,出生于1991年,今年刚满30岁,已是华中科技大学化学
- 青禾赤子,“疫”尘不染实践队:社区服务,探民生、知民情
该打球啦
为提高当代青年参与服务基层社区治理的能力,积极响应学校鼓励学生参加以“青春献礼入十大,社区实践志愿行”为主题的社会实践专项活动,2022年7月4日至7月10日,曲阜师范大学化学与化工学院“青禾赤子,‘疫’尘不染实践队”成员李淑娴在山东省济宁市兖州区新驿镇杨营新村进行了为期一周的社区服务志愿活动。实践队队员李淑娴的主要任务是每天按时在杨营新村居委会值班,协助村委会工作人员完成各项村内事务。杨营新村严
- 暨南大学计算机考研大纲,2021暨南大学考研大纲参考书目汇总
sherlockhj
暨南大学计算机考研大纲
该楼层疑似违规已被系统折叠隐藏此楼查看此楼来源:http://fangcai.100xuexi.com/Ebook/DigitalLibrary/BookNew.aspx?BookName=%u66A8%u5357%u5927%u5B66暨南大学化学与材料学院《710无机化学》历年考研真题汇编暨南大学理工学院《820数字电子技术》历年考研真题汇编暨南大学《821材料综合》历年考研真题汇编暨南大学《
- 华南理工大学化学考研
Graduate_Box
考研经验分享
华南理工大学化学考研先简单说下我吧,化学专业,一战华工软物质学硕,初试377,复试83.44,总成绩393.08,排名5.听起来好像挺顺利的,但考研人的心酸苦痛和血泪史,怕也只有考研人能懂了。所以我今天斗胆在这总结下我的经验,希望学弟学妹们少走弯路。首先,关于择校。我是在三月末四月初开始选学校的,看到上一届一个跟我成绩排名差不多的学姐成功上岸了武汉大学之后,满腔热血壮志凌云并且十分坚定,浩浩荡荡的
- 子厚讲座《论语·为政第二》下
风清语文
语文百群读书会讲座073期主题:《论语•为政第二》下时间:3月8日周四20:00-21:00主讲:子厚(儒学学者,讲师)讲师简介:张连社,笔名子厚。高级工程师。供职于中石化某研究所,从事油气田开发工程技术研究。1993年毕业于吉林大学化学系,后进修于中国地质大学(北京),获工学博士学位。业余爱好中国传统文化,广泛涉猎儒学、佛学、古诗词、康德哲学等领域,对儒学有较高造诣。思想上受新儒家梁漱溟、牟宗三
- 青岛农业大学赴临沂沂南实践团:传承时代精神,我们在路上
Chihiro_0abf
中国青年网济南7月28日电(通讯员黄懿娉)2021年是中国共产党建党100周年,同时是中国打赢脱贫攻坚战之后向乡村振兴出发的有效衔接之年,基于此,青岛农业大学化学与药学院赴临沂沂南实践团于7月11日到达沂南县马牧池乡常山庄村开展暑期支教活动。此次支教活动以建党百年为主题,聚焦乡村振兴,将党的创新理论教育融汇到党史教育宣传PPT之中。在丰富多彩的教学活动中,实践队员与当地小朋友们共同感受百年前青年们
- 曲园学子青春三下乡——QFNUteens' team团队组建与第一次线上会议
QFNUteens
我们组建了一支有理想敢奋斗的大学生实践团队——QFNUteens'team,来自曲阜师范大学化学与化工学院。我们团队成员共8位。我们团队建立在专业的基础上,队员敢于吃苦,勇于拼搏。本次活动我们立足于实践,突出于行动,向社会传达“感民情,促民生”的主题。寻找民生足迹,传承实干。走进生活,走进家乡,寻找各地“党史基因”,争做有志青年;开展返家乡社会实践志愿活动,做新时代有为青年;关注社会现状,采取线上
- 原著《蜗居》郭海萍为什么会越过越幸福,不是因为海藻
四月海豚
《蜗居》里得到最好的结局无疑是郭海萍。海藻失去子宫,宋思明死了,只有她无论是事业还是婚姻都特别完美。她在事业上一路开挂,开了一所培训学校,多次想离婚的她,也从鸡飞狗跳的婚姻生活中解放出来,夫妻恩爱,日子越过越好。海萍可以改变这一切,并不仅仅因为海藻,原因有以下几点。01海萍不幸福的原因是能力太小,欲望太大,所以日子过得拧巴难受。海萍是名牌大学化学系毕业,没有找对口的工作,而是找了一份文员的工作,每
- 算法 单链的创建与删除
换个号韩国红果果
c算法
先创建结构体
struct student {
int data;
//int tag;//标记这是第几个
struct student *next;
};
// addone 用于将一个数插入已从小到大排好序的链中
struct student *addone(struct student *h,int x){
if(h==NULL) //??????
- 《大型网站系统与Java中间件实践》第2章读后感
白糖_
java中间件
断断续续花了两天时间试读了《大型网站系统与Java中间件实践》的第2章,这章总述了从一个小型单机构建的网站发展到大型网站的演化过程---整个过程会遇到很多困难,但每一个屏障都会有解决方案,最终就是依靠这些个解决方案汇聚到一起组成了一个健壮稳定高效的大型系统。
看完整章内容,
- zeus持久层spring事务单元测试
deng520159
javaDAOspringjdbc
今天把zeus事务单元测试放出来,让大家指出他的毛病,
1.ZeusTransactionTest.java 单元测试
package com.dengliang.zeus.webdemo.test;
import java.util.ArrayList;
import java.util.List;
import org.junit.Test;
import
- Rss 订阅 开发
周凡杨
htmlxml订阅rss规范
RSS是 Really Simple Syndication的缩写(对rss2.0而言,是这三个词的缩写,对rss1.0而言则是RDF Site Summary的缩写,1.0与2.0走的是两个体系)。
RSS
- 分页查询实现
g21121
分页查询
在查询列表时我们常常会用到分页,分页的好处就是减少数据交换,每次查询一定数量减少数据库压力等等。
按实现形式分前台分页和服务器分页:
前台分页就是一次查询出所有记录,在页面中用js进行虚拟分页,这种形式在数据量较小时优势比较明显,一次加载就不必再访问服务器了,但当数据量较大时会对页面造成压力,传输速度也会大幅下降。
服务器分页就是每次请求相同数量记录,按一定规则排序,每次取一定序号直接的数据
- spring jms异步消息处理
510888780
jms
spring JMS对于异步消息处理基本上只需配置下就能进行高效的处理。其核心就是消息侦听器容器,常用的类就是DefaultMessageListenerContainer。该容器可配置侦听器的并发数量,以及配合MessageListenerAdapter使用消息驱动POJO进行消息处理。且消息驱动POJO是放入TaskExecutor中进行处理,进一步提高性能,减少侦听器的阻塞。具体配置如下:
- highCharts柱状图
布衣凌宇
hightCharts柱图
第一步:导入 exporting.js,grid.js,highcharts.js;第二步:写controller
@Controller@RequestMapping(value="${adminPath}/statistick")public class StatistickController { private UserServi
- 我的spring学习笔记2-IoC(反向控制 依赖注入)
aijuans
springmvcSpring 教程spring3 教程Spring 入门
IoC(反向控制 依赖注入)这是Spring提出来了,这也是Spring一大特色。这里我不用多说,我们看Spring教程就可以了解。当然我们不用Spring也可以用IoC,下面我将介绍不用Spring的IoC。
IoC不是框架,她是java的技术,如今大多数轻量级的容器都会用到IoC技术。这里我就用一个例子来说明:
如:程序中有 Mysql.calss 、Oracle.class 、SqlSe
- TLS java简单实现
antlove
javasslkeystoretlssecure
1. SSLServer.java
package ssl;
import java.io.FileInputStream;
import java.io.InputStream;
import java.net.ServerSocket;
import java.net.Socket;
import java.security.KeyStore;
import
- Zip解压压缩文件
百合不是茶
Zip格式解压Zip流的使用文件解压
ZIP文件的解压缩实质上就是从输入流中读取数据。Java.util.zip包提供了类ZipInputStream来读取ZIP文件,下面的代码段创建了一个输入流来读取ZIP格式的文件;
ZipInputStream in = new ZipInputStream(new FileInputStream(zipFileName));
&n
- underscore.js 学习(一)
bijian1013
JavaScriptunderscore
工作中需要用到underscore.js,发现这是一个包括了很多基本功能函数的js库,里面有很多实用的函数。而且它没有扩展 javascript的原生对象。主要涉及对Collection、Object、Array、Function的操作。 学
- java jvm常用命令工具——jstatd命令(Java Statistics Monitoring Daemon)
bijian1013
javajvmjstatd
1.介绍
jstatd是一个基于RMI(Remove Method Invocation)的服务程序,它用于监控基于HotSpot的JVM中资源的创建及销毁,并且提供了一个远程接口允许远程的监控工具连接到本地的JVM执行命令。
jstatd是基于RMI的,所以在运行jstatd的服务
- 【Spring框架三】Spring常用注解之Transactional
bit1129
transactional
Spring可以通过注解@Transactional来为业务逻辑层的方法(调用DAO完成持久化动作)添加事务能力,如下是@Transactional注解的定义:
/*
* Copyright 2002-2010 the original author or authors.
*
* Licensed under the Apache License, Version
- 我(程序员)的前进方向
bitray
程序员
作为一个普通的程序员,我一直游走在java语言中,java也确实让我有了很多的体会.不过随着学习的深入,java语言的新技术产生的越来越多,从最初期的javase,我逐渐开始转变到ssh,ssi,这种主流的码农,.过了几天为了解决新问题,webservice的大旗也被我祭出来了,又过了些日子jms架构的activemq也开始必须学习了.再后来开始了一系列技术学习,osgi,restful.....
- nginx lua开发经验总结
ronin47
使用nginx lua已经两三个月了,项目接开发完毕了,这几天准备上线并且跟高德地图对接。回顾下来lua在项目中占得必中还是比较大的,跟PHP的占比差不多持平了,因此在开发中遇到一些问题备忘一下 1:content_by_lua中代码容量有限制,一般不要写太多代码,正常编写代码一般在100行左右(具体容量没有细心测哈哈,在4kb左右),如果超出了则重启nginx的时候会报 too long pa
- java-66-用递归颠倒一个栈。例如输入栈{1,2,3,4,5},1在栈顶。颠倒之后的栈为{5,4,3,2,1},5处在栈顶
bylijinnan
java
import java.util.Stack;
public class ReverseStackRecursive {
/**
* Q 66.颠倒栈。
* 题目:用递归颠倒一个栈。例如输入栈{1,2,3,4,5},1在栈顶。
* 颠倒之后的栈为{5,4,3,2,1},5处在栈顶。
*1. Pop the top element
*2. Revers
- 正确理解Linux内存占用过高的问题
cfyme
linux
Linux开机后,使用top命令查看,4G物理内存发现已使用的多大3.2G,占用率高达80%以上:
Mem: 3889836k total, 3341868k used, 547968k free, 286044k buffers
Swap: 6127608k total,&nb
- [JWFD开源工作流]当前流程引擎设计的一个急需解决的问题
comsci
工作流
当我们的流程引擎进入IRC阶段的时候,当循环反馈模型出现之后,每次循环都会导致一大堆节点内存数据残留在系统内存中,循环的次数越多,这些残留数据将导致系统内存溢出,并使得引擎崩溃。。。。。。
而解决办法就是利用汇编语言或者其它系统编程语言,在引擎运行时,把这些残留数据清除掉。
- 自定义类的equals函数
dai_lm
equals
仅作笔记使用
public class VectorQueue {
private final Vector<VectorItem> queue;
private class VectorItem {
private final Object item;
private final int quantity;
public VectorI
- Linux下安装R语言
datageek
R语言 linux
命令如下:sudo gedit /etc/apt/sources.list1、deb http://mirrors.ustc.edu.cn/CRAN/bin/linux/ubuntu/ precise/ 2、deb http://dk.archive.ubuntu.com/ubuntu hardy universesudo apt-key adv --keyserver ke
- 如何修改mysql 并发数(连接数)最大值
dcj3sjt126com
mysql
MySQL的连接数最大值跟MySQL没关系,主要看系统和业务逻辑了
方法一:进入MYSQL安装目录 打开MYSQL配置文件 my.ini 或 my.cnf查找 max_connections=100 修改为 max_connections=1000 服务里重起MYSQL即可
方法二:MySQL的最大连接数默认是100客户端登录:mysql -uusername -ppass
- 单一功能原则
dcj3sjt126com
面向对象的程序设计软件设计编程原则
单一功能原则[
编辑]
SOLID 原则
单一功能原则
开闭原则
Liskov代换原则
接口隔离原则
依赖反转原则
查
论
编
在面向对象编程领域中,单一功能原则(Single responsibility principle)规定每个类都应该有
- POJO、VO和JavaBean区别和联系
fanmingxing
VOPOJOjavabean
POJO和JavaBean是我们常见的两个关键字,一般容易混淆,POJO全称是Plain Ordinary Java Object / Plain Old Java Object,中文可以翻译成:普通Java类,具有一部分getter/setter方法的那种类就可以称作POJO,但是JavaBean则比POJO复杂很多,JavaBean是一种组件技术,就好像你做了一个扳子,而这个扳子会在很多地方被
- SpringSecurity3.X--LDAP:AD配置
hanqunfeng
SpringSecurity
前面介绍过基于本地数据库验证的方式,参考http://hanqunfeng.iteye.com/blog/1155226,这里说一下如何修改为使用AD进行身份验证【只对用户名和密码进行验证,权限依旧存储在本地数据库中】。
将配置文件中的如下部分删除:
<!-- 认证管理器,使用自定义的UserDetailsService,并对密码采用md5加密-->
- mac mysql 修改密码
IXHONG
mysql
$ sudo /usr/local/mysql/bin/mysqld_safe –user=root & //启动MySQL(也可以通过偏好设置面板来启动)$ sudo /usr/local/mysql/bin/mysqladmin -uroot password yourpassword //设置MySQL密码(注意,这是第一次MySQL密码为空的时候的设置命令,如果是修改密码,还需在-
- 设计模式--抽象工厂模式
kerryg
设计模式
抽象工厂模式:
工厂模式有一个问题就是,类的创建依赖于工厂类,也就是说,如果想要拓展程序,必须对工厂类进行修改,这违背了闭包原则。我们采用抽象工厂模式,创建多个工厂类,这样一旦需要增加新的功能,直接增加新的工厂类就可以了,不需要修改之前的代码。
总结:这个模式的好处就是,如果想增加一个功能,就需要做一个实现类,
- 评"高中女生军训期跳楼”
nannan408
首先,先抛出我的观点,各位看官少点砖头。那就是,中国的差异化教育必须做起来。
孔圣人有云:有教无类。不同类型的人,都应该有对应的教育方法。目前中国的一体化教育,不知道已经扼杀了多少创造性人才。我们出不了爱迪生,出不了爱因斯坦,很大原因,是我们的培养思路错了,我们是第一要“顺从”。如果不顺从,我们的学校,就会用各种方法,罚站,罚写作业,各种罚。军
- scala如何读取和写入文件内容?
qindongliang1922
javajvmscala
直接看如下代码:
package file
import java.io.RandomAccessFile
import java.nio.charset.Charset
import scala.io.Source
import scala.reflect.io.{File, Path}
/**
* Created by qindongliang on 2015/
- C语言算法之百元买百鸡
qiufeihu
c算法
中国古代数学家张丘建在他的《算经》中提出了一个著名的“百钱买百鸡问题”,鸡翁一,值钱五,鸡母一,值钱三,鸡雏三,值钱一,百钱买百鸡,问翁,母,雏各几何?
代码如下:
#include <stdio.h>
int main()
{
int cock,hen,chick; /*定义变量为基本整型*/
for(coc
- Hadoop集群安全性:Hadoop中Namenode单点故障的解决方案及详细介绍AvatarNode
wyz2009107220
NameNode
正如大家所知,NameNode在Hadoop系统中存在单点故障问题,这个对于标榜高可用性的Hadoop来说一直是个软肋。本文讨论一下为了解决这个问题而存在的几个solution。
1. Secondary NameNode
原理:Secondary NN会定期的从NN中读取editlog,与自己存储的Image进行合并形成新的metadata image
优点:Hadoop较早的版本都自带,