PNAS:alpha频率经颅电刺激调控大脑默认网络
默认模式网络(DMN)是最重要的内在连接网络,是大脑功能组织的关键架构。相反,失调的DMN是主要神经精神疾病的特征。然而,该领域仍然缺乏对DMN调控的机制和对DMN调控失调的有效干预。目前的研究通过操纵神经同步来解决这个问题,特别是α(8-12Hz)振荡,这是一种主要的内在振荡活动,在功能和生理上与DMN越来越相关。使用高分辨率α-频率经颅交流电流刺激(α-tACS)刺激皮层α振荡源,结合同时脑电图和功能MRI(EEG- fMRI),我们证明了α-tACS(与伪对照相比)不仅增强了脑电图α振荡,还增强了DMN核心内的fMRI和(源水平)α连接。重要的是,α振荡的增加介导了DMN连接的增强。因此,这些发现确定了α振荡和DMN功能之间的机制联系。经颅α调制可以上调DMN,进一步强调了一种有效的非侵入性干预,以使各种疾病中的DMN功能正常化。
1.简介
大脑自组织成大规模的内在网络已被广泛认识。这种内在组织对正常的神经功能是如此的基础,它控制着大脑60%到80%的能量。两种主要机制内在区域间连接和神经元间同步被认为是支撑大脑组织的基础。默认模式网络(DMN),产生于内在区域间连接,纵横交错的大脑的大部分,占据内在连接网络的顶点和支配大脑内在活动.因此,DMN支持高级的人类心智能力(例如,意识、自我参照、社会推理、回忆过去和期待未来),而其失调是主要神经精神疾病的特征(例如,DMN在重度抑郁症中的高连通性和阿尔茨海默病、精神分裂症和创伤后应激障碍中的低连通性)。然而,管理DMN的机制仍然难以捉摸,同时缺乏有效的干预DMN失调。
神经元间的同步被认为与区域间的连接有内在的联系,并通过神经发育潜在地结合和塑造这种连接。重要的是,α(8-12Hz)振荡,内部神经同步的主要节奏,与DMN的功能有关。事实上,神经成像和神经计算的快速发展已经带来了越来越多的证据,表明α振荡和DMN之间存在多方面的生理和功能联系。生理学上,静息状态(RS)同时脑电图-功能磁共振(EEG-fMRI)记录已经揭示了α振荡和DMN活性之间的内在正耦合。与它在远程神经通信中的作用类似,α振荡被发现是连接DMN(后扣带皮层[PCC]和内侧前额叶皮层[mPFC])前后中枢的主要神经同步。从功能上说,α振荡和DMN都参与使大脑脱离感觉环境和维持RS,而α去同步和DMN连接障碍,包括α振荡PCC-mPFC连接的特异性破坏,在几种主要的神经精神疾病(如阿尔茨海默病、精神分裂症和创伤后应激障碍)中同时发生。
尽管如此,α振荡和DMN之间的这些联系在本质上仍然是相关的,需要实验研究来确定它们的机械联系。由于其主要来源(枕顶叶皮层)接近头皮,α振荡对经颅刺激有高度的响应,可以成为一个可行的实验操作目标。在众多的经颅刺激技术中,经颅交流电刺激(tACS)通过头皮应用频率比正弦电流,通过调谐频率和振幅以及振荡相位来模拟和引入内源性振荡,具有独特的优势。后者,通过加强相位同步,可以特别有效地促进区域间的连接。因此,我们实验性地操纵α振荡与MR兼容的高分辨率(HD) α频率tACS (α-tACS),以枕顶叶α相位源为目标。使用RS同时脑电图-功能磁共振记录,我们测量了tACS前后α同步(脑电图α功率和连接)和DMN连接(fMRI血氧水平依赖[BOLD]连接)的同步变化(与伪对照相比),并验证了通过tACS增强α同步可以促进BOLD波动的同步,导致DMN连通性增加的假设。
2.结果
2.1 tACS效果的验证(α-tACS增加α功率和连接)
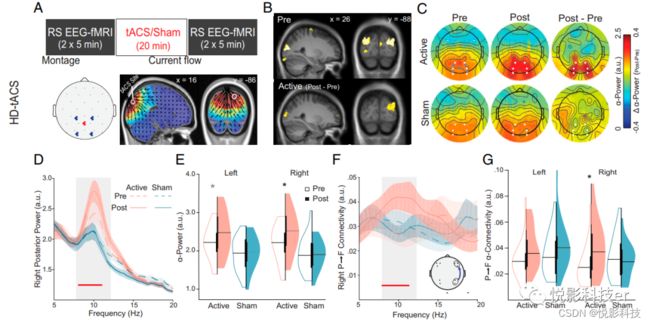
使用4x1蒙太奇在枕顶骨中线位置应用HD tACS(4个周围+1个中心电极形成闭合回路;图1A),它们被选来最大限度地瞄准主要的α皮质源——枕顶叶皮层。之前的工作已经证明了这种tACS协议在增强α局部功率和远程连通性方面的有效性和可重复性。基于标准头部模型的电流分布的有限元模型模拟证实了枕顶叶皮层的最大电场(0.21 V/m)(峰值在枕顶叶交界处;x, y, z=16,86,36),相对于额区最小电场(< 0.02 V/m)。另一个基于区域头部模型(Active组的平均T1)的有限元模型估计得出了类似的电流分布(SI附录,图s1)。Active组脑电图α功率源水平分析显示,右侧枕顶叶皮层的α功率最大(图1B)。总之,这些结果证实了我们的tACS准确地瞄准了枕顶叶皮层。
重要的是,为了支持α-tACS的疗效,我们观察到Active (versus Sham)组从刺激前到刺激后右侧后α功率和右侧后额α连接(P到F)增加(图1C-G)。这些影响,包括右半球优势,重复了我们之前的tACS发现。具体而言,tACS后,active组(n=17)右侧后α功率较基线显著增加,而Sham组(n=19;图1C E)无变化。双重对比()进一步证实了Active组(与Sham组相比)的特异性α功率增加。Active组左后α功率增高,但双对比后未见增强。最近的神经计算和电生理(包括颅内记录)研究证明了这一点,α投射跟踪一个选择性的P到F方向(即,有向的P到F连接)通过P到F皮质同步或行波。因此,我们使用格兰杰因果分析(GC)来检验这种α连通性的变化。我们发现Active组也表现出右半球α P到F连接的增加, Sham组同样不存在(图1F,G和SI附录,图S3)。类似的双重对比证实了α连接增加是Active组特有的。对面的F到P连通性不受tACS的影响(SI附录)。最后,如图1D和F所示,功率和连通性的增加都受α频率的限制,突出了tACS对α振荡的具体影响。
图1 α-tACS协议和效果验证
2.2 α-tACS增加DMN BOLD连接
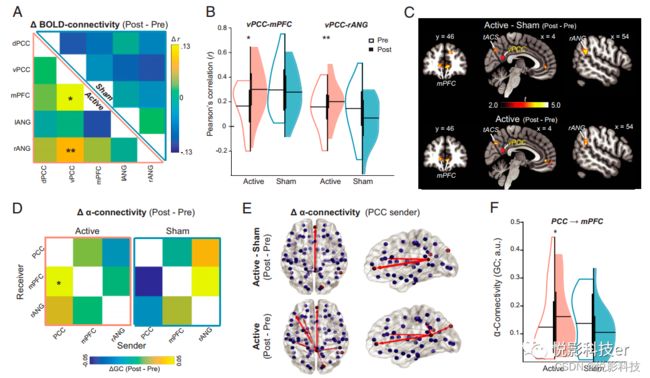
从刺激前后的DMN感兴趣区域(ROIs)中线枢纽(mPFC以及PCC-vPCC和dPCC的腹侧和背侧分支)和关键侧节点(左/右角回[ANG])中提取RS fMRI BOLD时间序列,进行基于ROIs的功能连接分析(随后根据错误发现率[FDR]进行多重比较校正)。Active组在tACS后显示vPCC-mPFC和vPCC-rANG连接增加(图2A-C)。Sham组无变化,而双对比()进一步证实这些增加是Active组特有的。全脑vPCC-seed连接图(简单对比和双重对比)证实了这些结果,重要的是,表明增加主要受DMN的限制(图2C和SI附录,图S2)。
2.3 α- tACS介导的DMN连接增强
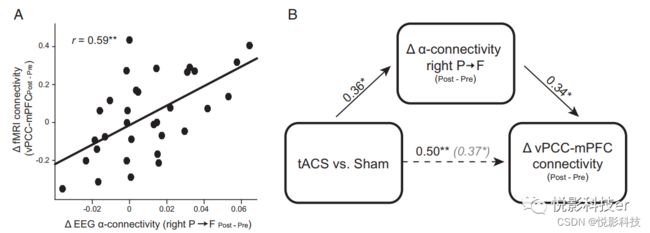
相关分析表明,BOLD vPCC-mPFC连接从基线开始的增加与αP到F连接增加强相关(r = 0.59,图3S=A;由于tACS显著增强了右半球GC,我们将这种右侧GC改变与DMN连接改变关联起来)。此外,这种相关性在两组中各自显著,突出了DMN和α连接之间稳健的内在耦合。P到F在其他频率(delta、theta和beta)的连接显示没有这种关联,表明α频率连接变化和DMN连接之间存在独特的关联。此外,BOLD vPCC-rANG的增加与α连接性无关,突出了α P到F连接与DMN前后侧连接的关系。重要的是,一项关于tACS调制BOLD vPCC-mPFC连接的中介分析揭示了α P到F连接的显著间接影响,表明α P到F连接性介导tACS对BOLD vPCC-mPFC连接性的影响(图3B)。
图2 α-tACS增强DMN中的BOLD和α连通性(假设检验)
图3 α P到F连接增加通过α-tACS介导DMN连接增强
2.4 α-tACS增加了tACS站点和DMN之间的连接
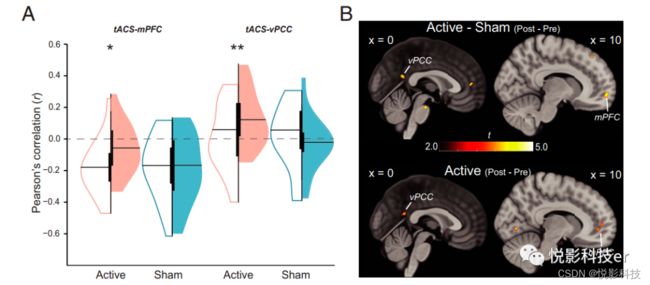
为了获得对tACS诱导的神经调节机制的了解,我们检查了tACS位点和DMN之间的BOLD连接(在体素周围的一个10mm的球,最大的tACS电场;图1A)。Active组tACS站点连接增强, Sham组无变化(图4)。双对比进一步证实了Active组(与Sham组相比)的特异性增加。Active组tACS站点-mPFC连接增强, Sham组无变化。再次,双侧对比证实了Active组的增加是特定的。tACS对tACS站点-rANG连接没有影响。基于全脑tACS站点基于种子的连接分析证实了这些结果,但显示DMN外的连接几乎没有变化(SI附录和图4B)。
图4 tACS站点和DMN之间增加的连接
2.5 复制和控制研究(高分辨率EEG-tACS)
为了进一步明确α- tACS效应并排除电刺激的频率无关效应,我们在主动控制条件下(经颅随机噪声刺激[tRNS])进行了独立的α- tACS研究(n=34)。我们发现右侧后α功率和右半球P到F α- tACS后的α连通性显著增加, tRNS后无变化。同样,在源水平,我们观察到α- tACS后α-频率DMN (PCC到mPFC)连接性显著增加,而tRNS没有增加。总之,这些结果不仅重复了主要研究的发现,而且强调了特定的α- tACS效应。更多的研究细节在附录中提供。
3.讨论
结合MR兼容的HDα-tACS和同时使用的EEG-fMRI,我们证明枕顶叶皮层α- tACS源不仅增强了α振荡,而且加强了DMN内的BOLD和α频率振荡连接。重要的是,tACS诱导的P到F α连接介导了DMN核心(vPCC-mPFC)之间BOLD连接的tACS增强。相比之下,在α频率或DMN之外没有出现tACS效应。这些结果表明,DMN可以通过经颅刺激α振荡而上调。此外,他们提供了将α振荡,特别是α连接,机械地与DMN联系起来的实验证据,进一步证实了α -DMN相互依赖的概念。
后α功率和P到F α连接分别反映枕顶叶皮层的局部α同步和枕顶叶皮层到额叶皮层的远程同步。我们的脑电图数据证实,tACS增强了目标枕顶叶皮层的α功率,以及P到F连通性,表明tACS调制局部和远处区域间同步。虽然这两种类型的tACS调制经常同时发生,但它们可以分离。例如,我们之前的tACS研究证明了增强的P到Fα连接在tACS后24小时持续,即使α功率恢复到基线水平。通过突触上的脉冲时间依赖的可塑性和长期增强潜在地加强振荡回路,α-tACS可以对远距神经通信(即α频率连接)和BOLD连接产生(即时和持久的)影响,而不仅仅是局部功率增强(通过神经传导)。
然而,只有少数α- tACS - fMRI研究检测了网络水平效应,这些研究使用了不同的刺激蒙太奇和协议,得出了不明确的结果。利用选择性的P到F α振荡投射,我们应用HD tACS对枕顶叶皮层的α发生器进行集中刺激,以优化网络级调制。颅内电流估计(基于标准和现实头部模型)证实了目标区域的聚焦电场。因此,tACS不仅增强了α P到F连接,但我们的中介分析也表明,这种tACS增强了α P到F连接促进DMN连接的总tACS上调。
参考文献:Transcranial stimulation of alpha oscillations up-regulates the default mode network