易基因|PBJ文章:微量ChIP-seq揭示水稻减数分裂细胞的组蛋白修饰基因转录调控
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
2022年09月02日,南京农业大学-作物遗传与种质创新国家重点实验室张文利教授课题组与扬州大学-江苏省粮食作物现代产业技术协同创新中心程祝宽教授课题组,联合在“Plant Biotechnology Journal”杂志题为“Low cell number ChIP-seq reveals chromatin state-based regulation of gene transcription in the rice male meiocytes”的研究文章。本研究通过微量细胞(10000个细胞)的ChIP-seq对水稻花粉母细胞减数分裂前期I的H3K4me3和H3K27me3进行全基因组组蛋白修饰分析。
标题:Low cell number ChIP-seq reveals chromatin state-based regulation of gene transcription in the rice male meiocytes
发表期刊:Plant Biotechnol J
发表日期:2022年09月02日
影响因子:13.263 /1区
方法:微量ChIP-seq
摘要:
减数分裂(细胞分裂方式)是生物细胞中染色体数目减半的分裂方式,基因转录和染色质结构的重编程在调节植物减数分裂进程具有非常重要的调节作用。由于常规染色质免疫沉淀(ChIP)实验需要的细胞量较多,植物雄性减数分裂细胞的染色质分析尚未完全阐明,导致染色质修饰影响减数分裂基因表达机制仍不清楚。本研究采用的微量细胞ChIP-seq技术(LCNChIP-seq),利用约10000个减数分裂前期Ⅰ的水稻花粉母细胞,绘制了全基因组H3K4me3和H3K27me3的组蛋白修饰图谱,两个标记各设置2个生物学重复。分别鉴定出25715个H3K4me3和16414个H3K27me3可重复peaks,其中3598个两种修饰标记同时存在的基因组位点,称为H3K4-K27me3,表明该时期的基因表达受两种修饰共同调控。将每个标记的ChIP-seq reads与基因表达水平进行关联分析,结果发现H3K4me3丰度与基因表达水平正相关,H3K27me3丰度与基因表达水平负相关。
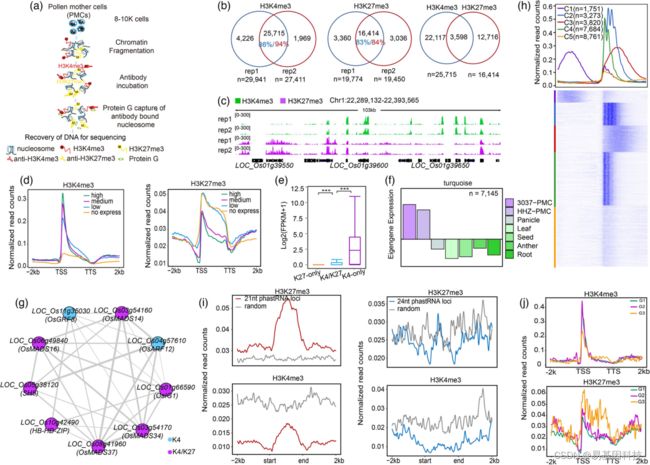
图:水稻雄性减数分裂细胞的H3K4me3和H3K27me3表征。
(a)LCNChIP-seq实验流程图。
(b)H3K4me3、H3K27me3、H3K4me3/H3K27me3(称为H3K4-K27me3)可重复peaks和交集部分Venn图。
(c)H3K4me3和H3K27me3的可重复peaks IGV图。
(d)TSS-TTS不同表达水平的所有基因的标准ChIP-seq reads数分析(FPKM值:高、中、低和无表达)(±2kb)。
(e)H3K4-K27me3、H3K4me3、H3K27me3基因的平均表达水平箱线图。采用Wilcoxon秩和检验确定显著性检验,P<0.001。
(f)共表达基因的共表达模式条形图。
(g)TF(transcription factor,转录因子)聚类分析生成的TF网络。蓝色和紫色点分别表示H3K4me3和H3K4-K27me3标记的TF。灰线的粗细表示共同调节TF数量。
(h)每个子簇中TSS基因的H3K4me3分布曲线图(上)和热图(下)(±2kb)。
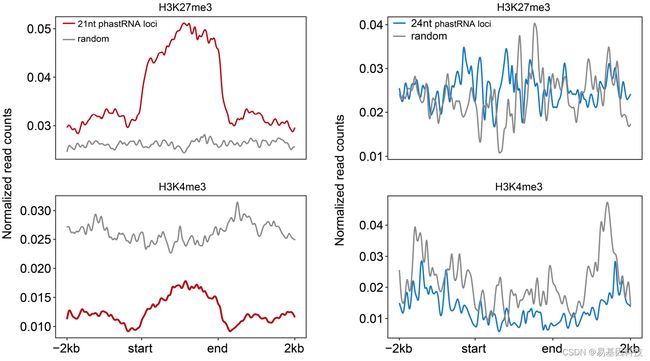
(i)21nt(左)和24nt(右)phasiRNA(phased small interfering RNA)编码位点±2kb范围内的ChIP-seq reads数。
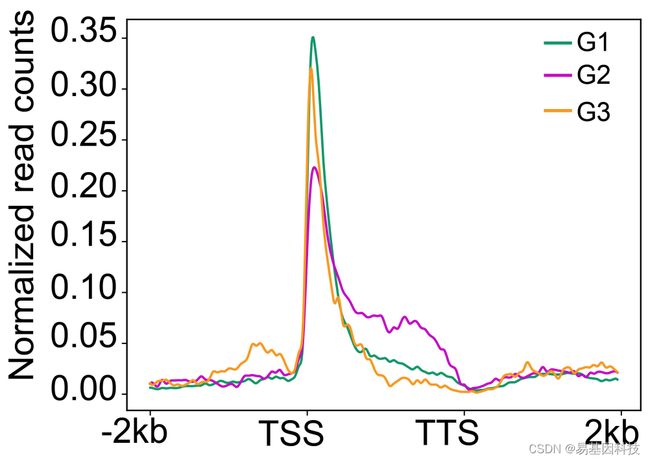
(j)H3K4me3和H3K27me3在拟南芥、玉米、水稻所有物种中TSS-TTS的G1基因中高表达,在水稻的G2基因中高表达,在水稻的G3基因中低表达或不表达、但在拟南芥和玉米的G3基因中高表达(±2kb)。
研究思路:
研究结果
研究人员对19个RNA-seq数据集进行WGCNA分析(加权相关网络分析),鉴定出7145个在前期Ⅰ高表达基因的MEturquoise模块,为研究TF如何调节花粉母细胞(PMC)中的基因表达,构建以中心TF(MEturquoise模块中鉴定的307个TF)为中心的调控网络,发现与花发育相关的子簇包含9个共同调控的TF,包括4个MADS-box TF(OsMADS14/16/34/37)和1个TALE TF(SH5)。7个(约78%)TF受H3K4me3和H3K27me3共同调控,被标记为H3K4-K27me3,只有2个TF在H3K4me3富集。这些结果表明,在PMC的前期I早期高表达的关键TF及其靶基因的子网络分别由H3K4-K27me3和H3K4me3差异调控。
为研究全基因组H3K4me3在PMC前期I中的作用,研究人员进行了k-means聚类分析,得到五个子聚类(C1–C5,k值=5) 发现C3中有849个基因(79个TF)的基因大多在H3K4me3中富集。GO富集分析表明,它们主要富集于植物正常减数分裂过程所必需的GO terms中,功能可能与糖代谢的葡萄糖/乙二醇/己糖基转移酶活性、乙酰转移酶活性、蛋白激酶活性、蛋白质泛素化和DNA结合活性等减数分裂过程相关。这些结果表明,全基因组H3K4me3在减数分裂的基因表达调控中起着重要作用。
为研究在水稻减数分裂细胞和配子中的21nt-phasiRNAs染色质特征,研究人员绘制了标21nt和24nt phasiRNA(phased small interfering RNA)编码位点±2kb范围内的ChIP-seq reads数,结果发现H3K27me3在21nt-phasiRNAs编码位点。与随机对照组相比,没有观察到21nt和24nt phasiRNA编码位点中H3K4me3的任何富集,这种现象在水稻配子中也检测到。这些结果表明,在水稻减数分裂细胞中,H3K4me3和H3K27me3在phasiRNAs或其他非编码RNAs(ncRNAs)编码位点上差异富集。
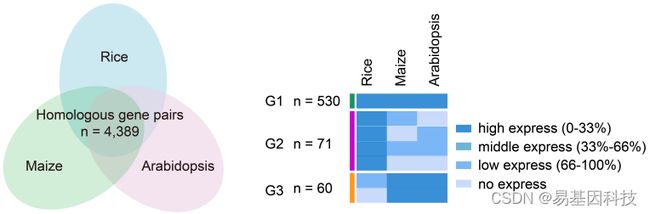
最后,研究人员对拟南芥、玉米、水稻中与减数分裂细胞相关的转录组数据进行分析,共鉴定出4389对同源基因,水稻与其他两个物种的蛋白质序列同一性>50%。得到三个子集群,其中G1基因(n=530)在三个物种均高表达、G2基因(n=71)仅在水稻中高表达,G3基因(n=60)在玉米和拟南芥中高表达。绘制了±2kb范围内每个亚群基因TSSs到TTSs的ChIP-seq reads数,研究人员发现G2基因H3K4me3高丰度,G3基因虽然低H3K4me3丰度、但具有高H3K27me3丰度。对玉米的分析发现H3K4me3丰度与每个亚群的基因表达水平没有直接相关性。这些结果表明H3K4me3与H3K27me3可能在不同物种的减数分裂阶段差异调节同源基因。
本研究利用微量ChIP-seq技术为低细胞input解析减数分裂前期I或其他关键发育阶段的染色质修饰特征提供了一个新参考,从而促进了对植物减数分裂过程的表观基因组调控的理解。
相关图形
图1:H3K4me3和H3K27me3的生物学重复 ChIP-seq数据相关性分析。Pearson相关系数
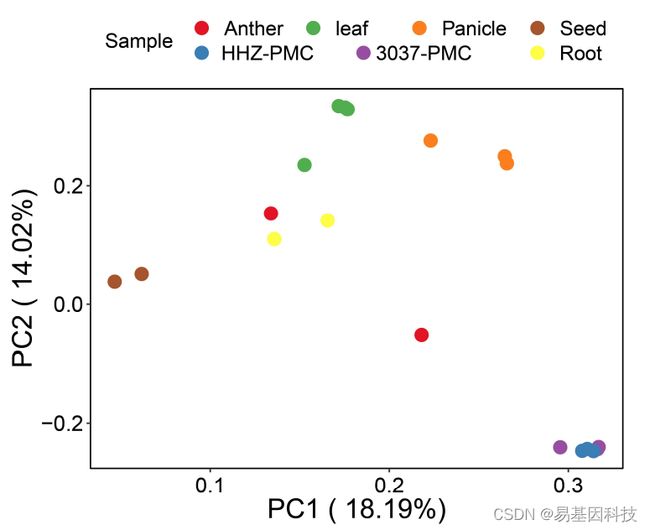
图2:不同水稻组织的RNA-seq数据主成分分析(PCA)(HHZ:水稻品种Huanghuazh)
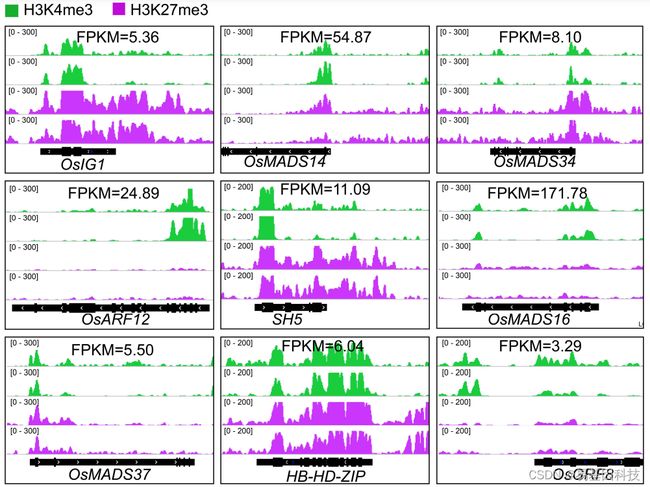
图3: 9个转录因子中H3K4me3和H3K27me3的富集IGV图
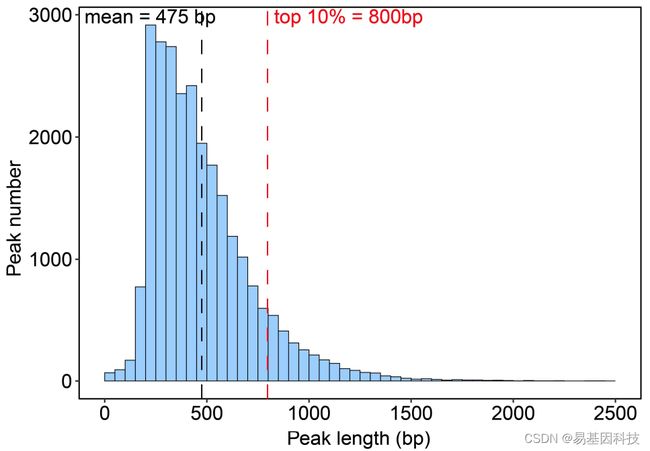
图4: H3K4me3 peaks的长度分布Barlpot图。
黑色虚线代表所有peaks平均长度,红色虚线代表较宽H3K4me3 peak阈值
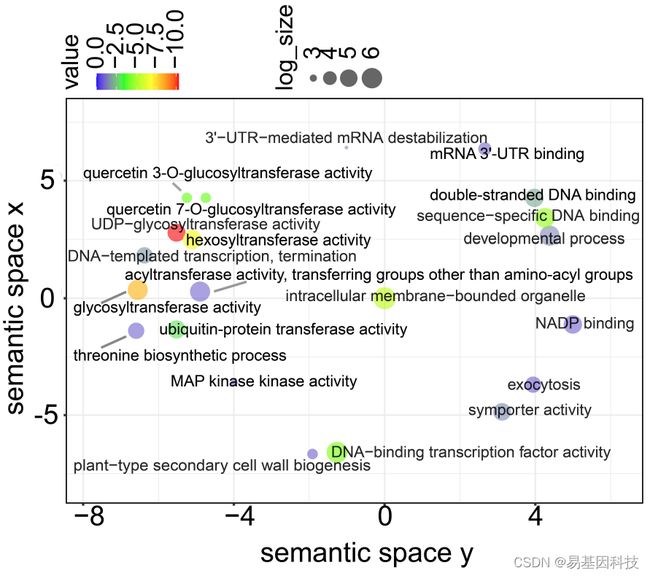
图5:H3K4me3基因GO富集分析
图6:分别对水稻配子中的21nt phasiRNA编码位点(左)和24nt phasiRNA编码位点(右)从起点-2kb到终点+2kb的归一化H3K4me3和H3K27me3 reads数进行剖面分析
图7:miR172d和OsmiR528中H3K4me3和H3K27me3丰度IGV图
图8:三种植物中的同源基因。
(左)拟南芥、玉米和水稻中同源基因与蛋白质序列同一性>50%的交集Venn图。
(右)三种不同亚型的同源基因,G1(n=530)在三种物种中高表达的基因,G2(n=71)仅在水稻中高表达的基因和G3(n=60)在拟南芥和玉米高表达的基因
图9:H3K4me3在G1、G2和G3基因从TSSs到TTSs的±2kb范围内富集程度
关于易基因染色质免疫共沉淀测序 (ChIP-seq) 技术介绍
染色质免疫共沉淀(Chromatin Immunoprecipitation,ChIP),是研究体内蛋白质与DNA相互作用的经典方法。将ChIP与高通量测序技术相结合的ChIP-Seq技术,可在全基因组范围对特定蛋白的DNA结合位点进行高效而准确的筛选与鉴定,为研究的深入开展打下基础。
DNA与蛋白质的相互作用与基因的转录、染色质的空间构型和构象密切相关。运用组蛋白特定修饰的特异性抗体或DNA结合蛋白或转录因子特异性抗体富集与其结合的DNA片段,并进行纯化和文库构建,然后进行高通量测序,通过将获得的数据与参考基因组精确比对,研究人员可获得全基因组范围内某种修饰类型的特定组蛋白或转录因子与基因组DNA序列之间的关系,也可对多个样品进行差异比较。
应用方向:
ChIP 用来在空间上和时间上不同蛋白沿基因或基因组定位
- 转录因子和辅因子结合作用
- 复制因子和 DNA 修复蛋白
- 组蛋白修饰和变异组蛋白
技术优势:
- 物种范围广:细胞、动物组织、植物组织、细菌微生物多物种富集经验;
- 微量建库:只需5ng以上免疫沉淀后的DNA,即可展开测序分析;
- 方案灵活:根据不同的项目需求,选择不同的组蛋白修饰特异性抗体。
有ChIP-seq测序或其他表观组学测序需求的老师可与易基因联系:0755-28317900
参考文献:Zhang A, You H, Cao L, Shi Y, Chen J, Shen Y, Tao S, Cheng Z, Zhang W. Low cell number ChIP-seq reveals chromatin state-based regulation of gene transcription in the rice male meiocytes. Plant Biotechnol J. 2022 Sep 2.
相关阅读:
项目文章|ChIP-seq揭示H3K27me3去甲基化酶在体细胞重编程调控转录机制
ChIP-seq分析方法:实用的工作流程和高级应用
一文看懂:ChIP实验和qPCR定量分析怎么做
项目文章 | ChIP-seq揭示HIV-1感染细胞转录抑制因子Schlafen 5的表观遗传调控机制