【听课笔记】复旦大学遗传学_10肿瘤遗传学
课程地址: 复旦大学遗传学
文章目录
- 十、肿瘤遗传学
-
- 10.1 肿瘤概况
- 10.2 肿瘤发生发展中的遗传学
-
- 10.2.1 癌基因
- 10.2.2 肿瘤抑制基因
- 10.2.3 病毒感染与肿瘤发生
- 10.2.4 表观遗传与肿瘤发生
- 10.3 肿瘤治疗中的遗传学
-
- 10.3.1 肿瘤常规治疗策略
- 10.3.2 靶向治疗
- 10.3.3 免疫治疗
十、肿瘤遗传学
10.1 肿瘤概况
肿瘤的发生
- 多细胞生物的单个/多个细胞发生变异
环境因素:致癌的物理化学因素等
遗传因素:遗传差异
↓ - 细胞分裂失控、逃避机体监视和清除
↓ - 变异细胞形成克隆,即原位肿瘤
↓ - 肿瘤细胞继续变异,具有转移能力,形成癌症
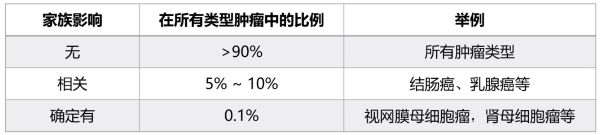
肿瘤的遗传性
-
肿瘤是源于基因变异的疾病,但肿瘤有遗传性的,也有非遗传性的(散发性)。只有在生殖细胞中发生的基因组变异才具有可遗传性。
-
视网膜母细胞瘤 (
retinoblastoma)
儿童眼内恶性肿瘤,发病时期早 (10-14 个月),眼底有灰白肿块,易扩散。遗传型占 35- 45%,多见双侧发病,有家族史。
Rb基因定位于 13q14 -
肾母细胞瘤 (
Wilms tumor)
为儿童腹部肿瘤的首位,恶性实体瘤,多发于婴幼儿时期(出生后 5 年内)。遗传型多为双侧发病。
WT1基因定位于 11p13 -
家族性腺瘤样息肉症 (familial adenomatous polyposis,
FAP)
在青少年时期结肠和直肠已有多发性息肉,其中一些随年龄增加而恶变成结肠癌。
APC基因定位于 5q21
肿瘤的定义
- 赘生物 (
neoplasm):新生物,泛指发生异常增殖的细胞,性质不定。 - 肿瘤 (
tumor / tumour):脱离了接触抑制,锚定依赖,失去生长控制的细胞群。
肿瘤通常指良性的赘生物,未发生侵袭和转移,是原位的。 - 癌症 (
cancer):具有侵袭和转移能力的肿瘤,恶性程度最高。
肿瘤的分类
● 根据肿瘤的不同来源,常见肿瘤类型有:
- 来自于上皮组织的肿瘤 /
carcinoma/ 癌
腺癌 adenocarcinoma
宫颈癌(子宫鳞状上皮) cervical carcinoma - 来自于间叶组织的肿瘤 /
sarcoma/ 肉瘤 (通常转移潜力较大,恶性程度较高)
平滑肌肉瘤(肌细胞) leiomyosarcoma
骨肉瘤(骨细胞) osteosarcoma - 来自于造血系统的肿瘤/
leukemia
髓细胞白血病(骨髓浆细胞)myelocytic leukaemia
淋巴瘤 (B 细胞和 T 细胞)lymphoma - 来自于神经系统的肿瘤
视网膜母细胞瘤(视网膜细胞)retinoblastoma
星形细胞瘤(星形胶质细胞)astrocytoma
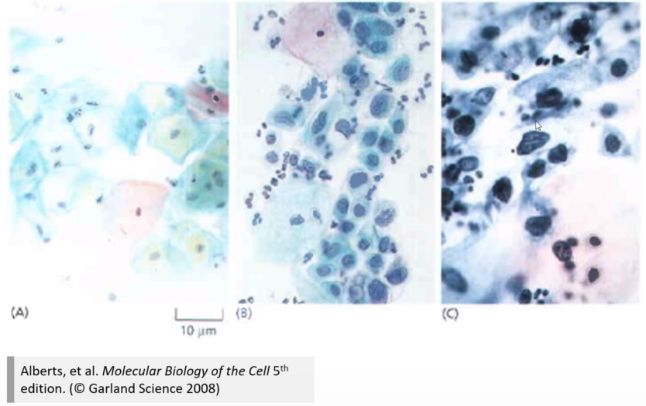
肿瘤的细胞学特征
-
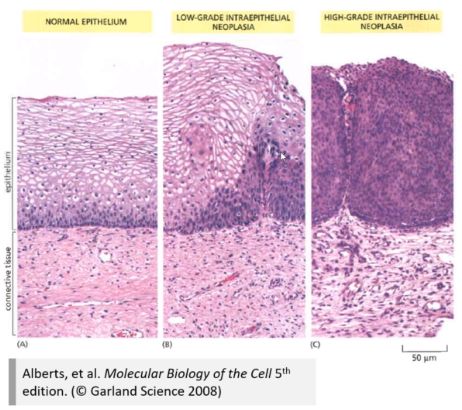
(1)生长失控
A:正常子宫颈(仅有基底层的单层细胞处于快速增殖状态)
B:初级赘生物形成(增殖的细胞群从基底层向外扩散)
C:整个上皮组织被去分化,快速增殖的细胞群替代,形成肿瘤(原位瘤,基底膜还是完整的,没有发生侵袭)。
-
(2)核型变异
A: 正常子宫颈(细胞分化正常,小核,胞质大,着色均匀)
B: 病变子宫颈(可见大量不成熟细胞,少量分化细胞,细胞核增大,核型多样化)
C: 肿瘤(细胞去分化,大核,核型变异多,间接反映存在大量基因组不稳定)
-
(3)浸润与转移
■ 浸润 (invasion) 是恶性肿瘤区别于良性肿瘤的显著特征。
D: 浸润性宫颈癌形成(肿瘤细胞突破基底层细胞外的层纤维基质,向结缔组织浸润性生长)

■ 转移 (metastasis) 是恶性肿瘤(癌)的最危险特征。
恶性的肿瘤细胞从原发灶突破基底膜浸润到邻近组织中,进一步浸润到血液或淋巴管,随体液在体内循环,并在另一组织处着床,再浸润到相应的实质组织中,通过快速增殖可形成转移灶。 -
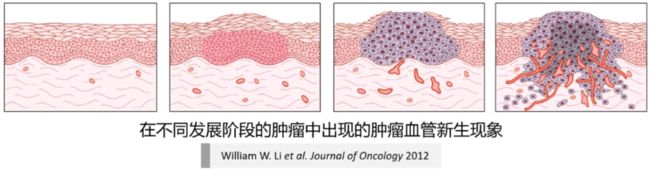
(4)肿瘤血管新生
■ 肿瘤血管新生 (tumor angiogenesis) :浸润到肿瘤组织内部的新的血管网络的形成过程。肿瘤血管新生对于肿瘤的生长,侵袭和转移具有重要的调控作用。
△ 原位肿瘤越长越大,内部会出现缺氧、排泄物堆积,肿瘤的高变异性使得肿瘤分泌促血管新生因子,招募周围的毛细血管向肿瘤内部生长,形成肿瘤血管。
■ 促血管新生因子 (pro-angiogenic factor) 和抗血管新生因子 (anti-angiogenic factor) 动态平衡调控肿瘤血管新生。
-
(5)其他特征
Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell. 2011.
① Evading growth suppressors
② Sustaining proliferative signaling
③ Deregulating cellular energetics
④ Resisting cell death
⑤ Genome instability & mutation
⑥ Inducing angiogenesis
⑦ Activating invasion & metastasis
⑧ Tumor-promoting inflammation
⑨ Enabling replicative immortality
⑩ Avoiding immune destruction

10.2 肿瘤发生发展中的遗传学
- 肿瘤发生是一系列基因连续突变的累积结果


- 肿瘤发生模型
■ 研究提示一个正常上皮细胞突变成为癌细胞可能需要累积 6~7 个突变。
■ 只有连续的突变累积才能使癌变中的正常细胞逃脱机体的各道防御机制,实现恶性增殖和侵袭转移。
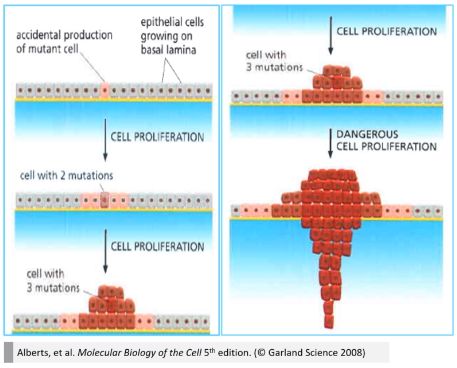
■ 根据 Fearon and Vogelstein (1990) 从手术切除获得的不同时期家族性腺瘤样息肉病患者的结肠标本中进行基因突变的分析,推测出的结肠癌的多步骤发生模型。

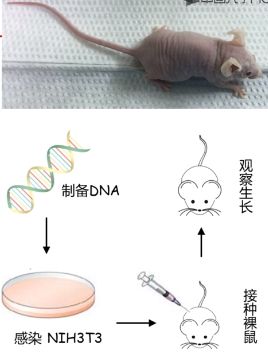
转化实验
-
转化实验可用于鉴定肿瘤相关基因
-
1981 年建立,通过检测某一基因的突变能否引起正常细胞转化为恶性表型,从而判定该基因是否属于肿瘤相关基因。
-
正常小鼠成纤维细胞(常用
NIH3T3)在裸鼠皮下不形成肿瘤。如果转染后的成纤维细胞在裸鼠皮下形成肿瘤灶,则说明导入细胞内部的 DNA 是可以转化正常细胞的肿瘤相关基因的突变体。 -
一般步骤:
(1) 制备目的 DNA
(2) 感染正常成纤维细胞(将目的 DNA 导入到 NIH3T3 细胞中,制备成细胞系)
(3) 皮下接种免疫缺陷小鼠(摘除胸腺,免疫缺陷,因此接受异体来源的细胞时不会出现免疫排斥)
(4) 观察体内细胞生长(观察小鼠皮下是否会长出特定的瘤体)
-
与肿瘤发生相关的遗传变异
a) 癌基因 (oncogene) 突变
b) 肿瘤抑制基因 (tumor suppressor gene,TS gene) 突变
c) 病毒感染(病毒基因)
d) 表观遗传(表观遗传调控的紊乱)
10.2.1 癌基因
第一个癌基因
Ras
- Nature 1982, 297:479-483.
人为地高表达人的 Ras 基因可以引起细胞转化和裸鼠成瘤。
进一步研究发现,在大鼠肉瘤病毒和人的膀胱癌细胞系中存在异常活跃的 Ras 基因。 - Ras 蛋白在细胞周期上游发挥调控作用,G1→S 有一个细胞周期检验点,检测细胞是否处于正常状态,这个检验点的激活依赖于 cyclinD,而 cyclinD 的合成依赖于生长因子,细胞外的生长因子促进细胞内 cyclinD 的合成需要通过 Ras 的调节,Ras 蛋白根据外界环境变化调节细胞内 cyclinD 的合成,从而调节细胞分裂。
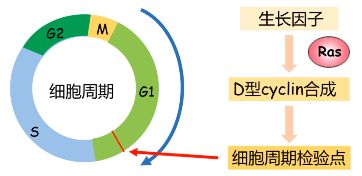
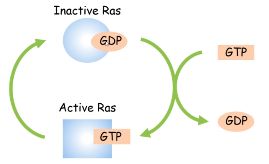
- 正常的 Ras 蛋白在细胞分裂的信号转导中通过动态结合 GDP/GTP 发挥信号转导中的开关作用。
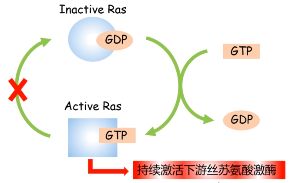
- 突变后的 Ras 癌蛋白可以在不需要信号刺激的情况下与 GTP 牢固结合,持久地处于激活状态,促进细胞的过度生长。
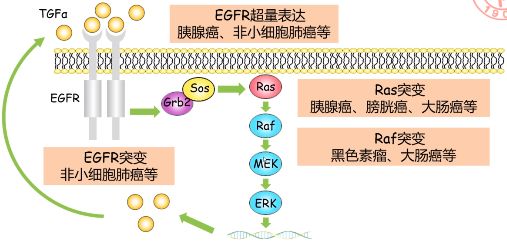
- Ras 通路上的其它癌基因及其激活方式
Ras 上游和下游其他信号转导分子也会参与肿瘤的发生发展,如 Ras 上游 EGFR 的过表达或突变、Ras 下游的 Raf 突变。
癌基因的定义与特点
- 癌基因 (
oncogene):正常情况下促进细胞增殖,但在肿瘤细胞中因功能获得性突变 (gain-of-function mutation) 产生过度或不恰当的活跃形式,促使肿瘤细胞获得无限生长的推动力。 - 正常调节细胞增殖,不含有突变形式的癌基因被称作原癌基因 (
proto-oncogene)。原癌基因和癌基因相当于是一对等位基因。 - 原癌基因高度保守,从酵母到人中都普遍存在,受到精细和严格的控制,调控细胞的生长,分裂和分化等。
■ 原癌基因参与正常细胞的生长和增殖调控。
■ 当原癌基因突变成癌基因后,调控细胞生长的通路被过度激活。

- 原癌基因只需要单拷贝的突变就可以成为有功能的癌基因。
- 原癌基因的突变或者改变基因产物的生化性质,或者提高基因的表达水平。
- 原癌基因突变的三种常见方式
(1) 编码区错义突变,产物活性上升
(2) 调控区突变,基因转录水平增加
(3) 染色体结构变异,改变基因结构和产物性质,如 BCR/ABL 融合蛋白

10.2.2 肿瘤抑制基因
肿瘤抑制基因
Rb
-
Rb基因是第一个被克隆的肿瘤抑制基因,最早于 1971 年在视网膜母细胞瘤中由 Knudson 发现。 -
在患者体细胞中 Rb 基因的两个拷贝都出现了功能丧失型突变。
-
Rb 基因:200kb,27 exons; mRNA 4.7kb,编码 105kD 的蛋白质,共 928 个氨基酸,可被磷酸化修饰,动态调控细胞周期。
-
RB 蛋白质(低磷酸化水平)能与失活的转录因子 E2F 结合,将细胞周期阻断在 G1 期,抑制 DNA 的复制。Rb 基因突变使其蛋白质失活,E2F 因子被释放,诱导 DNA 的复制和细胞的分裂。
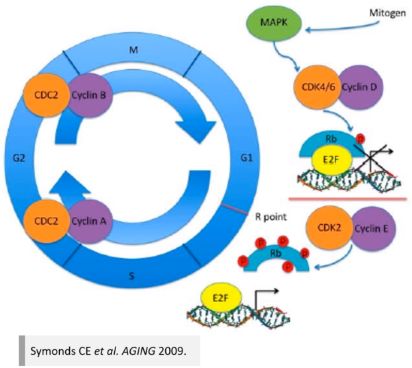
-
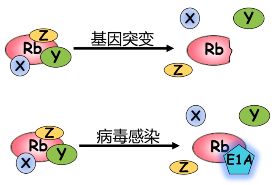
肿瘤抑制基因 Rb 的失活方式
(1) 基因突变或丢失,造成蛋白质产物无活性或者无产物。
(2) 病毒感染造成 RB 蛋白和病毒癌蛋白E1A的结合,不能再和结合蛋白互作。
(3) 过度磷酸化的 RB 蛋白不能和结合蛋白互作。
(4) RB 蛋白质被过度降解,导致 RB 蛋白质产物量不足。

肿瘤抑制基因
TP53
- 临床上超过 50% 的肿瘤有 TP53 异常。TP53 几乎参与肿瘤发生各个途径。
Levine AJ ,Oren M. The first 30years of p53: growing ever morecomplex.Nature Review Cancer.2009;9(10):701-13. TP53基因全长 20kb,定位于人类染色体 17p13.1,编码由 393 个氨基酸组成的 53kD 的核内磷酸化蛋白。- P53 蛋白受到磷酸化、乙酰化、甲基化、泛素化修饰,有与 DNA 和蛋白质结合的活性。
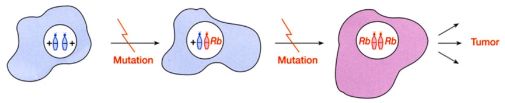
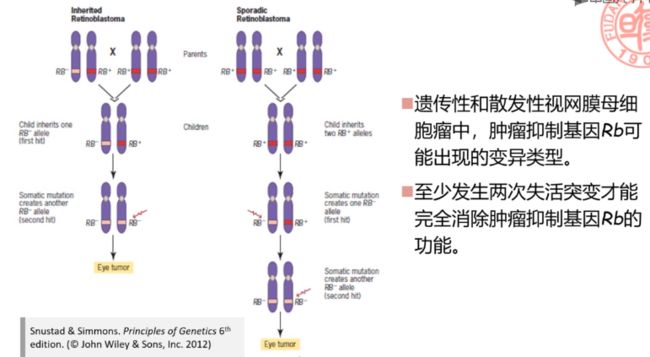
二次突变学说
-
二次突变学说 (
two-hit hypothesis):肿瘤抑制基因有两个正常的拷贝,因此需要两次失活突变才能丧失其抑制肿瘤的作用。 -
在遗传性病例中,第一次突变发生于生殖细胞中,造成个体的每一个体细胞均带有一个突变,成为杂合子;在此基础上发生的第二次突变是体细胞突变。两次突变累加才能完全破坏肿瘤抑制基因的正常功能。
-
在散发性病例中,需要同一个体细胞在一对等位基因上发生连续两次失活突变,发生概率较低。
-
家族性乳腺癌的遗传机制
BRCA1属于肿瘤抑制基因,它的突变可以诱发家族性乳腺癌(显性遗传模式)。在遗传性病例中,第一次 BRCA1 突变发生于生殖细胞中,第二次 BRCA1 突变是体细胞突变。
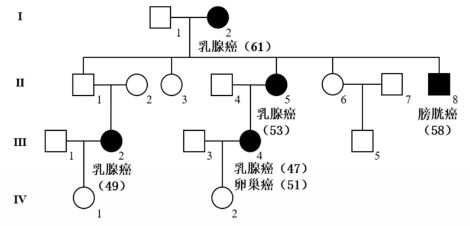
杂合性丢失
-
在肿瘤细胞变异的过程中,当(肿瘤抑制基因)等位基因处于杂合时,会出现丢失或突变的趋势,失去杂合性(变成纯合),称为杂合性丢失 (
Loss of heterozygosity,LOH) 。 -
杂合性丢失的机制
A) 染色体丢失
B) 染色体不分离(多拷贝)
C) 体细胞重组
D) 染色体缺失
E) 基因突变
F) 表观遗传

肿瘤抑制基因的定义与特点
- 肿瘤抑制基因 (
tumor suppressor gene): 正常情况下监控细胞准确复制、正常分裂和生长、程序性凋亡的基因,因为 功能丧失性突变 (loss-of-function mutation) 丧失了正常功能,使异常细胞逃避修复和清除,发展为肿瘤。 - 肿瘤抑制基因需要两个拷贝的突变才具有促进肿瘤发生的功能。
- 突变可以是整个基因丢失,也可以是由于突变或表达抑制造成的基因沉默。
- 肿瘤抑制基因发生功能丧失型突变的常见机制
(1) 编码区错义突变,产物失去活性
(2) 基因丢失
(3) 启动子区域超甲基化,转录抑制

10.2.3 病毒感染与肿瘤发生
- 约 5% 的人类肿瘤由病毒感染引起。
- 1911 年,Rous 发现 Rous 肉瘤病毒 (Rous sarcomavirus,
RSV) 的感染可以诱发家鸡形成肿瘤 (1966 年诺贝尔奖)。 - 1950s,Dulbecco 进一步揭示一些致癌病毒可以整合到人类基因组中,和宿主细胞一起转录表达,从而促进肿瘤发生 (1975 年诺贝尔奖)。
- 能够致癌的病毒可以分为 DNA 病毒和 RNA 病毒两大类,但两者采用的主要机制不同。
■ DNA 病毒常利用自身产物抑制宿主细胞的肿瘤抑制基因产物的活性(蛋白质水平发挥作用)
■ RNA 病毒多通过激活宿主细胞内原癌基因发挥作用(基因组水平发挥作用)
人乳头瘤病毒
HPV(DNA 病毒)
-
人乳头瘤病毒 (human papilloma virus, HPV) 是典型的可诱发肿瘤的 DNA 病毒
-
HPV 有 100 多种,部分和恶性肿瘤密切相关,被称为高危型 HPV。
-
1983 年,德国病毒学家 Harald zur Hausen 首次揭示宫颈癌的发生与高危型 HPV 感染密切相关(2008 年诺贝尔奖)。
-
临床上 70% 的宫颈癌是由 HPV16、18 感染造成的。有性生活的妇女感染过任意一种 HPV 的可能性高达 40~80%。而 80% 左右的 HPV 感染者可在数月内自然清除,只有少数持续高危型 HPV 感染 2 年以上才有可能致癌。
-
1951 年 2 月,从一位宫颈癌患者体内分离得到了一株宫颈癌细胞 HeLa,是使用最为广泛时间最长的人类细胞株。HeLa 细胞携带
HPV18。
-
HPV 疫苗由高危型 HPV 的主要衣壳蛋白组成的病毒样颗粒经高度纯化、混合制成。
■ 价:针对的高危型 HPV 的种类数
■ 用于预防用于 HPV 引起的宫颈癌、外阴癌、阴道癌、肛门癌、生殖器疣、HPV 持续感染等。 -
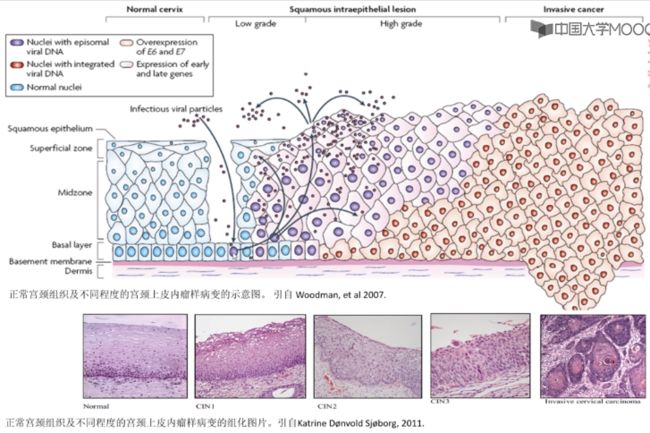
宫颈癌发生过程与 HPV 的关系
■ 如图,正常宫颈上皮细胞(蓝色)下面有一层快速分裂的基底层细胞,上层是较扁平的分化末端的细胞(有功能的上皮细胞,核小胞质大),随着病毒颗粒的感染,病毒颗粒进入快速分裂的基底层细胞后,一起进行 DNA 复制。
■ 携带病毒的子细胞(紫红色)不断增殖,不断侵犯上皮组织,同时,有些细胞死亡后会释放出新的病毒颗粒,进一步感染新的基底层细胞。
■ 后期,病毒 DNA 整合到宿主基因组 DNA 中,肿瘤细胞(黄色)就具有了侵袭和转移的能力,突破基底层,侵犯到基底层下的结缔组织,发生远端转移。
-
高危型 HPV 致癌机制
■ 高危型 HPV16 的基因组为闭合双链 DNA,编码早期表达基因和晚期表达基因。
■ HPV 感染人后,将基因组整合到人类染色体上(潜伏),利用宿主表达病毒基因,造成恶性转化。
■ 高危型 HPV 的编码的E6蛋白能够与宿主细胞的 p53 蛋白结合,诱导 p53 的泛素化降解,抑制细胞凋亡;E7蛋白能够与 Rb 蛋白结合,促进细胞复制与分裂。

与肿瘤发生有关的 RNA 病毒
-
与肿瘤相关的 RNA 病毒可以根据致癌机制的不同分为慢性肿瘤病毒和急性肿瘤病毒。
-
慢性肿瘤病毒通过整合到细胞内正常原癌基因附近,利用反转录病毒特有的 LTR 中的强启动子作用于细胞癌基因,诱发癌变,如人类 T 细胞白血病病毒
HTLV。通常这类病毒需要感染较长时间后才启动肿瘤发生。 -
急性肿瘤病毒的基因组中带有病毒癌基因 (
viral oncogene,v-onc) ,即能够诱导正常宿主细胞发生恶性转化的病毒基因。病毒感染后,病毒癌基因在宿主基因组中表达并发挥转化作用,致癌时间较短。如 RSV 病毒的v-Src等。

-
病毒癌基因与细胞癌基因
■ 1976,JM Bishop 与 HE Varmus 在脊椎动物细胞中发现了和 RSV 病毒癌基因 v-Src 高度同源的细胞癌基因 c-Src,说明癌基因存在于脊椎动物自身的基因组中。而且 c-Src 的异常活化与多种肿瘤的发生有重要联系 (1989 年诺贝尔奖)。
■ 癌基因正常情况下是促进细胞分裂增殖的,功能是非常重要的,高度同源也说明这些癌基因在进化过程中是保守的。
■ 病毒癌基因是相对于细胞癌基因的,细胞癌基因是哺乳动物自身的癌基因,病毒自己携带的高度同源的基因组序列,整合到宿主基因组中后会诱导正常宿主细胞发生恶性转化。
10.2.4 表观遗传与肿瘤发生
-
常见机制一:近着丝粒区异染色质的低甲基化造成有丝分裂重组事件的增加,导致基因组不稳定。
-
常见机制二:肿瘤抑制基因的启动子区域出现超甲基化,造成基因的表达抑制,发生失活突变。这两种机制都会促进肿瘤的发生。
-
miRNA 介导的基因表达沉默可以直接(与肿瘤抑制基因的 mRNA 结合)或间接(与肿瘤抑制基因的调控基因的 mRNA 结合)地 沉默肿瘤抑制基因或提高肿瘤抑制基因产物的活性。

10.3 肿瘤治疗中的遗传学
10.3.1 肿瘤常规治疗策略
-
临床上三成左右的肿瘤是可以治愈的,常见的肿瘤治疗策略是手术,化疗和放疗三种。
-
手术——手术切除,减少或消除肿瘤负荷,适用于早中期肿瘤。
-
化疗 (
chemotherapy) ——使用药物抑制肿瘤生长,晚期肿瘤的主要治疗手段,也是其他时期的辅助手段。 -
放疗 (
radiation therapy) ——利用射线抑制和消灭肿瘤细胞,和化疗效果类似。 -
化疗药物的利与弊
■ 绝大多数化疗药物的作用是杀死快速分裂的细胞。
■ 缺点:不能区分恶性的肿瘤细胞和正常快速分裂的细胞,如骨髓细胞、肝细胞和肠胃表皮细胞等。
■ 剂量的重要性:治疗指数 (therapeutic index),即能产生治疗效果需要的剂量和产生不可逆副作用的剂量之差。治疗指数越大,药物特异性和安全性越好。化疗药物的治疗指数远不如抗生素。
■ 例如:砒霜(As,O3),是急性早幼粒细胞白血病 (APL) 的有效治疗药物。
10.3.2 靶向治疗
- 靶向治疗 (
targeted therapy) 指的是利用药物或其他替代分子,通过干扰肿瘤发生和发展过程中的调节因子抑制肿瘤生长和扩散的新型治疗方法,也称作分子靶向治疗。 - 相对传统手段,靶向治疗的主要优点是特异性好,效果明显且对正常细胞造成的副作用小。
- 靶标的选择包括肿瘤细胞内部持续激活的细胞生长信号通路、凋亡途径以及免疫系统等等。
- 靶向治疗可以采用的药物形式主要包括小分子药物、单克隆抗体。
■ 小分子药物的筛选方法:将靶标分子进行小分子药物库的筛选,候选分子可进一步进行化学修饰以提高药物治疗效果、稳定性和安全性。
■ 抗体药物筛选方法:用靶标分子免疫动物制备特异性抗体,再利用基因工程手段进行人源化,防止抗体因被识别为异源蛋白而被免疫系统清除。
小分子靶向药——
Gleevec格列卫
- 用于费城染色体阳性的晚期慢性粒细胞白血病 (CML) 病人的治疗。
Gleevec(Imatinib mesylate,甲磺酸伊马替尼)正是一种可以抑制 BCR-ABL 蛋白活性的小分子化合物,通过竞争结合 BCR-ABL 的 ATP 结合位点而发挥作用。- 临床实验显示 Gleevec 的肿瘤抑制效果显著,药物治疗后的 5 年生存率可达 80-90%。
- 2001 年 5 月 10 日,美国 FDA 批准 Gleevec 治疗 BCR-ABL 融合蛋白阳性的慢性粒细胞白血病,Gleevec 是第一个被批准的小分子类靶向药物。
小分子靶向药——
Iressa易瑞沙
-
Iressa(易瑞沙)(
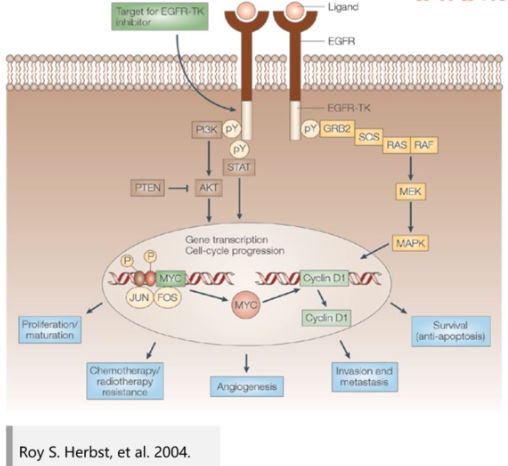
Gefitinib,吉非替尼)是一种选择性表皮生长因子受体 (EGFR) 的酪氨酸激酶抑制剂,该酶通常表达于上皮来源的实体瘤,与肿瘤发生发展有密切联系。 -
抑制 EGFR 活性可抑制肿瘤的生长和转移。
-
Iressa 能够竞争 ATP 结合到 EGFR 胞内的激酶结构域上,阻断 EGFR 的自磷酸化,从而阻断 EGFR 活化及信号转导通路。
-
临床前动物实验发现,Iressa 能广泛抑制异种移植于裸鼠的人肿瘤细胞衍生系的肿瘤生长,并提高化疗、放疗及激素治疗的抗肿瘤活性。
-
在临床实验中已证实吉非替尼对局部晚期或转移性非小细胞肺癌具客观的抗肿瘤反应并可改善疾病相关的症状。
-
2003.05 美国 FDA 批准 Iressa 用于治疗非小细胞肺癌。Iressa 是第一个被批准的用于靶向治疗的 EGFR 酪氨酸激酶抑制剂。
-
后期的临床治疗结果进一步显示 Iressa 对东亚地区的非吸烟的女性腺癌患者效果尤其明显。其原因是这个群体携带 EGFR 突变的频率最高(人群分层)。

-
目前临床上会首先进行患者的药物敏感基因(及突变类型)检测,再制定是否选用 Iressa 作为治疗药物。
单克隆抗体靶向药物
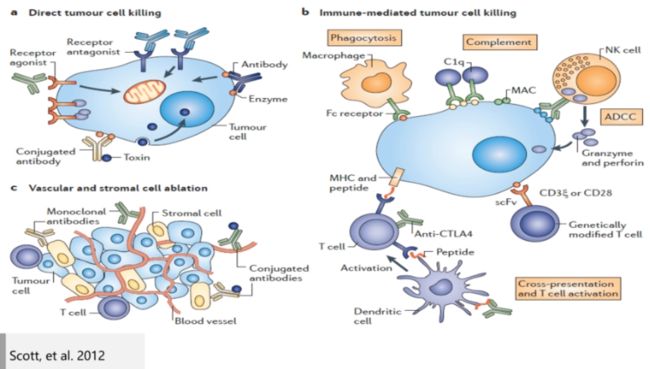
- 单克隆抗体介导的肿瘤靶向治疗可能通过几种不同机制:
a) 抗体结合后直接诱导肿瘤细胞死亡
b) 利用免疫途径介导肿瘤细胞死亡,如巨噬细胞吞噬、补活抗体依赖的细胞毒作用、补体途径等
c) 削除血管和间质组织细胞,间接抑制肿瘤细胞生长
Herceptin曲妥珠单抗
- Herceptin (Trastuzumab, 曲妥珠单抗)是另一类表皮生长因子受体家族成员
HER-2的特异性抗体。 - Herceptin 能够与细胞表面的 HER-2 结合,干扰 HER-2 的自磷酸化及阻碍异源二聚体的形成,抑制信号转导,从而抑制肿瘤生长。

- 临床上约有 15-25% 的乳腺癌患者存在 HER-2 基因扩增或 HER-2 蛋白表达增强现象,造成 HER-2 功能亢进。当 HER-2 突变阳性患者接受 Herceptin 治疗时,抗体可以与 HER-2 结合,阻断其作用,实现治疗效果。
- Herceptin 是美国 FDA 批准的第一个抗体类靶向药物,适用于 HER-2 高表达的乳腺癌患者或者 HER-2 受体阳性的胃癌患者。
靶向治疗的问题与挑战
-
问题:耐药、费用昂贵、缺乏长期毒性反应数据、研发周期长等问题。
-
靶向药物的耐药分为原发耐药和继发耐药。
■ 原发耐药是由于患者发病原因与药物靶分子无关(即患者没有携带特定的靶分子)、或者遗传差异现象所致。
■ 继发耐药的主要原因包括
(1) 肿瘤发展后期出现更多复杂突变,靶向药物作用单一,从而失去效应;
(2) 肿瘤细胞利用抵抗靶向药物的补偿途径拮抗药物作用。 -
解决问题的主要方法一一联合治疗,例如化疗联合靶向治疗,多重靶向药物联合或者靶向治疗联合免疫治疗等。
-
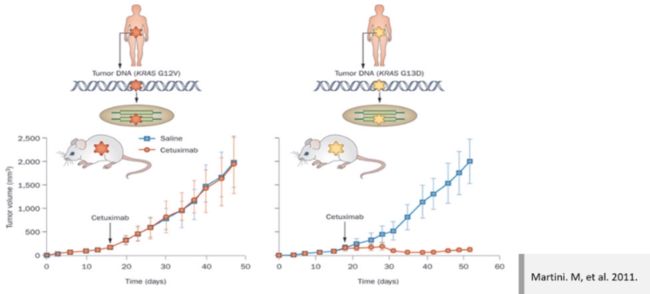
原发耐药举例
人群的遗传差异导致每个肿瘤患者对靶向药物的敏感性是不同的。
例如Cetuximab(西妥昔单抗,EGFR 的单克隆抗体)仅对某几类 K-RAS 突变型有效。人群的遗传多态性,例如 SNP 等,会对靶向药物敏感性造成影响。
-
继发耐药举例
一代、二代药物易瑞沙是针对L858R突变的,耐药患者中有 50% 左右产生了新的 EGFR 突变T790M。
新药研发:三代药物泰瑞莎 (Tagrisso) 即奥希替尼 (Osimertinib) 针对 EGFR 的T790M。在美国,从试验到上市仅用两年半 (2013.3-2015.11)。
2017 年泰瑞莎也已被 CFDA 批准。但临床上又出现了新的耐药人群 (C797S) 。

10.3.3 免疫治疗
- 免疫治疗泛指利用免疫系统来治疗疾病的方法。肿瘤的免疫治疗 (cancer immunotherapy) 指的是以正常免疫细胞为靶点,通过激活人体自身的免疫系统来治疗癌症。
- 优点:
- 增强免疫系统而不是破坏(化疗)﹔
- 不针对特定肿瘤类型,可对多种肿瘤有效;
- 增强的免疫系统还可以抑制癌细胞的进一步演化,降低药物耐受的风险。
CAR-T
-
嵌合抗原受体 T 细胞免疫疗法 (chimericantigen receptor T-cell immunotherapy)
-
主要应用:血液系统肿瘤
-
2017 年 8 月 FDA 全票通过了第一个 CAR-T 疗法
Kymriah(Novartis),用于治疗复发或难治性儿童和年轻成人 B 细胞急性淋巴细胞白血病。 -
2017 年 10 月 FDA 批准了第二个 CAR-T 疗法
Yescarta(Kite Pharma),用于治疗复发或难治性大 B 细胞淋巴瘤。 -
核心技术:利用基因工程技术向患者的 T 细胞内导入能够识别肿瘤抗原的基因及 T 细胞活化基因形成 CAR-T 细胞,赋予 T 细胞识别肿瘤抗原并迅速活化杀伤肿瘤细胞的能力。

-
CAR-T 流程
(1) 从癌症患者体内分离 T 细胞;
(2) 利用基因工程手段构建 CAR-T 细胞;
(3) 体外扩大培养 CAR-T 细胞;
(4) 将 CAR-T 输回患者体内;
(5) 患者观察与护理。 -
存在问题:
① 细胞因子风暴;
② 实体肿瘤治疗还有待发展。
免疫检查点
-
免疫检查点 (
immune checkpoint) 是免疫系统中能够上调或下调免疫反应的一类分子。通常情况下,免疫检查点处于抑制状态,防止免疫系统攻击自身组织。但当机体受到病原体感染或出现自身变异时,他们被激活,启动免疫反应,及时清除各种病原体或变异细胞,以维持机体健康。 -
位于 T 细胞表面的
CTLA-4(cytotoxic Tlymphocyte antigen 4)、PD-1(programmed cell death 1) 是研究和应用都最为广泛的免疫检查点。

-
免疫检查点抑制剂
■ 肿瘤细胞为了避免被免疫系统发现并清除,通常能够抑制免疫细胞的活性。
■ “免疫检查点抑制剂”是靶向免疫细胞表面的抑制型分析的药物,能够提升免疫系统的活性,让机体主动识别和清除肿瘤细胞。
■ 抗 PD-1 抗体药物【施贵宝的 Opdivo(O 药)、默沙东的 Keytruda(K 药)】,被成功应用于多种肿瘤类型的一线和二线治疗,具体包括黑色素瘤、非小细胞肺癌、肾细胞癌、头颈癌和霍奇金淋巴瘤等十余个癌种。 -
免疫治疗思路的发展:从增强到正常化
把免疫系统比作水龙头,肿瘤患者的免疫系统是被堵塞的。CAR-T是通过增加压力等方式增加水流的冲力,让水流出来达到治疗效果;免疫检查点抑制剂是把堵塞的东西移除,使免疫系统恢复正常,显然,这种方式毒副作用更小,效果也更好。
所以,开发更多有效的药物,使免疫系统正常化,加强机体自身的免疫清除能力,是未来免疫治疗的一个值得期待的领域。