易基因:PIWI/piRNA在人癌症中的表观遗传调控机制(DNA甲基化+m6A+组蛋白修饰)|综述
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
2023年03月07日,南华大学衡阳医学院李二毛团队在《Molecular Cancer》杂志发表了题为“The epigenetic regulatory mechanism of PIWI/piRNAs in human cancers”的综述文章,讨论了piRNA(PIWI-interacting RNA)的生物发生及其在人癌症中的表观遗传调控机制的研究进展,如N6-甲基腺苷(m6A)甲基化、组蛋白修饰、DNA甲基化和RNA干扰,为癌症的临床诊断、治疗和预后提供了新的见解。
期刊:Molecular Cancer(Mol Cancer)
日期:2023.03.07
IF:41.444 /Q1
背景
PIWI蛋白与PIWI互作RNA(piRNA)的强相关性在生物体的发育和繁殖中具有重要意义。最新证据表明,除生殖功能外,具有异常表达的PIWI/piRNA也与多种人类癌症密切相关。
PIWI亚家族蛋白属于PAZ-PIWI结构域(PPD)蛋白家族,这对于小非编码RNA(sncRNA)的生物发生和功能至关重要。PIWI蛋白主要与piRNA结合并在生殖细胞中发挥生理功能,除了直接切割和降解类似于Ago蛋白/miRNA的靶RNA功能外,PIWI蛋白/piRNA还可以通过招募其他表观遗传调节因子,如DNA甲基化酶、RNA甲基化酶、脱腺苷酶(deadenylyase)、磷酸化(phosphorylation)等发挥表观遗传调控功能。
人类PIWI家族蛋白包含四个成员:PIWIL1(HIWI)、PIWIL2(HILI)、PIWEL3(HIWI3)和PIWIL4(HIWI2);小鼠PIWI家族蛋白包含三个成员:MIWI(Piwil1)、MILI(Piwil2)和MIWI2(Piwil4);果蝇中包含三个PIWI编码基因:PIWI、Ago3和Aub。PIWI蛋白主要在生殖细胞中表达,在正常体细胞中几乎不表达,在各种物种中表现出高度保守的功能。最近研究发现PIWI蛋白在人类肿瘤中也异常表达,因此有望成为肿瘤靶向治疗的理想靶点。由于这一特性,PIWI蛋白近年来备受关注。PIWI蛋白在不同类型癌症中的异常表达为精确医学提供了一个良好的机会,阐明PIWI蛋白在癌症中的调控机制已成为癌症防治研究的重要课题。
关于piRNA
PIWI蛋白通常与piRNA结合发挥基因调控功能,在维持生殖细胞基因组的稳定性和完整性方面发挥重要作用。piRNA是sncRNAs的最大亚类,长度约24-32nt,2'-O-甲基化3'-端,首次发现存在于果蝇的生殖细胞系中,并逐渐在无脊椎动物和脊椎动物等多种物种中发现。约90%的piRNA由piRNA簇含有转座子元件的特异性位点产生。最近研究还发现,许多piRNA序列来源于非转座子序列,这意味着piRNA的功能不仅仅是沉默转座子。piRNA簇根据其从基因组上的两条或一条链产生piRNA的能力分为双链簇和单链簇。单链piRNA簇是分布最广泛和默认的类型,其转录类似于经典转录通路,常规转录本也正常剪接。双链piRNA簇主要分布在生殖细胞中并缺乏明确定义的启动子区域,新生成的piRNA转录本不能剪接和聚腺苷酸化。新生成的前体转录本从细胞核转运到细胞质,在细胞质中以不依赖于Dicer的方式进一步加工成成熟的piRNA,但这一过程复杂且尚未完全理解。目前,模型设计中已知两种相互关联的机制:常规扩增通路(也称Phasing加工通路)和“乒乓”扩增通路,如图1所示。
图1:piRNA产生的两种模式。
在体细胞中,piRNA主要通过Phasing加工通路生成(左侧)。首先,piRNA前体转录本被PIWI/启动子piRNA分解以产生pre-pre-piRNA,pre-pre-piRNA与新PIWI蛋白结合,然后通过内切酶切割成两部分(果蝇中的Zucchini或小鼠中的PLD6)。PIWI蛋白的结合部分是已知的中间piRNA(pre-piRNA),其在外显子酶(Trimmer/PNLDC1)和甲基转移酶(Hen1)的作用下产生成熟的应答piRNA。pre-pre-piRNA的其余部分在其5'端被PIWI蛋白重复结合,并被Zucchini/PLD6重复切割以产生一串尾随piRNA。在生殖细胞中,piRNA由Ago3和Aub介导的转座子和piRNA簇的互补转录本相互切割而产生,称为“Ping pang”循环(右侧),产生成对的piRNA(initiator-piRNA和responder-piRNA),在5'端有10个碱基重叠。
PIWI/piRNA在正常生殖细胞和肿瘤生殖细胞中的调控机制
PIWI/piRNAs复合体最主要的功能是参与转座子沉默和生殖发育的调控,其作用机制是在转录或转录后水平调节基因表达(图2)。
图2:PIWI-piRNA复合体在正常细胞中的调控机制。
在正常细胞中,PIWI蛋白主要与piRNA结合形成复合体,在转录或转录后水平调控基因表达。在转录水平上,靶基因转录主要受核定位PIWI蛋白招募组蛋白和DNA修饰酶的调控。在转录后水平上,除了PIWI蛋白在细胞质中招募并在RNA和蛋白酶体水平上调控的MTC、泛素化酶和磷酸化酶等表观遗传调控因子外,靶基因mRNA还可以直接靶向并以PIWI内切酶依赖的方式切割,在“乒乓”循环通路中实现。
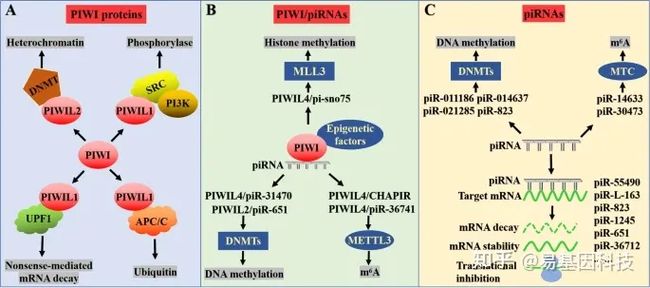
而PIWI蛋白在多种肿瘤中高表达,如胃癌、结肠癌、肝癌、神经胶质瘤和膀胱癌。此外piRNA的研究仍处于初步阶段,其在肿瘤中的表观遗传调控机制仍在研究中。本综述总结了有关PIWI/piRNA在人类癌症中表观遗传调控机制的最新信息,包括m6A甲基化、组蛋白修饰和DNA甲基化等(图3),这为癌症诊断和预后以及治疗提供了独特的生物标记物观察结果。
图3:PIWI/piRNA对人类癌症的表观遗传调控机制。
PIWI蛋白主要通过与其他功能蛋白(如甲基转移酶、泛素化酶、磷酸化酶等)结合,以不依赖piRNA的方式调控癌症中的基因表达。
PIWI蛋白以piRNA依赖性方式调控癌症中的基因表达,这与正常细胞中的调控相似。
piRNA独立调控癌症机制,通过与表观遗传调控因子结合或直接调控其表达来发挥表观遗传调控功能。PiRNA还可以与靶基因结合以降解mRNA、改变其mRNA稳定性或抑制其翻译过程。
PIWI/piRNA在人类癌症中的表观遗传调控机制
DNA甲基化
DNA甲基化是指生物体在DNA甲基转移酶(DNMT)的催化下,以S-腺苷甲硫氨酸(SAM)为甲基供体将甲基转移至特定碱基的过程,在长期沉默基因方面尤其在启动子区域至关重要。在哺乳动物中,DNA甲基化主要发生在CpG岛胞嘧啶的第五个碳原子上,称为5-甲基胞嘧啶(m5C)。正常细胞中的CpG岛由于保护作用而去甲基化导致全基因组低甲基化,维持甲基化模式的酶不受调控及正常未甲基化CpG岛的高甲基化是人类肿瘤中的常见现象。先前的研究表明,启动子区域的高甲基化导致抑癌基因的失活这是人类肿瘤的共同特征之一。lncRNA可以招募DNMT来提高DNA甲基化水平,而最近的研究表明piRNA可以通过在某些人类癌症中招募DNMT来影响高甲基化。DNA甲基化与piRNA之间的相互作用对基因组的稳定性和表达产生了深远影响,最终导致细胞信号的异常变化,从而促使疾病进展。
许多研究发现肿瘤细胞中DNA甲基化变化与PIWI/piRNA疾病密切相关。与正常乳腺组织相比,乳腺癌组织中piR-651、piR-823和piR-021285高表达,但PIWI蛋白在乳腺癌中的表达尚未统一。Didier等人发现PIWIL2在正常乳腺组织中表达,但在乳腺肿瘤组织中不表达,而其他三项研究结果则相反。piR-651的过表达可以促进乳腺癌细胞的增殖和侵袭,其调控机制是通过PIWIL2将DNMT1招募到抑癌基因PTEN的启动子区,导致PTEN启动子甲基化,从而降低其表达水平。此外,Fu等人表明piR-021285可以促进原癌基因ARHGAP11A 5'UTR/第一外显子甲基化并下调其表达水平,但其特异性调控机制尚需进一步研究。Ding等人发现piRNA-823的过表达促进DNMTs表达,如DNMT1、DNMT3A和DNMT3B,从而诱导基因腺瘤性息肉病(APC)的高甲基化,通过触发Wnt信号通路诱导管腔乳腺癌症细胞干化。除乳腺癌外,还发现piR-823在多发性骨髓瘤(MM)和食管鳞状细胞癌(ESCC)中上调。
MM中piR-823过表达可以通过激活DNMT3B和上调DNA甲基化水平来维持多发性骨髓瘤干细胞的干性并增加致瘤力。Yan等人表明,piRNA-823可以上调DNMT3A和DNMT3B的mRNA水平和蛋白水平,导致抑癌基因p16(INK4A)甲基化,从而在MM中发挥促癌作用。Su等人表明,piR-823和DNMT3B均在ESCC中过表达,且彼此呈正相关。piR-823可通过DNMT3b介导的DNA甲基化来促进ESCC进展。
PIWI/piRNA介导的DNA甲基化在其他肿瘤中也起重要作用。在前列腺癌中,高表达的piRNA-31470诱导DNMT1和DNMT3α通过PIWIL4与谷胱甘肽S-转移酶Pi1(GSTP1)的CpG岛结合。随后GSTP1甲基化并抑制其转录,GSTP1失活增加了正常细胞对氧化应激的敏感性和前列腺癌的风险。Wu的研究表明,LV-has-piR-011186与特异性序列结合的过表达将DNA甲基化和组蛋白甲基化蛋白招募到CDKN2启动子基因中,从而促进细胞增殖,并抑制U937白血病细胞凋亡。在肺癌中,RASSF1基因家族的主要成员RASSF1C可以促进PIWIL1表达和调控piRNA表达。本研究提出RASSF1C/PIWIL1/piRNA轴,该轴通过DNA甲基化调控肺癌Gem互作蛋白(GMIP)mRNA的表达,从而影响癌细胞的迁移。
m6A RNA甲基化
近年来,m6A是最受关注的表观遗传RNA修饰之一,其在调控基因表达方面发挥着至关重要的作用。这种RNA修饰可以通过m6A的“writers”, “erasers” 和“readers”实现,这些蛋白质可以分别对RNA进行甲基化、去甲基化和鉴定m6A。MTC由至少七种“writers”蛋白组成:METTL3、METTL14、METTL16、WTAP、RBM15/15B、KIAA1429、ZC3H13。m6A去甲基化酶目前主要有两种类型:FTO和ALKBH5,表明m6A甲基化和DNA甲基化及组蛋白修饰一样,是一种可逆修饰。为了执行特定的生物功能,m6A必须被特定的RNA结合蛋白识别。这些甲基化识别蛋白,如YT521-B同源(YTH)蛋白、异质核核糖核蛋白(HNRNP)、真核翻译起始因子3(elF3)和IGF2 mRNA结合蛋白(IGF2BP)家族,以m6A依赖的方式影响mRNA的命运,包括RNA转录、加工、翻译和代谢。
越来越多的证据表明,m6A RNA甲基化也可能影响肿瘤发生。因此,有研究人员想知道piRNA和m6A之间是否存在一些可以共同影响癌症进展的关系。如Xie等的研究表明,piRNA-14633可以通过piRNA-14533/METTL14/CYP1B1轴促进宫颈癌(CC)的恶化,在该研究中,piRNA-14633在CC细胞中高表达,且提高了m6A RNA甲基化水平和METTL14 mRNA稳定性。此外,由piRNA-14633调控的METTL14可能靶向CC细胞中的CYP1B1,从而促进CC细胞的增殖、迁移和侵袭能力。Han等的研究表明,piRNA-30473通过调节WTAP在弥漫性大B细胞淋巴瘤(DLBCL)中发挥作用。作为DLBCL患者的阴性预后指标,piRNA-30473在DLBCL中过表达,且通过调节WTAP和IGF2BP2的表达来调控m6A甲基化水平,IGF2BP2是一种m6A readers,可以通过增加HK2 mRNA的稳定性来上调细胞中靶向其mRNA 5’UTR的HK2表达。这两项研究都表明,piRNA通过调控m6A甲基转移酶的表达来发挥m6A修饰的作用。
此外研究还发现,piRNA可以通过与某些m6A甲基转移酶相互作用并影响其活性来调控细胞全基因组m6A水平。例如,Liu等发现piRNA-36741通过调控BMP2的METTL3依赖性m6A甲基化来调控成骨细胞分化。CHAPIR(心肌肥大相关piRNA)-PIWIL4复合体通过与METTL3互作并阻止Parp10 mRNA转录本的m6A甲基化来上调Parp10表达,从而抑制NFATC4在细胞核中的积累,进而促进病理性肥大和重塑心脏。从机制上讲,这两项研究都得出结论,piRNA-PIWIL4复合体直接与METTL3互作并调控METTL3介导的靶向基因转录本的m6A修饰。
尽管这些研究证明piRNA-PIWI蛋白复合体可以通过调控m6A甲基转移酶的表达或影响其m6A活性来发挥m6A修饰的作用,但几个关键问题仍未解决。例如,piRNA可以通过PIWI蛋白招募DNA甲基转移酶,以调控靶基因的DNA甲基化,类似于miRNA,piRNA作为一种ncRNA与mRNA的3’UTR或CDS区结合。因此某些piRNA是否只调控与其结合的靶基因的m6A水平,就像DNA甲基化一样,而不是细胞的全基因组m6A水平。此外,深入研究这一问题也有望阐明m6A如何在转录组中特异性和动态沉积的分子机制。而目前只进行了少量的研究,piRNA和m6A调控机制在人类癌症中具有巨大潜力,应进一步研究来挖掘深层次的内部机制。
组蛋白修饰
核小体是染色体功能的基本单位,由146对碱基围绕组蛋白八聚体形成,组蛋白八聚体由四种组蛋白(H2A、H2B、H3和H4)的两个分子组成。真核生物的一些组蛋白能够稳定核小体,而组蛋白末端的游离氨基酸残基可以进行共价修饰,如甲基化、乙酰化、磷酸化、泛素化、腺苷二磷酸核糖基化和糖基化,其中甲基化和乙酰化是两种重要修饰。组蛋白乙酰化是由组蛋白乙酰转移酶(HAT)和组蛋白去乙酰化酶(HDAC)介导的可逆动态平衡过程。HAT可以将乙酰辅酶A携带的乙酰基转移到组蛋白N末端的特定赖氨酸残基上,乙酰基中和残基携带的正电荷,从而扩大DNA构象并放松核小体结构,从而促进DNA与转录因子的结合并激活特定基因的转录。组蛋白甲基化通常发生在赖氨酸和精氨酸残基上,不同位点的甲基化对组蛋白功能有不同的影响。这些修饰酶可分为两部分,一部分是活性标记,另一部分是抑制性标记。组蛋白H3赖氨酸4三甲基化(H3K4me3)、H3和H4乙酰化以及组蛋白H3赖氨酸36(H3K36me2和H3K36me3)是活性标记,有利于核小体三维结构开放染色质转录通路的形成。而抑制性标记如组蛋白H3赖氨酸9和27(H3K9me3和H3K27me3)的三甲基化,能够产生浓缩的染色质。
不同种类的piRNA可以招募相应的组蛋白修饰酶,从而产生不同的效果。如一项研究表明,pi-sno75可以上调促凋亡蛋白TRAIL表达,并在乳腺癌中发挥抑制作用。从机制上说,pi-sno75与PIWIL1/4结合并通过招募MLL3/hCOMPASS复合体诱导TRAIL的H3K4甲基化/H3K27去甲基化。Wu等人证明CDKN2B相关的piRNA、hsa-piR-011186和hsa-piR-014637在白血病细胞U937中高表达,其表达上调可抑制CDKN2B表达,从而促进细胞周期进程并诱导细胞凋亡。从机制水平来说,hsa-piR-011186和hsa-piR-014637与DNMT1、Suv39H1和EZH2蛋白形成复合体,调节CDKN2B启动子位点中DNA和组蛋白H3的甲基化水平。这种特异性的piRNA复合体加速了细胞周期的表观遗传修饰,为白血病的进展提供了新见解。另一项研究表明,浸润性乳腺癌(IBCs)中PIWIL2的低表达与DNMT1、组蛋白H1、HP1和SUV39H1的下调之间存在强相关性,这与染色质可及性和基因组甲基化有关。导致DNA去甲基化和转座元件再激活的PIWI/piRNA功能障碍是许多肿瘤细胞基因组完整性和免疫应答变化的表观遗传机制。此外在IBC中的反应,PIWIL2低表达与免疫细胞毒性CD8+增加密切相关,证明了作为免疫疗法的预测性生物标志物的可行性以及可能的新型临床诊断标志物。
PIWI/piRNA的其他致癌机制
在生殖细胞中,依据其剪接酶活性,PIWI蛋白可以切割与piRNA互补的转座子RNA,从而导致转座子基因转录后沉默,这与piRNA生物合成有关。但这种情况在癌症中有所不同,根据目前的研究,PIWI蛋白和piRNA作为两个独立的个体来调控mRNA衰变(图2)。例如,Liu等人发现PIWIL1作为APC/C复合体的共激活因子,在piRNA缺失的情况下靶向细胞粘附蛋白Pinin进行蛋白水解泛素化,从而促进胰腺癌转移。Lin等人也证明在PIWIL1高表达的胃癌细胞中很难检测到piRNA表达,PIWIL1敲除的piRNA结合活性仍然可以发挥促进癌细胞生长和肿瘤转移的生物学功能。从机制上讲,PIWIL1可能通过结合蛋白对抑癌基因表达进行负调控,而结合蛋白是无义介导的mRNA衰变机制的核心因子。PIWI蛋白可以直接与某些功能蛋白(泛素酶和磷酸化酶)结合以不依赖于piRNA在肿瘤中发挥表观遗传调控功能。当然,这种现象是否也存在于正常细胞中需要进一步研究。另外,许多piRNA可以类似于miRNA机制,通过癌症中的piRNA-RNA互作调控转录后网络以抑制靶功能。在肺癌细胞中,piRNA可通过P-ERM、Caspase-3和Akt/mTOR调控癌细胞的生长、凋亡、迁移和侵袭。在结肠癌细胞中,piRNA通过HSF1、BTG1和FAS调控癌细胞的生长、凋亡和细胞周期转运。只有PWIL1蛋白在人结肠癌COLO205细胞中表达,而其他PIWI蛋白不表达。在与hpv16/18相关的头颈部鳞状细胞癌中,piRNA FR140858缺失可能促进微染色体维持复合体组分7的表达。在乳腺癌中,PIWIL1与piR-36712结合形成RISC并靶向降解SEPW1的逆转录假基因SEPW1P,随后通过SEPW1 mRNA与SEPW1P RNA竞争microRNA-7和microRNA-324来下调SEPW1表达并抑制增殖、迁移和侵袭。在神经母细胞瘤细胞中,piRNA-39980直接靶向JAK3基因,从而诱导细胞增殖、增强转移并抑制其衰老。在膀胱癌中,piRNA DQ594040表达下调,piRNA DQ594040通过靶向TNFSF4抑制膀胱癌细胞增殖并诱导细胞凋亡。
需要进一步研究PIWI如何以不依赖于piRNA的方式调控和发挥作用;还有必要进一步探讨是否有新的不同于常规piRNA的小RNA参与PIWI在癌症中的调控和功能,或者可能有新的PIWI功能相关蛋白参与PIWI的调控和功能。这些关于PIWI在癌症中的作用和机制的深入研究最终将为PIWI在癌症精确治疗中的应用提供坚实的理论基础。
与piRNA/PIWI蛋白相关靶向治疗的未来前景
肿瘤治疗目前还受低效和侵入性诊断工具以及治疗引起的不良后果的困扰(如恢复率低、缺乏普遍性和频繁随访等),但更具针对性的靶向治疗和相关诊断方法已经出现。靶向治疗,旨在在肿瘤发生过程中切断特异性通路和功能蛋白,尤其是具有异常表达的突变分子。现已检测到多种piRNA和PIWI蛋白在肿瘤生殖细胞和其他癌组织中下调或上调,以促癌发生或抑癌生长。新出现的证据表明piRNA和PIWI蛋白在病理分级或临床转移中的高度恶性相关。在肿瘤中,piRNA/PIWI复合体能够通过表观遗传通路调控致癌作用。piRNA/PIWI蛋白的表观遗传机制基于基因水平来促进或抑制细胞增殖、迁移和转移。在未来或许可以通过上调或下调piRNA/PIWI复合体表达来改变与参与癌症发生特异性通路的m6A RNA、组蛋白和DNA甲基化修饰相关分子的表达或稳定性。当然,如果在一种癌症中检测到更多由piRNA/PIWI复合体调控的更多表观遗传通路,那制备靶向药物的几率将加大。
miRNA在肿瘤靶向治疗中的应用存在三个问题:特异性,可递送性和耐受性,而piRNA则具有很大的改善。首先在特异性方面,一是大多数piRNA在生殖细胞和癌细胞中表达,表明其具有良好的细胞特异性;二是piRNA与靶基因碱基互补配对,并在转录或转录后水平调控靶基因表达,表明其具有良好的基因特异性。但piRNA与miRNA也存在相似的问题,如脱靶效应和由序列相似或过量诱导的免疫原性等问题,远高于预期的内源水平。其次在可递送性方面,因为piRNA的3'端具有2'-O-甲基化结构,所以piRNA在血液中比miRNA更稳定,因此piRNA具有更好的可递送性。第三,关于耐受性或副作用,piRNA和PIWI蛋白由于其在细胞中的特异性表达而具有较少的副作用。因此,凭借这些优势,PIWI/piRNA将具有非常广阔的应用前景。
结论
癌症是危害人类健康的致命性疾病。尽管医学科学和技术领域的科学家们一直致力于癌症治疗的研究,但到目前为止仍然是一种难以征服的疾病,其中一个主要原因就是缺乏肿瘤特异性抗原。PIWI/piRNA通常仅在生殖细胞和癌性肿瘤组织中表达,但在正常体细胞组织中几乎不表达,使其成为精准靶向治疗的潜在靶标。随着技术的飞速发展,关于PIWI/piRNA复合体的新研究信息不断出现。PIWI/piRNAs介导的表观遗传调控在生殖细胞发育中起重要作用,包括DNA甲基化、组蛋白甲基化、组蛋白乙酰化和组蛋白泛素化,不仅可以在转录水平上发挥重要的调控作用,而且PIWI家族蛋白可以在piRNA诱导下对mRNA进行切割,这也显示出转录后的调控作用。然而PIWI/piRNA在癌症中的调控机制有所不同。大部分研究发现PIWI蛋白和piRNA是两个独立的个体对肿瘤发挥调控作用。因此,有必要进一步研究PIWI蛋白如何以不依赖于piRNA的方式在肿瘤中发挥其调控功能。
本综述还讨论了人类癌症中PIWI/piRNA复合体的四种可能的调控机制,如核酸内切酶、DNA甲基化、组蛋白调控,以及m6A甲基化的最新研究(表1)。目前关于m6A甲基化的研究很少,需要更多的研究来分析PIWI/piRNA介导的m6A修饰在肿瘤发生和发展中的作用。深入研究表观遗传学机制有助于完善肿瘤发生机制的理论。通过进一步研究,PIWI/piRNA可能成为肿瘤诊断的小分子标志物,并促进肿瘤诊断和治疗的发展。
表1:PIWI/piRNA在各种癌症中的作用
易基因科技提供全面的表观组学测序服务,有DNA甲基化、组蛋白修饰、RNA甲基化测序需要的老师可联系0755-28317900。
参考文献:Zhang Q, Zhu Y, Cao X, Tan W, Yu J, Lu Y, Kang R, Wang X, Li E. The epigenetic regulatory mechanism of PIWI/piRNAs in human cancers. Mol Cancer. 2023 Mar 7;22(1):45.
相关阅读:
综述:糖尿病大血管和微血管病变的表观遗传学调控机制(DNA甲基化+组蛋白修饰)
深度综述:表观遗传机制在慢性疼痛中的作用(DNA甲基化+组蛋白修饰+非编码RNA)
多组学关联研究怎么做?DNA甲基化组+转录组+宏基因组+16S研究思路
深度综述:癌症中RNA修饰机制的遗传和表观遗传失调(m6A+m1A+m5C+ψ)