易基因:全基因组DNA甲基化分析揭示DNMT1在斑马鱼模型听觉系统发育中的作用 | 胚胎发育
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
听力障碍通常与内耳发育不全或损伤有关,是影响生活质量的严重健康问题。因此研究听觉器官发生过程中的关键基因对于探索听力损伤的潜在策略至关重要。斑马鱼模型在理解内耳发育不良和相关疾病的分子遗传学原理方面得到了越来越多的应用,内耳发育包括遗传遗传机制和表观遗传机制。
2022年03月29日,复旦大学附属眼耳鼻喉科医院何英姿团队和皖南医学院弋矶山医院刘少峰团队合作在《Cell Prolif》杂志发表题为“Dnmt1 is required for the development of auditory organs via cell cycle arrest and Fgf signalling”的研究论文,该研究以斑马鱼为实验模型,通过RNA测序(RNA-seq)、原位杂交(ISH)、全基因组重亚硫酸盐测序(WGBS)和免疫组化等方法揭示了DNMT1(DNA methyltransferase 1 ,DNA甲基转移酶1)在听觉系统发育中的重要作用。
标题:Dnmt1 is required for the development of auditory organs via cell cycle arrest and Fgf signalling Dnmt1通过细胞周期阻滞和Fgf信号调控听觉器官发育
时间:2022-03-29
期刊:Cell Proliferation
影响因子:IF 8.755
技术平台:WGBS、RNA-seq、ISH等
研究摘要
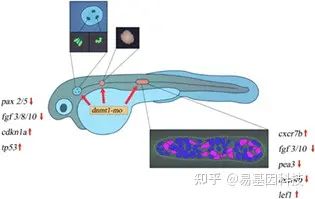
本研究以斑马鱼为实验模型,探讨DNA甲基转移酶1 (DNMT1)在听觉系统发育中的作用。用吗啉寡核苷酸(mololino oligonucleotide)诱导Dnmt1缺失,利用RNA-seq、ISH、WGBS和免疫组化等方法研究其形态学改变和机制。结果表明,在斑马鱼发育中的后侧线(posterior lateral line,pLL)系统中,Dnmt1下调诱导神经丘(neuromasts)数量减少,并抑制原基细胞增殖。ISH结果表明,Fgf信号通路被抑制,趋化因子成员cxcr4b、cxcr7b和cxcl12a表达受到干扰,而lef1表达在抑制Dnmt1后增加。此外,Dnmt1表达下调导致耳石畸形和半规管畸形,胞囊(utricle)和球囊(saccule)的毛细胞(hair cell,HC)分化受到严重抑制。当Dnmt1表达下调时,耳基板标志物pax2/5和fgf3/8/10的原位染色减少。WGBS分析表明全基因组甲基化水平显著下调,其中细胞周期基因在Dnmt1实验组和对照组之间的表达差异最大。进一步的ISH分析证实了RNA-seq和WGBS实验结果,cdkn1a和tp53在Dnmt1敲除后均上调。本研究结果表明,Dnmt1通过调控细胞周期基因以及Wnt和Fgf信号通路对斑马鱼听觉器官的发育至关重要。
研究方法:
(1)全胚原位杂交(whole mount In situ hybridization, WISH)技术检测了Dnmt1在斑马鱼胚胎早期发育过程中的时空特异性表达模式。Dnmt1在眼、内耳和侧线系统中的强表达模式表明,Dnmt1在这些器官的发育和分化中至关重要。
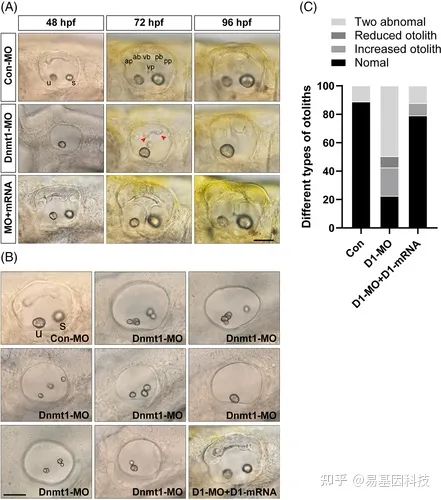
(2)通过斑马鱼的胚胎显微注射Morpholinos方法下调Dnmt1表达,结果表明与对照组相比,Dnmt1- MO胚胎表现出一定程度的发育迟缓和畸形,包括耳石器官异常、半规管畸形和侧线系统神经丘数量减少。
(3)通过ISH、 RNA-seq和WGBS分析结果表明,Dnmt1通过调控耳囊泡(OV)特异性基因、FGF信号通路和细胞周期信号通路来调控斑马鱼听觉器官的发育。
结果图形
(1)Dnmt1在斑马鱼内耳和神经丘中的表达
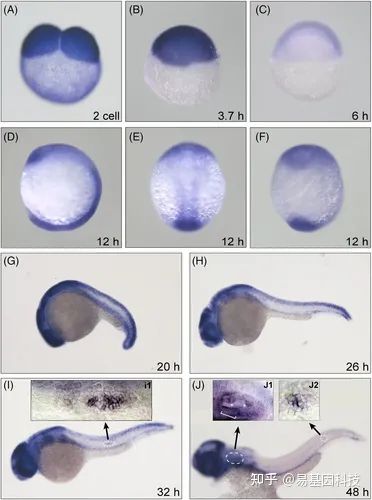
图1:Dnmt1为斑马鱼内耳和pLL发育所必需。
WISH染色描绘了Dnmt1在2-cell期(two-cell stage)(a)、oblong期(B)、胚盾期(shield stage)(C)、体节期(segmentation period)(D:侧视图,E:背视图,F:12hpf时的腹视图,G:20hpf时d 侧视图)的持续表达。Dnmt1高表达水平富集在26-48hpf的迁移原基(H和I)、头部区域的内耳和后侧线(J)的沉积神经丘上。原基(primordium)(I1)、内耳(inner ear)(J1)和神经丘(neuromast)(J2)结构的放大倍数图像表明Dnmt1高表达。
(2)Dnmt1为侧线神经丘(lateral line neuromasts)沉积所必需
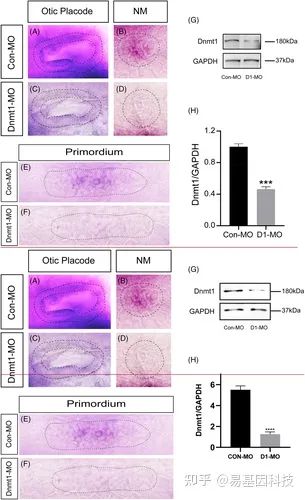
图2:敲除Dnmt1后,Dnmt1表达显著下调。
A-F:与对照组相比,Dnmt1-MO胚胎中Dnmt1原位染色在不同时期WISH均下调。黑色虚线分别表示48 hpf时的耳囊泡(A,C)和神经丘(B,D)。E-F中的黑色虚线表示32 hpf时的原基。
G-H:Dnmt1 morpholino注射后,Dnmt1的蛋白印迹在条带强度(G)和定量分析(H)中均显著降低。
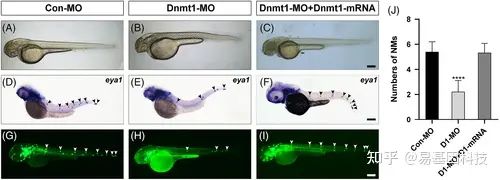
图3:Dnmt1是斑马鱼后侧线神经丘沉积所必需的。
A-B. 48 hpf时,野生型胚胎和Dnmt1缺失型胚胎的大体形态。
D-E. 与对照组(D)相比,Dnmt1突变体(E)在侧线神经丘的eya1染色中发现神经丘数量减少和神经丘之间的距离延长。
G-H. 转基因斑马鱼系cldnb:lynGFP证实了在WISH中观察到的结果。
C、F、I. 在mRNA组和MO联合注射组中成功挽救了形态学、eya1染色和绿色荧光标记的神经丘。
(3)抑制Dnmt1表达可显著抑制PLL细胞增殖
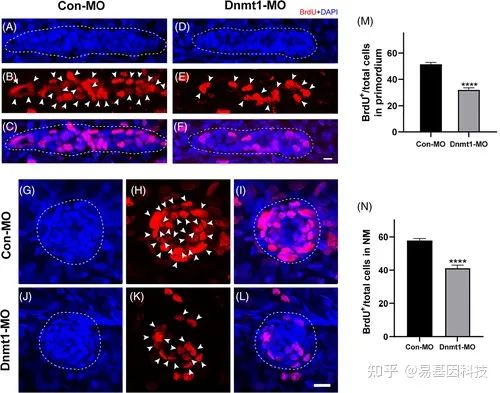
图4: Dnmt1下调在原基迁移和神经丘形成过程中抑制细胞增殖。
A-L. 对照胚胎和Dnmt1缺失突变体之间BrdU标记的增殖细胞数量比较代表性图像
M-N. 对照组胚胎(n=32)和Dnmt1-MO胚胎(n=31)的BrdU指数差异有统计学意义
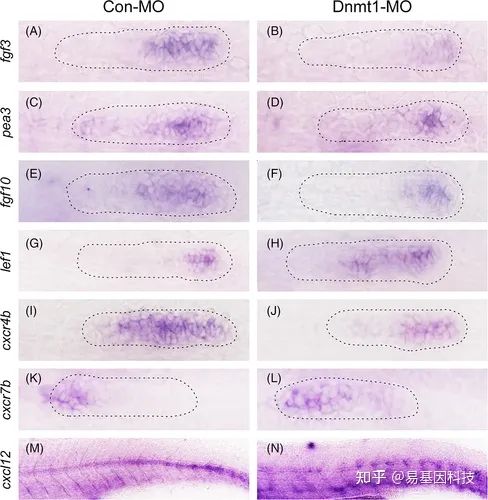
(4)DNMT1通过调节Fgf、Wnt和趋化因子信号通路调控PLL发育
图5:Dnmt1缺失抑制斑马鱼原基中的Fgf信号和趋化因子超家族。
(5)斑马鱼Dnmt1基因敲除导致严重的耳畸形
图6:敲除Dnmt1会破坏半规管和耳石器官的正常发育
图7:Dnmt1抑制影响HC在胞囊和球囊中的分化。
(6)Dnmt1通过调控pax家族和Fgf信号通路参与斑马鱼内耳胚胎发生
图8:Dnmt1敲除后耳板编码标记基因表达变化
(7)Dnmt1在斑马鱼发育过程中调控cdkn1a和tp53的转录水平
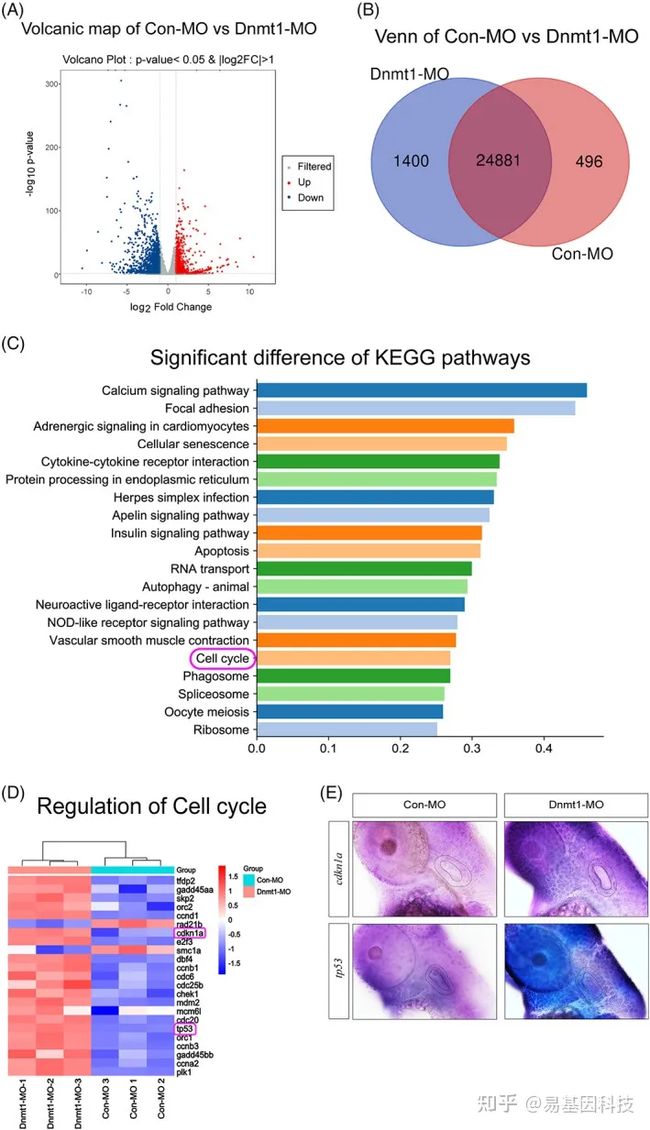
图9:RNA-seq分析揭示细胞周期基因是斑马鱼耳发育过程中Dnmt1抑制的关键调控因子。
- 火山图分析显示了这两组的所有DEG。
- Venn图进一步标记了Con-MO和Dnmt1-MO组中唯一和重叠DEG数量。
- KEGG富集分析显示,Dnmt1敲除样品和对照组之间的前20个信号通路存在统计学差异。
- 两组的细胞周期通路DEG聚类分析。
- ISH数据证实,与对照组相比,48 hpf时敲除Dnmt1后cdkn1a(p21)和tp53均上调
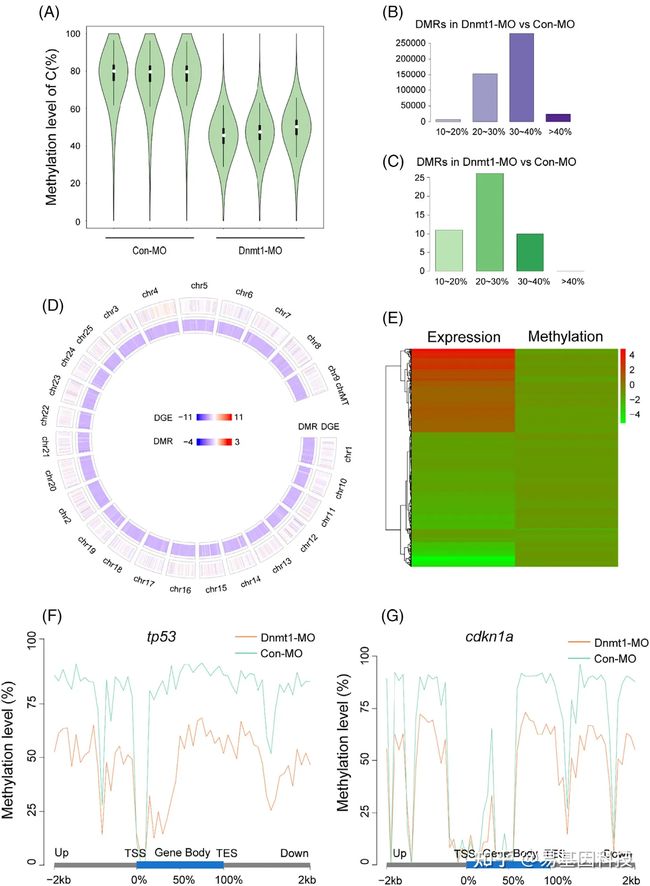
图10:WGBS分析检测Dnmt1敲除后的全基因组低甲基化。
- 小提琴图显示具有三个生物学重复的Con-MO组和Dnmt1-MO组的整体甲基化水平。白点表示中值,黑色实框表示四分位距(interquartile range, IQR),细黑线表示数据范围,小提琴的宽度表示分布密度。
B-C. 与Con-MO组相比,Dnmt1-MO组中低甲基化(B)和高甲基化(C)的DMR数量。横坐标表示不同的甲基化水平。
D. Circos图显示与Con-MO组相比,基因组Dnmt1-MO组中DEG和DMR的总体分布。从外圈到内圈分别表示染色体数目、DEG(RNA-Seq)和DMR(CpG)。红色表示上调,蓝色表示下调;颜色越深,差异越大。
E. 热图显示与Con-MO组相比,Dnmt1-MO组共有的DEG和DMR相关基因。红色表示上调,绿色表示下调。
F-G. 与Con-MO组相比,Dnmt1-MO突变体功能区中tp53和cdkn1a的甲基化水平均显著降低。TES转录终止位点;TSS转录起始位点。
关于易基因全基因组重亚硫酸盐测序(WGBS)技术
全基因组重亚硫酸盐甲基化测序(WGBS)可以在全基因组范围内精确的检测所有单个胞嘧啶碱基(C碱基)的甲基化水平,是DNA甲基化研究的金标准。WGBS能为基因组DNA甲基化时空特异性修饰的研究提供重要技术支持,能广泛应用在个体发育、衰老和疾病等生命过程的机制研究中,也是各物种甲基化图谱研究的首选方法。
易基因提供的全基因组甲基化测序技术通过T4-DNA连接酶,在超声波打断基因组DNA片段的两端连接接头序列,连接产物通过重亚硫酸盐处理将未甲基化修饰的胞嘧啶C转变为尿嘧啶U,进而通过接头序列介导的 PCR 技术将尿嘧啶U转变为胸腺嘧啶T。
应用方向:
WGBS广泛用于各种物种,要求全基因组扫描(不错过关键位点)
- 全基因组甲基化图谱课题
- 标志物筛选课题
- 小规模研究课题
技术优势:
- 应用范围广:适用于所有参考基因组已知物种的甲基化研究;
- 全基因组覆盖:最大限度地获取完整的全基因组甲基化信息,精确绘制甲基化图谱;
- 单碱基分辨率:可精确分析每一个C碱基的甲基化状态。
易基因科技提供全面的DNA甲基化研究整体解决方案。
参考文献:Tang D, Zheng S, Zheng Z, Liu C, Zhang J, Yan R, Wu C, Zuo N, Wu L, Xu H, Liu S, He Y. Dnmt1 is required for the development of auditory organs via cell cycle arrest and Fgf signalling. Cell Prolif. 2022 May;55(5):e13225.
相关阅读:
项目文章|WGBS+RNA-seq揭示PM2.5引起男性生殖障碍的DNA甲基化调控机制
WGBS跟RRBS该如何选?表观DNA甲基化和转录调控结果关联思路
14种全基因组DNA甲基化测序(WGBS)标准分析比对软件的比较 | 生信专区
技术推介 | 全基因组重亚硫酸盐甲基化测序(WGBS)