求臻医学:DDR基因共突变预测睾丸生殖细胞肿瘤患者免疫治疗疗效
近日,求臻医学与河北医科大学第四医院肿瘤内科姜达主任科室合作,报道了一例先前接受过治疗的携带有DNA损伤修复基因共突变的转移性混合性睾丸生殖细胞肿瘤(TGCT)患者,在接收免疫治疗后长期获益的案例。截止本文发表之日,患者病情仍在持续稳定之中。目前该案例报道(case report)已在线发表于Immunotherapy,将为混合性TGCT患者接受有效的ICI治疗提供依据。
研究背景
睾丸生殖细胞瘤(TGCT)是青少年和年轻成年男性最常见的恶性肿瘤,在25-34岁之间其发病率达到高峰。TGCT的发病率在过去30年中一直在攀升。临床病理上,TGCT有两种类型:精原细胞瘤和非精原细胞瘤。非精原细胞瘤进一步细分为以下亚型:胚胎性癌、绒毛膜癌、卵黄囊瘤、畸胎瘤和混合性生殖细胞肿瘤。先前的研究表明,非精原细胞瘤比精原细胞瘤更具侵袭性,更容易转移。此外,晚期非精原细胞瘤的预后比精原细胞瘤的预后差。
尽管联合手术、基于顺铂的化疗和放疗等方式可以治愈大多数混合性TGCT患者,但某些患者对这些传统的疗法并不敏感,因此迫切需要新的治疗策略。近年来,免疫检查点抑制剂(ICIs)已广泛应用于多种肿瘤类型。然而,它们在混合性TGCT中的应用却鲜有报道。
DNA损伤修复(DDR)系统在纠正和修复DNA损伤方面起着至关重要的作用。研究表明,DDR基因的突变可以预测多种实体瘤患者对ICI治疗的反应敏感性。然而,它们在预测ICI治疗转移性混合性TGCT疗效中的作用尚未报道过。
在此,我们报道了一例经过治疗的转移性混合性TGCT患者。通过使用基于血浆的循环肿瘤DNA(ctDNA),我们发现该患者携带三个重要的DDR基因 (BRCA2、MSH6和PMS2)的共突变。该患者在接受了手术和一线化疗出现了进展后,又接受了单药PD-1抑制剂卡瑞利珠单抗(Camrelizumab)治疗,此后病情一直处于稳定状态。据我们所知,本案例为携带有DNA损伤修复基因共突变的转移性混合性TGCT患者经免疫检查点抑制剂后线治疗后长期获益的首次报道。
病例分享
案例情况:
患者,男,19岁。
因无明显诱因出现右睾丸肿胀和疼痛一个月入院。
诊疗经过:
· 2015年9月9日:磁共振成像(MRI)显示右侧睾丸形态和信号异常,肿块阴影大小约为7×6.3×9.3 cm。血清甲胎蛋白(AFP)水平为257.7ng/mL,人绒毛膜促性腺激素(hCG)水平>1000mIU/mL。
· 2015年9月11日:计算机断层扫描(CT)显示右睾丸肿块和下腔静脉左前缘有软组织结节,疑似肿大的淋巴结(图1A)。
· 2015年9月14日:患者接受了右侧睾丸的根治性切除术。术后病理学显示,右侧睾丸肿块为混合性TGCT,由胚胎性癌、卵黄囊瘤和畸胎瘤组成(图1B)。
图1. 确诊时的CT和术后病理。2015年9月11日CT扫描显示右侧睾丸肿块(A)。H.E染色的病理结果显示,右侧睾丸肿块为混合性TGCT,由胚胎性癌、卵黄囊瘤和畸胎瘤组成(B)。IHC显示肿瘤组织PD-L1表达极低,CPS为1(C,D)。
· 2015年10月22日:腹部CT显示腹膜后多处淋巴结肿大,邻近腹主动脉和右髂血管,其中最短直径超过了2cm(图2A,2B)。
· 2015年11月:患者接受了博莱霉素、依托泊苷和顺铂(BEP)的术后辅助化疗。
· 2016年2月3日:腹部平扫和增强CT显示腹膜后邻近右髂血管处多个淋巴结肿大。血清hCG水平<1.2 mIU/mL,其临床反应被评估为病情稳定(SD)。
· 2016年4月13日:经过全身正电子发射断层扫描(PET)/CT检查后,患者的治疗反应仍被评估为SD。
· 2017年3月28日:胸部和腹部增强CT扫描显示存在腹膜后和右髂血管旁结节,长约3.9cm,确定为肿大的淋巴结。与2017年2月3日相比,淋巴结明显增大,因此患者的临床反应被评估为疾病进展(PD,图2A,2B)。
· 2017年3月29日—7月20日:患者接受了6个周期的BEP方案化疗。
· 2017年4月10日:使用包括247个肿瘤相关基因的panel对患者血浆中的ctDNA进行NGS检测。发现患者有CDH1突变(p.V794fs)和 FBXW7突变 (p.G587fs),突变频率为分别为0.98% 和1.88%。由于前者对比卡鲁胺片敏感,而后者对mTOR抑制剂(如西罗莫司, 依维莫司,及替西罗莫司)敏感。因此,从2017年8月15日至2019年6月,患者每天口服50 mg 比卡鲁胺片。2019年6月,患者自行将比卡鲁胺片的剂量减少至每隔一天50 mg。期间其临床反应评估为SD(图2A-2D)。
图2. 治疗前后的动态CT成像。与2019年11月20日相比,ICI治疗后,虽然右肾下极水平处的主动脉旁结节或邻近右髂血管的淋巴结未显示出明显变化(图A,B),但是右腹股沟淋巴结呈缩小迹象(图C)。左侧腹股沟淋巴结则逐渐消失(图D)。
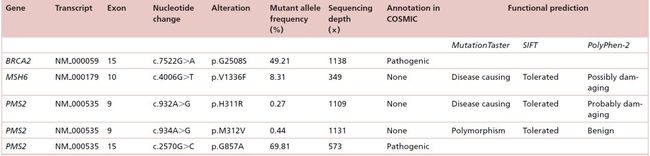
值得注意的是,本次NGS检测还发现患者存在BRCA2、MSH6和PMS2基因的五种突变(表1,图3A-3D)。
分别是:
1)BRCA2:NM_000059:chr13:exon15:c.7522G>A:p.G2508S;
2)MSH6:NM_000179:chr2:exon10:c.4006G>T: p.V1336F;
3)PMS2:NM_000535:chr7:exon9:c.932A>G:p.H311R;
4)PMS2:NM_000535:chr7:exon9:c.934A>G:p.M312V;
5)PMS2:NM_000535:chr7:exon15:c.2570G>c: p.G857A。
表1. 通过对患者血浆ctDNA的二代测序检测到的DNA损伤修复(DDR)基因的突变
图3. BRCA2(A)、MSH6(B)和PMS2(C,D)的IGV图。
· 2019年9月17日:胸部和腹部CT显示右髂血管旁淋巴结大小约为5.8×5.3 cm, 比2019年6月13日明显增大。此外,右腹股沟区淋巴结轻微肿大,最短直径约0.8 cm。血清中AFP、hCG和CEA的血清水平分别为301.4ng/mL、41.48mIU/mL和2.46ng/mL。因此,临床反应评估为PD(图2B,2C)。
患者随后开始接受后线治疗,包括2019年10月9日的首次局部放疗和随后的每3周一次的PD-1抑制剂卡瑞利珠单抗200mg。放疗后,腹部CT扫描显示,与2019年6月13日相比,右肾下极水平的主动脉旁结节没有明显变化(图2A)。
· 2019年10月20日:患者在另一家医院接受了NGS检测,结果显示MSI-L(14.89%)和TMB-M(3.8 Muts/Mb)。
· 2019年11月21日—2021 年5月: 基于2017年4月10日进行的NGS检测显示的BRCA2、MSH6和PMS2基因的五种共突变,患者接受了16个周期的单药卡瑞利珠单抗(200mg q3w)治疗。
· 2021年5月25日:CT显示,与2019年11月20日相比,右肾下极水平的主动脉旁结节或与右髂血管相邻的淋巴结没有明显变化(图2A, 2B)。此外,右腹股沟淋巴结略微缩小(图 2C),左腹股沟淋巴结逐渐消失(图2D)。
通过最近的一次随访得知,患者目前仍处于SD,无进展生存期(PFS)已超过了28个月。从确诊到现在,他已经存活了6.75年。患者的时间线如图4所示。
图4. 时间线
案例讨论
在转移性混合性TGCT的病例中,关于ICI的疗效以及DDR基因突变作为ICI治疗预测生物标志物的价值,目前的研究较少。
在本病例报告中,该转移性混合性TGCT患者后线经过ICI治疗,获得了持久的疾病稳定,PFS已经超过了28个月。通过基于血浆的ctDNA进行NGS检测发现有BRCA2、MSH6和PMS2基因的五种突变。在COSMIC数据库中,BRCA2 (p.G2508S)和PMS2 (p.G857A)的基因突变被注释为致病性。目前尚无关于MSH6(p.V1336F)、PMS2(p.H311R)和PMS2(p.M312V)突变的注释。然而,两个生物信息学软件工具(即MutationTaster和PolyPhen-2)一致预测MSH6(p.V1336F)和PMS2(p.H311R)的突变具有致病性。根据三种生物信息学软件(即MutationTaster、SIFT和PolyPhen-2)的预测结果,只有PMS2突变(p.M312V)被预测为良性。
在本案例中,PD-L1、MSI或TMB均不是预测ICI疗效的理想的生物标志物,因为免疫组化(IHC)结果显示PD-L1的表达非常低,综合阳性评分(CPS)只有1(图 1C,1D)。患者为MSI-L(14.89%)和TMB-M(3.8muts/Mb)。
Wang等人发现DDR通路中的同源重组修复(HRR)和错配修复(MMR)以及HRR和碱基切除修复(BER)的共突变是ICI治疗的潜在生物标志物。BRCA2是HRR通路的核心元件,而MSH6和PMS2在MMR通路中发挥关键作用。因此,HRR-MMR通路的共突变可能共同作用以增强对PD-1阻断的反应。与其他类型的恶性肿瘤类似,我们的病例报告表明,DDR基因的缺陷可潜在预测睾丸生殖细胞肿瘤患者的免疫治疗疗效。
一些病例报告证明了ICI治疗在转移性TGCT治疗中的可能作用。然而,这些患者中的大多数是通过ICI和化疗联合治疗的。因此,很难辨别这些疗效是由于ICI治疗还是化疗的作用。此外,关于DDR基因的突变可能是TGCT中ICI治疗的潜在预测生物标志物目前尚未报道。同时,一些关于ICI治疗TGCT的临床试验正在进行中(NCT03403777、NCT03081923、NCT03158064和NCT02834013)。
据我们所知,本案例首次报道了携带DDR基因共突变的转移性混合性TGCT患者接受单药PD-1抑制剂后长期获益。该病例可能突出了DDR基因突变在预测PD-L1、MSI-L和TMB-M低表达TGCT患者ICI治疗效果中的作用。
在过去几年中,基于血浆的ctDNA NGS作为辅助诊断手段应用越来越普遍,可为医生及肿瘤学家提供有用的信息。尽管这种方法面临许多不足和挑战,但它有很大潜力显著改善临床结果。值得注意的是,我们的案例首次报告了使用基于血浆的ctDNA检测出DDR基因突变以预测转移性混合性TGCT对ICI治疗反应的可行性。
结论与启发
本案例首次报道携带DDR基因共突变的转移性混合性TGCT患者经过ICI治疗长期获益。该发现有助于为混合性TGCT患者接受有效的ICI治疗提供依据。
参考文献:
1. Shah S, Ward JE, Bao R, Hall CR, Brockstein BE, Luke JJ. Clinical response of a patient to anti-pd-1 immunotherapy and the immune landscape of testicular germ cell tumors. Cancer Immunol. Res. 4(11), 903-909 (2016).
2. Zschabitz S, Lasitschka F, Hadaschik B et al. Response to anti-programmed cell death protein-1 antibodies in men treated for platinum refractory germ cell cancer relapsed after high-dose chemotherapy and stem cell transplantation. Eur. J. Cancer, 76, 1-7 (2017).
3. Zschabitz S, Lasitschka F, Jager D, Grullich C. Activity of immune checkpoint inhibition in platinum refractory germ-cell tumors. Ann. Oncol. 27(7), 1356-1360 (2016).
4. Roos WP, Thomas AD, Kaina B. DNA damage and the balance between survival and death in cancer biology. Nat. Rev. Cancer. 16(1), 20-33 (2016).
5. Le DT, Durham JN, Smith KN et al. Mismatch repair deficiency predicts response of solid tumors to PD-1 blockade. Science, 357(6349), 409-413 (2017).
6. Le DT, Uram JN, Wang H et al. PD-1 blockade in tumors with mismatch-repair deficiency. N. Engl. J. Med. 372(26), 2509-2520 (2015).
7. Teo MY, Seier K, Ostrovnaya I et al. Alterations in DNA damage response and repair genes as potential marker of clinical benefit from PD-1/PD-L1 blockade in advanced urothelial cancers. J. Clin. Oncol. 36(17), 1685-1694 (2018).
8. Lawrence MS, Stojanov P, Mermel CH et al. Discovery and saturation analysis of cancer genes across 21 tumour types. Nature, 505(7484), 495-501 (2014).
9. Song Y, Huang J, Liang D et al. DNA damage repair gene mutations are indicative of a favorable prognosis in colorectal cancer treated with immune checkpoint inhibitors. Front. Oncol. 10, 549777 (2020).
10. Wang Z, Zhao J, Wang G et al. Comutations in DNA damage response pathways serve as potential biomarkers for immune checkpoint blockade. Cancer Res. 78(22), 6486-6496 (2018).
11. Semaan A, Haddad FG, Eid R, Kourie HR, Nemr E. Immunotherapy: last bullet in platinum refractory germ cell testicular cancer. Future Oncol. 15(5), 533-541 (2019).
12. Cheng ML, Pectasides E, Hanna GJ, Parsons HA, Choudhury AD, Oxnard GR. Circulating tumor DNA in advanced solid tumors: clinical relevance and future directions. CA. Cancer J. Clin. 71(2), 176-190 (2021).