细胞自噬机制最新研究进展(2021年12月)
细胞自噬是指细胞分解细胞质等自身组分的一种自然现象,其作用是加速细胞的新陈代谢,或在饥饿时获得能量的一个重要手段。本文中,小编整理了多篇重要研究成果,共同解读近期科学家们在细胞自噬研究领域取得的新进展!分享给大家!
【1】Cell Death & Differentiation: 长春新碱有助于跨物种脑老化的自噬功能下降
2021-12-17报道,近日,研究者描述了小鼠大脑中的自噬生物发生随着年龄的增长而下降,这与老年小鼠和人脑组织中SORBS3基因(编码vinexin)的表达增加有关。
图片来源: https://doi.org/10.1038/s41418-021-00903-y
之前在全基因组图像siRNA筛查中,Vinexin被认为是一种候选的自噬调节因子,这表明siSORBS3治疗增加了自噬小体的数量,这是由于溶酶体加工减少,意味着自噬通量受损。虽然之前的数据没有得到跟踪,但我们在包括小鼠原代神经元在内的多个细胞系中的数据表明,使用多种试剂耗尽vinexin可以通过促进自噬小体的生物发生来增加自噬通量和底物清除。
另一种耐人寻味的可能性是SORBS3表现出拮抗的多效性,并导致“适合度权衡”。 具体地说,SORBS3已被确认为肝细胞癌的肿瘤抑制因子,而我们的研究结果表明,SORBS3表达的增加可能会促进细胞(尤其是神经元)适合性的年龄相关性下降。
原文:So Jung Park et al. Vinexin contributes to autophagic decline in brain ageing across species. Cell Death Differ. 2021 Nov 30. doi: 10.1038/s41418-021-00903-y.
【2】J Extracell Vesicles: 缺氧时促血管生成细胞外囊泡的分泌依赖于自噬相关蛋白Gabarapl1
2021-12-14报道,研究者揭示并证明了LC3/GABARAP蛋白家族成员GABARAPL1的表达增加是内体成熟、分选到内体和肠病毒分泌所必需的。
在这项研究中,作者描述了GABARAPL1在缺氧时需要分泌EVS和生长因子,从而促进了不同类型肿瘤细胞的生长。此外,作者还证明了GABARAPL1和GABARAP在较小范围内的表达,而不是GABARAPL2的表达,强调了不同的GABARAP家族成员的独特功能。
在这份报告中,作者描述了一个独特的EV亚集的发现,它由低氧细胞特异性分泌,并依赖于低氧诱导的GABARAPL1表达。重要的是,本研究观察到GABARAPL1在分泌后表达于这些EV的表面。通过使用GABARAPL1的封闭抗体来利用这一治疗切入点,这导致了体外EV功能的抑制。 此外,研究还发现,在肿瘤异种移植中沉默GABARAPL1后,肿瘤生长和再生长在照射后延迟,这是由于血管化减少和肿瘤坏死增加所致。总之,本研究显示了GABARAPL1通过低氧细胞分泌EVS在肿瘤进展中的独特作用。
原文:Tom G Keulers et al. Secretion of pro-angiogenic extracellular vesicles during hypoxia is dependent on the autophagy-related protein GABARAPL1. J Extracell Vesicles. 2021 Dec;10(14):e12166. doi: 10.1002/jev2.12166.
【3】KEAP1/PGAM5复合物的新作用:诱导自噬的ROS传感器
2021-12-07报道,在这里,作者证明了适度的线粒体超氧化物和过氧化氢的产生氧化了Keap1,从而破坏了该蛋白与PGAM5之间的相互作用,导致了其蛋白酶体降解的抑制。 积聚的PGAM5干扰线粒体内PINK1的加工,导致PINK1在线粒体膜外膜上积聚。反过来,PINK1促进了Parkin对线粒体的募集,并使线粒体对自噬去除变得敏感。作者还证明了Keap1-PGAM5蛋白相互作用的抑制剂(包括CPUY192018)可以模拟线粒体ROS的作用,并敏化有丝分裂机制,表明这些抑制剂可以作为有丝分裂的药理调节因子。
虽然有限的细胞ROS水平在正常的生理功能中是有益的,但过度的ROS积累(通常由有缺陷的线粒体产生)会导致核酸、蛋白质和脂质的氧化损伤。正常情况下,过量的ROS可被超氧化物歧化酶(SOD)、过氧化氢酶、谷胱甘肽过氧化物酶、谷胱甘肽还原酶或还原型谷胱甘肽等清除系统中和,并通过激活依赖于NRF2/Keap1(核因子红系相关因子2/Kelch ECH相关蛋白1)的途径来触发抗氧化反应。
作者展示了PINK1-Parkin和PGAM5通路之间的串扰在ROS诱导的自噬调节中的作用。作者发现Keap1的氧化抑制了PGAM5的蛋白酶体降解,导致它的积累和干扰PINK1的处理,从而使线粒体对自噬去除敏感。这一过程不需要NRF2的参与。
原文:Akbar Zeb et al. A novel role of KEAP1/PGAM5 complex: ROS sensor for inducing mitophagy. Redox Biol. 2021 Nov 11; 48:102186. doi: 10.1016/j.redox.2021.102186.
【4】Jolkinolide B通过双重抑制Akt信号和自噬使膀胱癌对mTOR抑制剂增敏
2021-12-07报道,研究表明,JB可诱导Akt反馈激活和细胞保护性自噬的双重抑制,增强mTORi对PTEN缺陷型和顺铂耐药膀胱癌细胞的抗增殖作用。同时,mTORi通过增强JB激活的内质网应激和MAPK通路,增强JB的促凋亡和促凋亡作用。这些协同作用机制与细胞内活性氧积累有关。
靶向mTOR被认为是一种有效的癌症治疗策略,几种mTOR抑制剂(MTORi),如替西罗莫司(temsirolimus,tems)、雷帕霉素(Rapa)和伊波利莫斯(evolimus,evms),已被FDA批准用于治疗一系列癌症。然而,mTORi的治疗效果并不令人满意,因为mTOR的抑制也可能激活几个代偿信号通路,从而允许细胞存活。
研究表明,JB同时抑制了mTORi诱导的Akt反馈激活和细胞保护性自噬,而mTORi则增强了JB诱导的膀胱癌细胞的凋亡和凋亡。总之,多功能增敏剂JB和mTORi的组合可能成为膀胱癌治疗的一种有前途的策略。
原文:Jun Sang et al. Jolkinolide B sensitizes bladder cancer to mTOR inhibitors via dual inhibition of Akt signaling and autophagy. Cancer Lett. 2021 Nov 16; S0304-3835(21)00581-4. doi: 10.1016/j.canlet.2021.11.014.
【5】Cell:揭示哺乳动物自噬体形成机制,新冠病毒可以破坏这种机制
2021-11-30报道,在一项新的研究中,美国新墨西哥大学自噬、炎症与代谢卓越生物医学研究中心主任Vojo Deretic教授领导的一个研究团队绘制出了自噬在哺乳动物---包括人类---中如何发挥作用的关键细节。在一项令人惊人的发现中,这些作者提供的证据显示,SARS-CoV-2感染可以破坏这一过程。相关研究结果近期发表在Cell期刊上,论文标题为“Mammalian hybrid pre-autophagosomal structure HyPAS generates autophagosomes”。
Deretic在谈到这项新研究时说,“这强调了自噬作为一种过程的重要性。这个领域正在努力了解它在哺乳动物和人类细胞中是如何发挥作用的。” 在这篇论文中,他和他的同事们描述了驻留在不同细胞膜上的两种蛋白---FIP200和ATG16L1---如何合并形成“混合自噬前体结构(hybrid pre-autophagosomal structure, HyPAS)”。
Deretic说,他们惊讶地发现SARS-CoV-2冠状病毒会干扰自噬过程。Deretic说,细胞有强大的先天免疫机制来识别试图在其内部细胞质中复制的病毒,但是这种冠状病毒已经找到了一种偷偷摸摸的方式进行增殖。 他说,“SARS-CoV-2劫持了细胞膜。这是它的大秘密。如果这种病毒要成功增殖,它需要隐藏在细胞膜内,这样,存在于细胞内的这些系统就不会发现它。它在抑制自噬,这样它就可以利用细胞膜来进行自己的邪恶工作。它非常狡猾。”
原文:Suresh Kumar et al. Mammalian hybrid pre-autophagosomal structure HyPAS generates autophagosomes. Cell, 2021, doi:10.1016/j.cell.2021.10.017.
【6】Nature Communication:自噬蛋白ATG9A能够从脂滴中动员脂质
2021-11-29报道,在这项研究中,作者调查了人类ATG9A是否在细胞内脂质稳态中发挥作用,特别是与LDS有关。结果表明,在人类细胞中,ATG9A基因的敲除(KO)或敲除(KD)导致LDs的数量和大小增加,FA从LDs到线粒体的转运受阻,线粒体FAβ氧化减少。相反,另一种在自噬后期发挥作用的蛋白质ATG7的KO不影响LD丰度和线粒体FA转运和β氧化,表明ATG9A-KO细胞中LD和FA代谢缺陷不是由于LDs自噬降解受阻所致。 作者还证明了ATG9A VTCs与内质网中富含tmem41b的亚域密切相关,并且这两种结构都在吞噬体、ld和线粒体附近被发现。这些发现证明了ATG9A对体内细胞内脂质运输的需求,并表明吞噬分子组装位点有助于脂质从LDS分布到扩大的吞噬分子和线粒体。
自噬是一种分解代谢过程,在这个过程中,细胞质物质被吞噬成双膜自噬小体,最终与溶酶体融合,被溶酶体酸性水解酶降解。这一过程始于杯状自噬前结构的从头形成,称为“吞噬载体”或“隔离膜”,与内质网(ER)富含磷脂酰肌醇的亚区(称为“omegasome”)紧密结合在一起。这一过程被称为“吞噬载体”或“隔离膜”,与内质网(ER)中富含磷脂酰肌醇的亚域(称为“omegasome”)密切相关。
原文:Elodie Mailler et al. The autophagy protein ATG9A enables lipid mobilization from lipid droplets. Nat Commun. 2021 Nov 19;12(1):6750. doi: 10.1038/s41467-021-26999-x.
【7】Sci Bull:揭示相分离参与调控细胞自噬的分子机制
doi:10.1016/j.scib.2021.10.012
液-液相分离(LLPS, liquid–liquid phase separation)是指关键分子达到阈值浓度时,与其他蛋白质或RNA一起浓缩成密闭的液状隔室的过程。LLPS通过创建相对独立的空间域来选择性地富集分子并形成不同的结构,在各种生理和信号传递过程中发挥着关键作用。近期的研究表明,相分离能够驱动叶绿体中的蛋白分选,调动宿主对病原体感染的免疫反应,感知环境温度和湿度的变化等。
细胞自噬(autophagy)指真核生物将功能异常的细胞器或生物大分子通过双层膜的囊泡运至液泡或溶酶体进行降解,以促进循环的过程。最新研究表明,自噬可以降解液态凝聚物,且前自噬体结构(pre-autophagosomal structure, PAS)也经历液-液相分离以调节自噬体形成。虽然泛素样蛋白ATG8在修饰自噬体和将特定货物招募到自噬体的过程中起核心作用,但目前尚不清楚ATG8 是否发生相分离以调节自噬体的生物合成。
近日,上海交通大学的研究人员在Science Bulletin上发表了题为“Arabidopsis AUTOPHAGY-RELATED3 (ATG3) facilitates the liquid–liquid phase separation of ATG8e to promote autophagy”的研究论文,揭示了拟南芥自噬相关蛋白ATG3通过增强ATG8e的液-液相分离进而促进细胞自噬,为细胞自噬调控机制的研究提供了新思路。自噬的核心是泛素折叠蛋白ATG8,经脂质磷脂酰乙醇胺(PE)修饰后结合吞噬体和自噬体。ATG8一旦插入自噬膜,脂质化的ATG8为众多自噬适配体和受体提供了一个对接平台,分别驱动自噬囊泡动力学和货物选择。
【8】Immunity:自噬调节内皮连接以抑制炎症期间中性粒细胞的渗出
doi:10.1016/j.immuni.2021.07.012
中性粒细胞从血液循环迁移到感染或损伤部位是一种关键的免疫反应,需要破坏血管内部的内皮细胞(EC),而不受调控的中性粒细胞跨内皮细胞迁移(TEM)是致病性的,但其生理终止的分子基础仍然未知。巨自噬/经典自噬是一种进化保守过程,能够将细胞质内容物递送至溶酶体进行降解,典型自噬已成为先天免疫功能的中心调节器,包括细胞因子的产生、免疫细胞的分化和病原体清除。虽然有足够的证据表明免疫细胞自噬相关基因调节炎症,但对EC 自噬在这方面的作用知之甚少,然而,自噬是许多EC功能的稳态调节剂,最显著的是EC存活和发育性血管生成,并且是许多血管疾病的关键调节剂。
该研究证明了发炎组织中小静脉的EC表现出强大的自噬反应,该反应在时间上与中性粒细胞运输的峰值一致,并且严格定位于EC接触。 EC自噬的遗传消融导致小鼠炎症模型中过度的中性粒细胞TEM和不受控制的白细胞迁移,而自噬的药理学诱导抑制中性粒细胞浸润到组织中。从机制上讲,自噬调节EC连接的重塑和关键EC粘附分子的表达,促进它们的细胞内运输和降解。该研究确定自噬是一种旨在终止生理炎症的EC白细胞运输机制的调节剂。
为了研究自噬在体内与中性粒细胞转运的时间谱相关的潜在作用,研究者建立了一种共聚焦显微镜方法,使用GFP-LC3转基因小鼠(GFP-Map1lc3aTG/+),观察和量化睾提肌的毛细血管后小静脉(PCVs)中LC3点的形成。最初的实验检测到微静脉ECs中GFP-LC3斑点的数量增加以响应营养饥饿,这是一种有效的典型自噬刺激剂;局部给药III类磷脂酰肌醇3-激酶(PI3K)抑制剂3-甲基腺嘌呤(3MA),这是一种成熟的饥饿诱导自噬体形成阻滞剂,显著降低ECs中显示GFP-LC3点的总ECs的百分比和这些细胞器的数量。
【9】IJMS:放疗所诱导的细胞自噬或能增强对细胞周期的调节
doi:10.3390/ijms22168391
如今,CDK4和CDK6抑制性药物在乳腺癌治疗中的临床应用不断扩大,这引起了科学家们对在其它肿瘤中测试这些药物的极大兴趣,而将这些药物与其它治疗性策略进行结合的潜力似乎是一项非常值得探索的领域,尽管研究人员假设将CDK4和CDK6抑制性药物与放疗相结合来治疗癌症,但这种方法在临床前或临床研究中并未得到充分应用;同样地,最近研究人员重点关注了自噬,其作为一种可能性的靶点通路,或嫩更提高CDK4和CDK6抑制剂的抗肿瘤效果,但还需要后期更深入的调查。
基于此前将细胞周期激酶(CDK,Cyclin-Dependent Kinase)抑制剂与激素疗法结合来治疗乳腺癌的基础,近日,一篇发表在国际杂志International Journal of Molecular Sciences上题为“CDK4, CDK6/cyclin-D1 Complex Inhibition and Radiotherapy for Cancer Control: A Role for Autophagy”的研究报告中,来自天普大学等机构的科学家们通过研究深入揭示了CDK抑制剂联合放疗治疗癌症的潜在效果。
研究者表示,这种抗癌疗法组合背后的分子机制在某些情况下与细胞的自噬有关,而自噬是一种特殊的细胞过程,其能促进细胞存活,并在特定情况下死亡,比如在那些细胞死亡机制无效的癌症中;因此,靶向作用CDK调节的细胞周期蛋白(Cyclins)在此前研究中被证明是有效的。
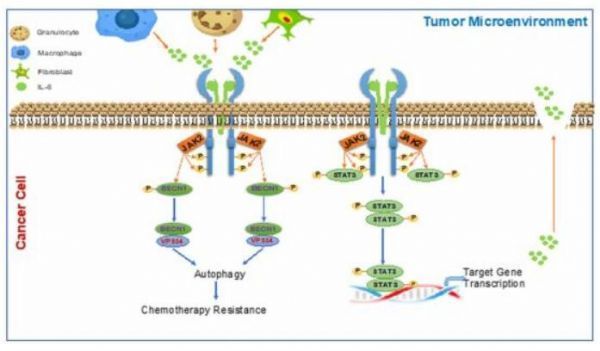
IL-6介导的自噬激活促进大肠癌化疗耐药的示意图
图片来源:https://doi.org/10.1038/s41467-021-23923-1
【10】Nature 子刊:IL-6通过促进BECN1磷酸化调节自噬和化疗耐药性
doi:10.1038/s41467-021-23923-1
细胞外细胞因子在肿瘤微环境中富集,调节肿瘤的各种重要特性,包括自噬。然而,自噬和细胞外细胞因子之间联系的确切分子机制仍有待阐明。在本研究中,作者证明了IL-6通过IL-6/JAK2/BECN1途径激活自噬并促进大肠癌(CRC)的化疗耐药。从机制上讲,IL-6触发JAK2和BECN1之间的相互作用,其中JAK2在Y333磷酸化BECN1。作者通过调节PI3KC3复合物的形成,证明BECN1 Y333磷酸化在BECN1激活和IL-6诱导的自噬中起关键作用。此外,作者还研究了BECN1Y333磷酸化作为预测结直肠癌预后不良和化疗耐药的标志物。针对IL-6/JAK2/BECN1信号通路的自噬抑制剂或药物联合治疗可能是大肠癌治疗的一种潜在策略。
癌症的发生与特定的肿瘤微环境(Tme)密切相关,包括间质成纤维细胞、浸润的免疫细胞、血液或淋巴管网络以及细胞外基质。TME中的正常细胞可以被癌细胞吸收或修饰以产生多种生长因子、趋化因子和基质降解酶,从而促进癌细胞的增殖和侵袭。IL-6是TME中常见的细胞因子,肿瘤相关的巨噬细胞、粒细胞、成纤维细胞和癌细胞都是IL-6的主要来源。IL-6直接作用于癌细胞,触发STAT3靶基因的表达,其编码蛋白促进癌细胞增殖和存活,促进血管生成、侵袭、转移和免疫抑制。此外,IL-6刺激额外的促炎细胞因子的产生,因为IL-6在TME中招募了许多类型的免疫细胞。IL-6水平在多种不同癌症的患者中均可观察到,如乳腺癌、宫颈癌和结直肠癌。值得注意的是,核因子-核转录因子B(NF-κB,NF-κB)是推动IL-6表达的关键转录因子,在许多人类肿瘤中普遍观察到NF-κB的高激活。此外,手术和放化疗会增加循环中的IL-6水平,据报道,复发肿瘤患者的循环IL-6水平也会升高。炎症性肠病患者也可观察到血清IL-6水平升高,且IL-6水平一般与结直肠癌患者的肿瘤大小、分期和转移有关。在几种类型的癌症中,循环中的IL-6水平已被证明是生存的预后指标和治疗反应的预测因子。
【11】Cell Rep:增强机体的自噬过程或有望帮助治疗糖尿病
doi:10.1016/j.celrep.2021.109184
自噬作用功能失调往往参与到了多种代谢性疾病的发病过程中,包括2型糖尿病等;然而,自噬机制调节机体代谢的机制目前研究人员并不清楚,自噬被认为是一种通过溶酶体介导的降解过程。近日,一篇刊登在国际杂志Cell Reports上题为“The autophagy protein Becn1 improves insulin sensitivity by promoting adiponectin secretion via exocyst binding”的研究报告中,来自美国西北大学等机构的科学家们通过研究发现,增强脂肪组织中的自噬作用或能帮助治疗糖尿病。
研究者表示,自噬是一种能分解并清除机体不必要组分的细胞过程;Beclin 1/Becn1作为一种促进自噬过程的特殊蛋白,其能通过参与到激素脂联素(adiponectin)的通路中来使得细胞对胰岛素变得敏感;尽管该过程的某些方面需要进一步研究,但这种机制似乎能被用来治疗糖尿病患者的胰岛素耐受。研究者Congcong He说道,如果有什么东西能够模仿或增强脂联素的功能,其或许就能有效治疗糖尿病。
自噬在许多过程中扮演着关键角色,比如移除寿命较长且错误折叠的蛋白质、清理损伤的细胞器、调节细胞的生长和代谢等,自噬过程的一个主要调节子就是名为Beclin 1的特殊蛋白。在正常生物体中,Beclin 1仅会在特定压力状况下被激活,比如缺少营养物质或氧气等。Beclin 1的激活会诱发自噬过程,从而就会回收再循环功能失调的细胞结构,并能够改善首先诱发这一过程的压力因素。
此前研究中,研究人员设计出了Beclin 1突变后能增强其功能的遗传工程化小鼠,结果发现,这些小鼠除了能减缓机体心脏和肾脏的寿命外,还能延长机体的寿命;而且这些小鼠对葡萄糖会变得不耐受但对胰岛素会更加敏感。研究者表示,其并不能清除葡萄糖,这种表型就类似于1型糖尿病,但如果给予小鼠注射胰岛素的话,其反应就会更好;尽管这些小鼠存在胰岛素储存缺陷,但研究人员并不清楚为何其对胰岛素会更加敏感。
【12】Cell:重大进展!实验性药物CA激活分子伴侣介导的自噬,有潜力治疗阿尔茨海默病
doi:10.1016/j.cell.2021.03.048
阿尔茨海默病是一种起病隐袭、呈进行性发展的神经退行性疾病,临床特征主要为认知障碍、精神行为异常和社会生活功能减退。一般在65 岁以前发病为早发型,65 岁以后发病为晚发型,有家族发病倾向被称为家族性阿尔茨海默病,无家族发病倾向被称为散发性阿尔茨海默病。据世界卫生组织报告,目前全球约有5000 万人患有痴呆症,其中阿尔茨海默病是最常见的类型。阿尔茨海默病可能的危险因素包括:增龄、女性、低教育水平、吸烟、中年高血压与肥胖、听力损害、脑外伤、缺乏锻炼、社交孤独、糖尿病及抑郁障碍等。
在一项新的研究中,来自美国阿尔伯特-爱因斯坦医学院的研究人员设计出一种实验性药物,它可以在小鼠体内逆转阿尔茨海默病的关键症状。该药物通过重新激活一种消化和循环利用不需要的蛋白以去除它们的细胞清理机制而起作用。相关研究结果于2021年4月22日在线发表在Cell期刊上,论文标题为“Chaperone-mediated autophagy prevents collapse of the neuronal metastable proteome”。
这些作者表示,在小鼠身上取得的发现并不总是适用于人类,特别是在阿尔茨海默病中,不过他们发现导致阿尔茨海默病小鼠模型的细胞清理能力下降也发生在该疾病患者身上,这表明这种药物也可能在人类身上发挥作用。在20世纪90年代,阿尔伯特-爱因斯坦医学院老龄化研究所共同主任Ana Maria Cuervo博士发现了这种称为分子伴侣介导的自噬(chaperone-mediated autophagy, CMA)的细胞清理过程,至今针对它在健康和疾病中的作用发表了200篇论文。
随着人们年龄的增长,CMA的效率越来越低,这就增加了不需要的蛋白积累成损害细胞的不溶性团块的风险。事实上,阿尔茨海默病和所有其他神经退行性疾病的特点是在患者的大脑中存在有毒的蛋白聚集物。这些作者在这项研究中揭示了CMA和阿尔茨海默病之间的动态相互作用,神经元中CMA的丧失可促进阿尔茨海默病,反之亦然。这些发现表明,激活CMA的药物可能为治疗神经退行性疾病带来希望。
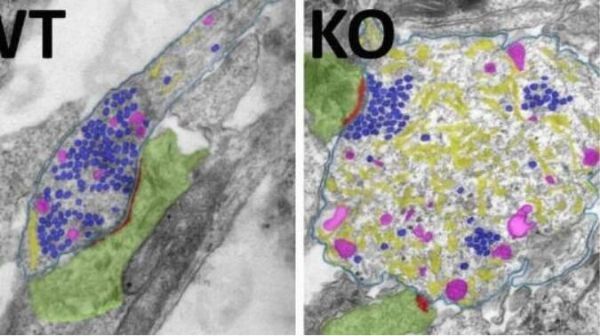
【13】Dev Cell:阻断细胞自噬可用于治疗癌症
doi:10.1016/j.devcel.2020.12.016
回收罐头和瓶子是一个好习惯。它有助于保持地球清洁。体内细胞内的循环利用也是如此。每个细胞都有清除废物的方法,以再生更新,更健康的细胞。这种“细胞回收”过程被称为自噬。针对和改变这一过程与帮助控制或减少某些癌症有关。现在,辛辛那提大学的研究人员已经表明,通过改变细胞的回收过程能够有效改善乳腺癌细胞的生长。这些结果发表在Developmental Cells杂志上。
通讯作者Jun-Lin Guan博士说:“自噬有点像细胞自相残杀。他们吃掉自己令人讨厌的成分,从而保证大部分结构不受损害;但是,我们不希望癌细胞这样做,因为这会使癌细胞变得更强壮,更健康的。以前的研究发现,阻断此过程会减慢另一种乳腺癌的生长速度,但尚不清楚阻断自噬是否对HER2阳性乳腺癌是否有益。”
这类乳腺癌是一种恶性癌症,其生长迅速。尽管有有效的治疗方法,但不幸的是,这些特定的癌细胞找到了一种对治疗产生抵抗力的方法,从而导致患者复发和更高的死亡率。该研究的研究人员使用动物模型显示,阻断自噬消除了这种类型乳腺癌的发展和生长,“甚至比我们先前对其他类型乳腺癌的研究都更大”。研究人员还发现,通过阻止这种活动,他们能够完全影响癌细胞内的其他活动和机制,从而改变其作用和反应。
图片来源:Dmytro Puchkov, Marijn Kuijpers
【14】Neuron解析!自噬作用如何保护大脑神经元细胞免受损伤?
doi:10.1016/j.neuron.2020.10.005
近日,一篇发表在国际杂志Neuron上题为“Neuronal autophagy regulates presynaptic neurotransmission by controlling the axonal endoplasmic reticulum”的研究报告中,来自莱布尼茨分子药理学研究所等机构的科学家们通过研究揭示了自噬在神经元功能发挥中所扮演的关键角色。研究者指出,自噬似乎保护了大脑中的神经元细胞,而其背后的原因或许与此前假设的并不相同,当研究人员利用遗传技巧关闭自噬介导的细胞废物处理系统时(并没有像预期那样检测到蛋白质沉积物),他们发现,细胞中内质网的水平升高了,而内质网是一种由膜囊组成的系统,除了其他功能外,其还充当了钙质的储存器,这就会导致神经递质释放的升高,最终引发致命性的神经元过度兴奋。
自噬在健康细胞的功能维持过程中扮演着关键角色,其中一个典型例子就是通过所谓的自噬体来降解并回收损伤的蛋白质分子或整个细胞器,比如缺陷的线粒体等;这种清理机制对于大脑中的神经元尤其重要,自噬能够帮助清理蛋白质沉积物,比如在神经变性疾病发生过程中出现的蛋白质等,自噬的神经保护效应如今也已经被科学家们利用模式生物进行研究证实了。然而,这种保护性效应的原因或许与研究人员此前假设的并不相同,通过调查自噬在年轻健康小鼠中枢神经系统中所扮演的关键角色,研究人员如今取得了新的研究发现。
文章中,他们利用遗传技巧首先关闭了必要的自噬基因,随后利用蛋白质组学技术分析了神经元中蛋白质的水平,而此前假设主要由自噬过程降解的蛋白质或许根本就没有在神经元中富集,如果其降解是通过自噬过程发生的,这或许就是可以预料的。文章中,研究人员并未发现预期的自噬底物,而是在神经元轴突中发现了异常高水平的内质网,这些膜囊和小管的功能之一就是为钙质提供大量的细胞内储存,细胞中钙质的调节对中枢神经系统的兴奋性传输至关重要,当神经元彼此间相互交流时,钙离子通道就会在突触处打开,从而导致钙质从外涌入突触,同时还会导致突触小泡释放神经递质,这样钙质就会被泵出神经元或者进入到内质网内,当然也可以根据需要进行释放。
【15】Nature子刊:揭秘一种未知蛋白在细胞自噬过程中所扮演的关键角色
doi:10.1038/s41594-020-00518-w
近日,一项刊登在国际杂志Nature Structural & Molecular Biology上的研究报告中,日本微生物化学研究所等机构的科学家们通过研究发现,一种拥有能介导细胞自噬功能的Atg9蛋白或许在其两层脂质双分子层之间存在磷脂转位活性(phospholipid translocation activity),同时研究人员还阐明了Atg9的活性或会导致自噬体膜的扩张表现。
自噬体(autophagosome)的形成是确定自噬过程降解靶点的重要步骤,也是细胞内蛋白降解的其中一项机制,尽管此前研究人员发现,作为脂质转移蛋白,Atg2能从内质网中转移磷脂分子,但他们并不清楚利用运输的磷脂分子来促进膜扩张的分子机制。
这项研究中,研究人员对人类和酵母中具有未知功能的膜蛋白Atg9进行了研究,他们发现,在体外试验中Atg9能够展现出脂质爬行酶的活性(lipid scramblase activity),此外,当通过冷冻电镜技术来分析Atg9的三维结构时,研究者发现,Atg9拥有能将两个膜片结构连接到脂质双分子层上的孔状结构,此外,这种成孔氨基酸的突变还会导致Atg9在体外失去脂质爬行酶的活性,并能够抑制酵母中自噬体的形成;因此,这项研究中,研究人员揭示了一种全新的机制,即Atg9或能作为一种新型的爬行酶,并能与Atg2(一种脂质转移蛋白)相结合,这两种蛋白或许都能发挥作用最终形成自噬体。
【16】Science:重磅!分子伴侣介导的自噬调节胚胎干细胞的多能性,有望开发新的再生疗法
doi:10.1126/science.abb4467
在一项新的研究中,来自美国宾夕法尼亚大学佩雷尔曼医学院的研究人员发现胚胎干细胞中称为CMA(chaperone-mediated autophagy, 分子伴侣介导的自噬)的自噬过程可能作为修复或再生受损细胞和器官的新型治疗靶点。相关研究结果发表在2020年7月24日的Science期刊上,论文标题为“Chaperone-mediated autophagy regulates the pluripotency of embryonic stem cells”。
人体包含200多种不同类型的特化细胞。所有这些细胞都可以由胚胎干细胞(ESC)分化而来。胚胎干细胞不断地自我更新,同时保留了分化为成年动物中任何一种细胞类型的能力,这种状态称为多能性。科学家们已知道细胞代谢在这一过程中起到了一定的作用;但是,目前还不清楚细胞的内部线路究究竟如何起作用以保持这种状态并最终决定干细胞的命运。
这项新的临床前研究首次展示了胚胎干细胞如何将CMA保持在低水平,以促进这种自我更新,而且我们揭示了两种可能操纵胚胎干细胞自我更新和分化的新方法来关闭这种抑制,以增强CMA活性和让它们分化成特化细胞。研究者Xiaolu Yang博士表示,“对于希望开发组织或器官再生疗法的人们来说,这是干细胞生物学领域的一个耐人寻味的发现。我们揭示了两种可能操纵胚胎干细胞自我更新和分化的新方法:CMA和一种由CMA调节的称为α-酮戊二酸(alpha-ketoglutarate)的代谢物。合理干预或引导这些功能可能是提高再生医学方法效率的有力途径。”
糖尿病、AD、基因编辑、CAR-t\干细胞等更多相关研究进展,请查看:
最新进展 - 泽平公开课![]() http://zepingbio.m.motj.cn/col.jsp?id=135
http://zepingbio.m.motj.cn/col.jsp?id=135