单基因泛癌+免疫浸润+实验sci思路。看完你也能轻松拿到4+以上
今天给同学们分享一篇单基因泛癌+免疫浸润+实验的生信文章“Comprehensive analysis of the correlation of the pan-cancer gene HAUS5 with prognosis and immune infiltration in liver cancer”,这篇文章于2023年2月10日发表在Scientific Reports期刊上,影响因子为4.6。

肝癌是全球癌症相关死亡的最常见原因之一,仍然是全球健康挑战,其发病率在全球范围内不断增长。肝细胞癌(HCC)是最常见的原发性肝癌类型,约占所有病例的80%。乙型和丙型肝炎病毒感染、酒精滥用以及摄入真菌代谢产物黄曲霉毒素B1是HCC的主要风险因素。
1. HAUS5表达的显著差异和HAUS5作为泛癌预后生物标志物的评估
作者使用GTEx数据集分析了正常组织中HAUS5的表达水平。如图1A所示,与其他组织相比,卵巢和睾丸组织的表达水平相对较高,而血液和肝脏组织的表达水平相对较低。作者从CCLE数据库下载了肿瘤细胞系的数据,并分析了多个肿瘤细胞中HAUS5的表达情况(图1B)。结果显示,HAUS5的表达水平通常升高,并且在不同组织来源的癌细胞系中存在显著差异(Kruskal Wallis检验P = 2e−49),这与TCGA数据库的分析结果一致,即大多数肿瘤组织的表达水平高于正常组织。为了进一步确定HAUS5的差异表达情况,作者分析了20种不同肿瘤和正常组织中的HAUS5 mRNA水平。如图所示。1C,HAUS5 mRNA水平在胶质母细胞瘤(GBM),脑低级别胶质瘤(LGG),肺腺癌(LUAD),结肠腺癌(COAD),乳腺浸润性癌(BRCA),食管癌(ESCA),肾乳头状细胞癌(KIRP),胃腺癌(STAD),前列腺腺癌(PRAD),子宫体内膜癌(UCEC),头颈部鳞状细胞癌(HNSC),肾透明细胞癌(KIRC),肺鳞状细胞癌(LUSC),肝细胞癌(LIHC),甲状腺癌(THCA),直肠腺癌(READ),膀胱尿路上皮癌(BLCA)和胆管癌(CHOL)组织中显著高于正常组织。由于某些癌症正常样本数量较少,作者将GTEx和TCGA数据集与log2(x + 1)表达值整合,并分析了27种癌症类型中HAUS5表达的差异。作者在肿瘤中发现了HAUS5的高表达,包括GBM、LGG、UCEC、宫颈鳞状细胞癌(CESC)、KIRP、COAD、STAD、HNSC、KIRC、LUSC、LIHC、BLCA、READ、胰腺腺癌(PAAD)、急性髓系白血病(LAML)和CHOL,但在LUAD、PRAD、皮肤切除性黑素瘤(SKCM)、THCA、卵巢浆液性囊腺癌(OV)、睾丸生殖细胞肿瘤(TGCT)和子宫肉瘤(UCS)中的表达低于正常水平(图1D)。
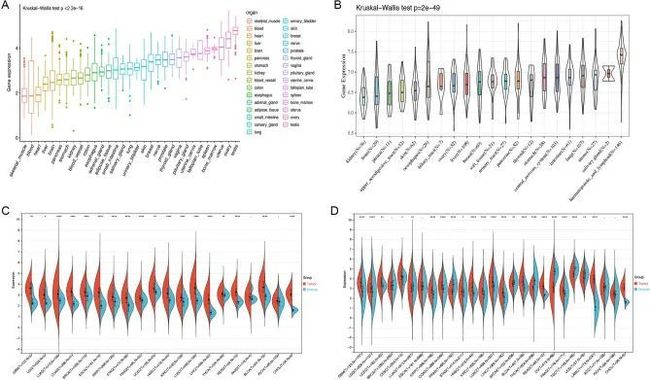
图1 HAUS5的差异表达
在确认HAUS5在大多数肿瘤中过度表达后,作者进一步探讨了HAUS5表达与泛癌症患者预后的关系。作者分析了33种肿瘤中基因表达与预后之间的关系。从图2A中,作者发现HAUS5表达显著影响多种癌症类型患者的生存期,包括肾上腺皮质癌(ACC)(p = 8.90E−04)、肾透明细胞癌(KIRC)(p = 2.70E−05)、低级胶质瘤(LGG)(p = 3.30E−09)、肝细胞癌(LIHC)(p = 1.90E−03)、间皮瘤(MESO)(p = 3.10E−03)、前列腺癌(PRAD)(p = 0.02)、直肠癌(READ)(p = 3.00E−02)、肉瘤(SARC)(p = 0.04)和胸腺瘤(THYM)(p = 0.02)。此外,HAUS5在READ和THYM中是低风险基因,而在其他类型的癌症中是高风险基因。考虑到随访期间可能存在非肿瘤死亡因素的可能性,作者分析了HAUS5表达与疾病特异性生存(DSS)之间的关系。在图2B中,高HAUS5表达与ACC(p = 1.20E−03)、KIRC(p = 2.90E−04)、LGG(p = 3.90E−09)、LIHC(p = 1.80E−04)、MESO(p = 1.20E−03)、PRAD(p = 5.10E−03)和甲状腺癌(THCA)(p = 0.04)患者的预后不良相关。就HAUS5表达与无病生存期(DFI)之间的关联而言,森林图(图2C)显示COAD(p = 0.02)、LGG(p = 0.03)、LIHC(p = 4.50E−04)和PRAD(p = 1.70E−04)患者高表达与不良预后相关。在ACC(p = 5.40E−03)、LGG(p = 7.10E−08)、LIHC(p = 5.80E−05)、MESO(p = 0.02)和PRAD(p = 3.40E−08)中,高HAUS5表达与较短的无进展生存期(PFI)显著相关(图2D)。从结果中作者发现,HAUS5与LIHC、LGG和PRAD中的所有四个生存指标显著相关,这表明HAUS5在多种肿瘤中发挥重要作用。

图2 基于SangerBox数据库,根据HAUS5表达的33种肿瘤的生存分析结果绘制了森林图
2. 高表达和临床相关性的HAUS5在LIHC中
作者使用R软件包对TCGA数据库中的419个样本进行了生物信息学分析,以验证LIHC在各种癌症中的发现。根据图3A,作者发现HAUS5 mRNA在LIHC样本(369例)中显著高于正常样本(50例),这与泛癌分析结果一致。图3B显示,HAUS5 mRNA的表达水平高于癌旁组织(n = 50)。图3C显示,GSE25097数据集分析验证了HAUS5表达差异。通过使用来自CPTAC和HPA数据库的临床标本,作者发现了正常和肿瘤组织中HAUS5的蛋白表达水平。根据图3D、E,与正常组织相比,肿瘤组织中HAUS5的表达水平相对较高,与mRNA结果相似。作者通过Kaplan-Meier生存曲线分析了HAUS5 mRNA表达与LIHC患者预后之间的关系,以探索HAUS5是否可以作为LIHC的预后生物标志物。研究结果表明,HAUS5表达高的患者在LIHC队列中的预后较差(OS:截断值=513,风险比(HR)=1)。52,p = 0.022;DSS:截断值 = 513,HR = 1.84,p = 0.0097;无复发生存期(RFS):截断值 = 520,HR = 1.38,p = 0.055;无进展生存期(PFS):截断值 = 513,HR = 1.44,p = 0.014)(图3F–I)。

图3 在肝细胞癌中,HAUS5的表达水平高且具有预后价值
为了确定HAUS5表达在肿瘤发展中的重要性,作者观察了HAUS5表达与LIHC的病理特征在Kaplan-Meier Plotter数据库中的相关性。HAUS5表达上调与男性患者的较差OS和PFS相关(OS HR = 1.68,p = 0.023;PFS HR = 1.69,p = 0.0041),以及女性患者(OS HR = 2.38,P = 0.0043)。具体而言,增加的HAUS5 mRNA表达与I + II期(OS HR = 2.63,p = 6.20E-05;PFS HR = 1.64,p = 0.014)的LIHC患者的较差OS和PFS相关。此外,作者发现2级(OS HR = 2.13,p = 0.0053;PFS HR = 2.02,p = 0.0051)患者的OS和PFS与HAUS5表达相关。HAUS5与无乙型肝炎病毒感染的患者的较差OS和PFS相关(OS HR = 1.73,p = 0.023;PFS HR = 2.75,p = 2.70E−05)。随后,作者使用UALCAN数据库探索了HAUS5在正常和肝细胞癌组织中根据不同的临床特征(如年龄、性别、种族、肿瘤分级、TNM分期和TP53突变状态)的表达差异。如图4A-F所示,作者的结果表明HAUS5表达与临床参数和肝癌发展密切相关。

图4 通过UALCAN数据库分析HAUS5表达水平与LIHC临床特征之间的关联
3. 构建一个预测肝细胞癌患者预后的诺莫图
根据OS单变量和多变量Cox回归分析,TNM分期和HAUS5表达显著相关(图5)。构建了一个整合年龄、性别、TNM分期和HAUS5风险评分的预测图(图6A)。总分通过将遗传评分、年龄、性别和TNM分期的分数相加来计算。预测3年和5年生存率的校准曲线表明,预测图所预测的生存率与实际生存结果密切相符。基于TCGA队列,3年预测图的AUC为0.74,5年预测图的AUC为0.77(图6B)。几乎重叠的参考线表明该模型准确无误(图6C、D)。

图5 TCGA-LIHC队列中HAUS5与其他临床参数与OS的单变量(a)和多变量(b)Cox回归分析的相关性

图6 构建和评估一个用于预测肝细胞癌患者3年和5年生存率的图表
4. 共表达基因和功能富集分析
基于TCGA-LIHC数据集,作者研究了低表达组和高表达组之间的差异表达基因(DEGs),以探究HAUS5的生物功能。富集的生物通路(BP)与发育相关,包括“核分裂”、“细胞器分裂”、“染色体分离”、“有丝分裂核分裂”和“核染色体分离”(图7A)。富集的细胞组分(CC)与“含胶原的细胞外基质”、“突触膜”、“凝缩染色体”、“染色体着丝粒区域”和“凝缩染色体着丝粒区域”相关(图7B)。在分子功能(MF)方面,DEGs主要富集在“通道活性”、“被动跨膜转运活性”、“信号受体激活活性”、“受体配体活性”和“离子通道活性”(图7C)。作者还进行了KEGG通路富集分析,结果显示高HAUS5表达主要与细胞周期、视黄酸代谢、药物代谢-细胞色素P450、PPAR和P53信号通路相关(图7D)。
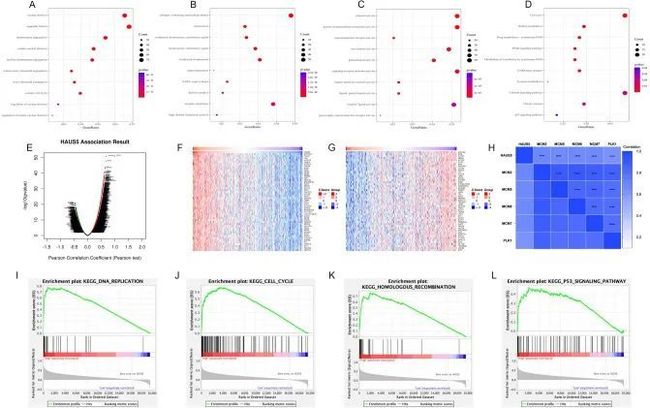
图7 HAUS5的功能富集分析和共表达基因
LinkedOmics数据库被用来研究HAUS5共表达基因。如火山图(图7E)所示,4836个基因(深红色点)与HAUS5呈显著正相关,2730个基因(深绿色点)呈负相关(虚假发现率(FDR < 0.01)。图7F、G显示了与HAUS5正相关和负相关的前50个基因。此外,作者还创建了一个热图,显示了HAUS5与几个参与细胞周期调控的基因之间的相关性(图7H)。作为细胞增殖的潜在标志物,MCM2-7在DNA复制中起着重要作用,并与肝癌的进展和预后有关。PLK1是一个重要的细胞周期调控蛋白激酶,与HAUS5 mRNA表达呈正相关。如图7I-L所示,GSEA显示与HAUS5表达呈正相关的基因主要富集在DNA复制、细胞周期、同源重组和P53信号通路中。这些结果表明HAUS5与DNA复制和细胞分裂有关。
5. HAUS5表达与免疫浸润相关
通过将CIBERSORT算法应用于TCGA-LIHC队列的转录组,评估了肝癌患者的免疫细胞浸润水平(图8A)。随后,作者根据HAUS5的中位表达将样本分为不同亚组,并使用ssGSEA方法研究肝癌组织中28种免疫细胞的分布情况(图8B)。在低组中,有12种免疫细胞亚型(活化的CD8 T细胞、CD56dim自然杀伤细胞、效应记忆CD8 T细胞、嗜酸性粒细胞、巨噬细胞、肥大细胞、单核细胞、自然杀伤细胞、中性粒细胞、浆细胞样树突状细胞、调节性T细胞和1型T辅助细胞)的HAUS5表达较高组别表达更高。结果显示,低HAUS5表达组具有更丰富的免疫浸润细胞,尤其是活化的CD8 T细胞和自然杀伤细胞。鉴于免疫治疗在LIHC患者中的临床应用的重要性,作者进一步探讨了HAUS5表达与免疫检查点的相关性。从图中可以看出 在作者的研究中发现,HAUS5的表达与大多数免疫调节靶点呈现不同程度的相关性(CCL14(r = -0.35,p = 5.02e-12),CXCL12(r = -0.372,p = 1.43e-13),KDR(r = -0.442,p = 2.2e-16),TMEM173(r = -0.428,p = 2.2e-16),PDCD1(r = 0.283,p < 0.001)和PDL1(r = 0.206,p < 0.001))。此外,作者还包括了369个肝细胞癌(LIHC)样本,检测到了突变。在图8D的瀑布图中,显示了前15个突变基因,其中189个(51.2%)LIHC患者具有不同颜色编码注释表示的体细胞突变类型。与HAUS5表达低的组相比,高表达组在LIHC中的前10个突变基因(包括TP53、BAP1、RB1、NBEA、DCHS1、MUC17、DNAH10、HECTD4、TSC2和LRRK2)中显著具有更多的突变。这些结果表明,HAUS5的表达与肝细胞癌中的免疫浸润相关。
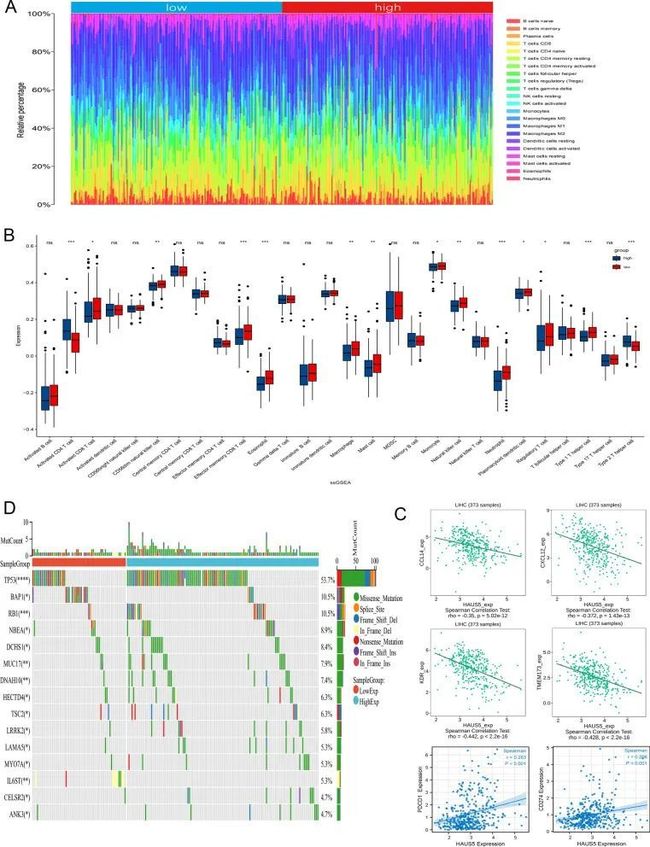
图8 HAUS5表达与肿瘤微环境中的免疫浸润和突变相关
6. HAUS5的敲除显示出抑制肿瘤的效果
在体外试验中,作者通过qRT-PCR比较了HepG2和Huh7细胞系中HAUS5的基线表达水平,结果显示HepG2的HAUS5 mRNA表达高于Huh7(图9A)。作者使用siRNA在HepG2和Huh7细胞中敲低了HAUS5的表达,并通过qRT-PCR进行了验证(图9B)。作者使用CCK-8和集落形成实验评估了LIHC细胞的增殖情况。结果显示,HAUS5敲低显著抑制了细胞增殖(图9C、D)。不同处理组的细胞被接种到6孔板中。板上分别接种了1000个细胞(HepG2)或3000个细胞(Huh7)。细胞培养14天后固定,用吉姆萨染色后进行计数。结果显示,HAUS5敲低组的集落形成率显著低于对照组(图9E)。EdU实验表明,HAUS5敲低细胞中DNA复制受到了抑制(图9F)。作者的研究表明,抑制HAUS5的表达显著降低了肝癌细胞的增殖。
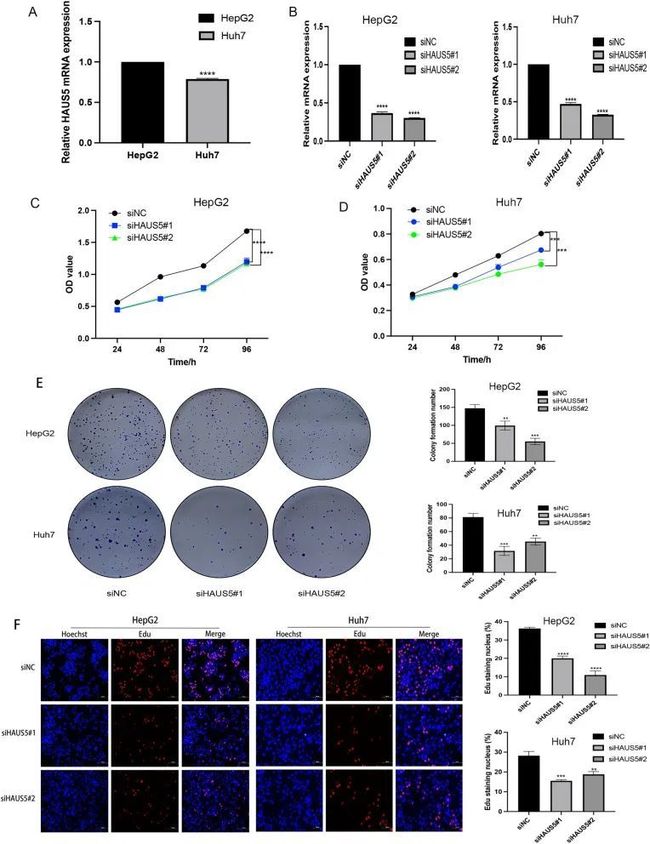
图9 HAUS5基因敲低对细胞增殖的影响
总结
在这项研究中,通过生物信息学分析,将泛癌基因HAUS5确定为肝癌的一种新的预后标志物。作者进一步通过体外实验验证了抑制HAUS5表达可以抑制肝癌细胞的增殖。新的生物标志物的发现有望改善患者的生存率。然而,这项研究存在一些局限性。作者大部分的发现都是基于数据分析,未来需要进行更多的实验来进一步验证和探索潜在的机制。