参考意义大。4+巨噬细胞相关生信思路,简单易复现。
今天给同学们分享一篇生信文章“Angiogenesis regulators S100A4, SPARC and SPP1 correlate with macrophage infiltration and are prognostic biomarkers in colon and rectal cancers”,这篇文章发表在Front Oncol期刊上,影响因子为4.7。
结果解读:
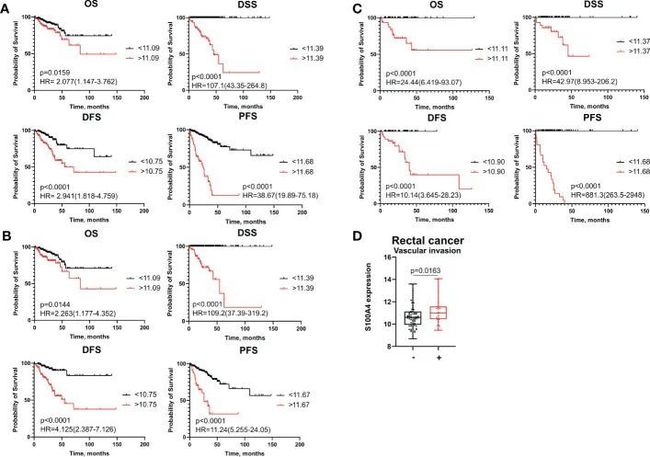
高S100A4 mRNA表达是一个强有力的预测因子,与癌症类型无关,预示着较短的生存率
作者应用Cox回归分析、ROC分析和Kaplan-Meier曲线来评估S100A4在结直肠癌(CRC)总体组、结肠癌(CC)患者和直肠癌(RC)患者的疾病预后的重要性。在每个组中,根据ROC分析确定的截断意义,将所有患者根据S100A4表达分为高风险组和低风险组,以预测总体死亡、疾病相关死亡、复发和进展。Kaplan-Meier生存曲线显示,S100A4高风险组(>截断值)的CRC患者相比低风险组(<截断值)具有更短的总生存期(OS)(p=0.0159)、疾病特异性生存期(DSS)(p<0.0001)、无病生存期(DFS)(p<0.0001)和无进展生存期(PFS)(p<0.0001)(图1A)。对于结肠癌和直肠癌患者的OS、DSS、DFS和PFS,结果也相似(图1B、C),表明S100A4 mRNA表达的预后意义不依赖于癌症类型。
SPARC mRNA表达升高是结肠癌而非直肠癌预后不良的准确独立预测因子
SPARC(分泌性富含半胱氨酸的蛋白,也被称为骨基质结合蛋白或BM-40)是一种钙结合的基质细胞外蛋白。在肿瘤微环境中,SPARC具有抗血管生成作用,并影响肿瘤生长、细胞外基质沉积。类似于S100A4,ROC分析根据SPARC mRNA水平将所有患者分为高风险组和低风险组,用于预测总体死亡、疾病相关死亡、复发和进展的预后。高风险组中SPARC mRNA表达超过截断值与较差的无病生存期(p=0.0017)和较差的无进展生存期(p=0.0039)显著相关,但与较好的总生存期(p=0.0401)相关,适用于CRC患者(图2A)。结肠癌患者也呈现类似趋势(图2B)。在直肠癌中,SPARC mRNA表达超过截断值与较差的总生存期(p=0.0061)、较差的无病生存期(p=0.0371)和较差的无进展生存期(p=0.0120)相关(图2C)。在单变量COX分析中,SPARC基因表达超过截断值预测结直肠癌组患者的较差无病生存期(HR=2.88;95% CI [1.377-6.006],p=0.004)和较差无进展生存期(HR=2.06;95% CI [1.308-3.258],p=0.002),以及结直肠癌患者的较差无病生存期(HR=2.64;95% CI [1.141-6.110],p=0.023)和较差无进展生存期(HR=1.98;95% CI [1.172-3.360],p=0.010)。在调整年龄、肿瘤分期、肿瘤大小、淋巴血管侵犯、血管侵犯和淋巴结转移后,多变量Cox回归分析显示,增加的SPARC mRNA表达仍然是结直肠癌患者不良无病生存期(HR=6.65;95% CI [2.208-20.100],p=0.0007)和不良无进展生存期(HR=1.88;95% CI [1.144-3.120],p=0.001)的独立预后因子。在结直肠癌患者中,高风险组的SPARC mRNA表达还独立预测短期无病生存期(HR=7.44;95% CI [2.082-26.600],p=0.002)和短期无进展生存期(HR=1.83;95% CI [1.021-3.302],p=0.042)。在RC患者中,SPARC mRNA水平高于截断值在短期OS方面具有预后意义(HR=5.84;95% CI [1.404-21.421],p=0.014),短期DFS方面具有预后意义(HR=2.83;95% CI [1.019-7.907],p=0.045),以及短期PFS方面具有预后意义(HR=4.50;95% CI [1.332-15.225],p=0.015)在单变量COX分析中。但在多变量分析中,它不是一个独立的标准。因此,作者得出结论,SPARC mRNA表达在结直肠癌中可以作为DFS和PFS的独立预后因子。
SPP1 mRNA表达增加是直肠癌和结肠癌PFS的独立不利指标
分泌磷酸蛋白1(SPP1,OPN,骨营养素)是一种与整合素结合的基质细胞外蛋白,已发现参与许多细胞过程,如细胞信号通路、细胞黏附和迁移、细胞介导的免疫、血管生成和转移。Kaplan-Meier分析显示,在结直肠癌(CRC)患者中,基于SPP1 mRNA水平高于截断值的高风险组与低风险组相比,其总生存率较差(p=0.0312),无疾病生存率较差(p=0.0308),无进展生存率较差(p=0.0018)(图3A)。在结肠癌患者中,SPP1表达较高的病例的总生存率(p=0.0108)和无进展生存率(p=0.0139)较低(图3B)。对于直肠癌患者,高风险组的无疾病生存率(p=0.0375)和无进展生存率(p=0.0417)降低(图3C)。
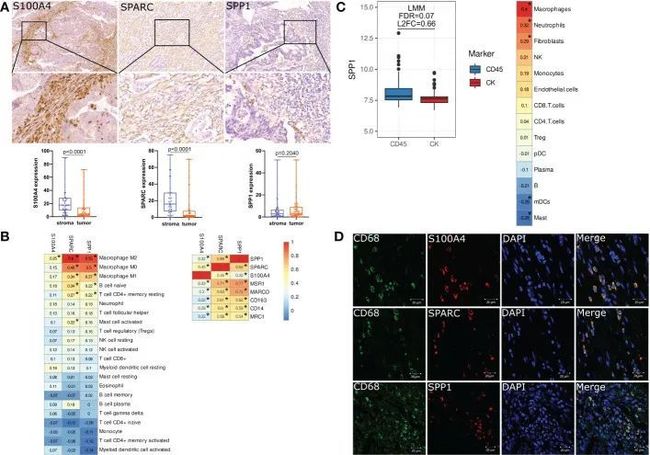
S100A4,SPP1和SPARC在人类结直肠癌组织中由肿瘤相关巨噬细胞表达
使用数字量化,作者对人类结肠和直肠癌组织进行了S100A4、SPP1和SPARC的免疫组化分析。为了提高定量分析的重复性和准确性,作者使用了两种方法来量化蛋白质表达。其中一种基于H-score,第二种包括阳性细胞的百分比。相关性分析显示,基于百分比和H-score的表达具有很强的相关性(S100A4的R=0.99;SPARC的R=0.97;SPP1的R=0.99)。此外,作者使用了蛋白质水平的百分比,因为它在统计学上更具显著性。
作者证明在蛋白质水平上,与肿瘤巢相比,S100A4和SPARC在基质组织细胞中表达更丰富[17,69 (10,03–28,65) S100A4基质 vs. 4,18 (1,31-13,93) S100A4肿瘤,p<0,0001和16,04 (7,29-29,62) 基质SPARC vs. 2,08 (0,78-7,72) 肿瘤SPARC,p<0,0001)](图4A)。SPP1在CRC组织中表达较少,并且其在基质区和肿瘤巢中的表达相等[2,93(0,63-6,67) 基质SPP1 vs. 3,31 (1,52-9,04) 肿瘤SPP1,p=0,204)(图4A)。
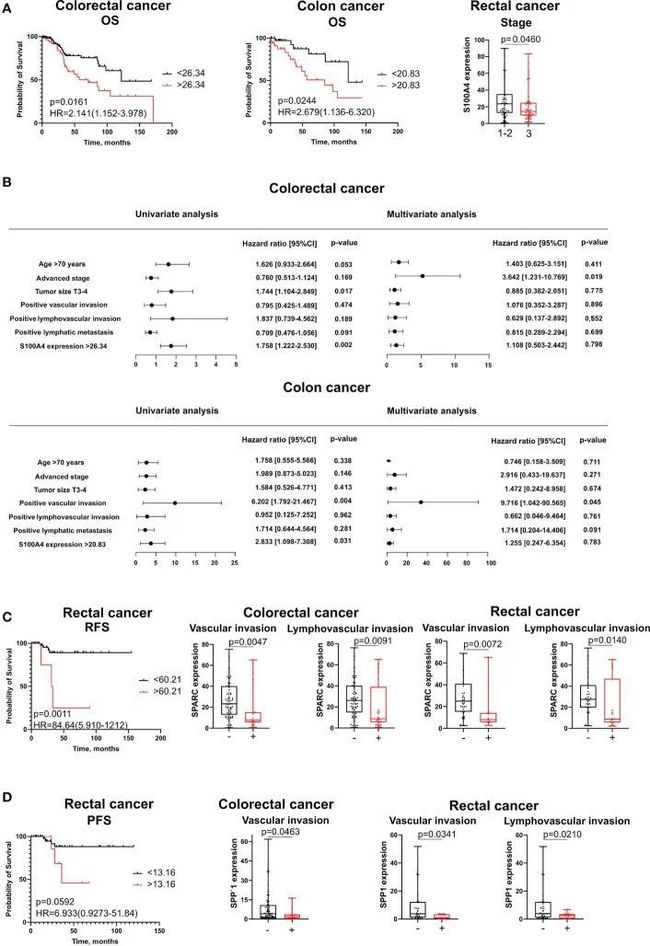
S100A4、SPARC和SPP1的基质水平对患者预后具有不利影响,但对病理肿瘤参数具有有利影响
S100A4、SPARC和SPP1的蛋白水平仍然是不利的生存参数。在单变量COX分析和Kaplan-Meier生存分析中,高风险组(表达超过截断值的意思)中S100A4的蛋白水平仅在结直肠癌患者(HR=2.141;95% CI [1.152-3.978],p=0.016)和结直肠癌患者(HR=2.679;95% CI [1.136-6.320],p=0.024)的整体结直肠癌患者组中预后仅为OS(图5A、B)。在多变量Cox分析中,S100A4 mRNA表达不是独立的参数。SPARC和SPP1的高蛋白表达与直肠癌患者的较短无复发生存期(RFS)和PFS相关(图5C、D)。然而,根据单变量和多变量Cox分析,这些参数并不具有预测价值。
新辅助化疗/放化疗逆转了S100A4的预后价值
最后,作者发现新辅助化疗(NACT)/放化疗(NCRT)可以将S100A4的活性从促肿瘤转变为有利的活性。一般而言,可以假设促血管生成因子可以诱导形成具有不同功能的血管 - 一侧对可溶性因子或免疫细胞的渗透性不同,另一侧对促进转移的癌细胞的渗透性不同(21, 22)。可以假设在治疗开始前,特定类型的血管结构对肿瘤生长有益,而一旦应用化疗,同一类型的血管结构就会转变为对患者有利的结构(23, 24)。这种效应的可能解释是化疗药物或选择性抗肿瘤免疫细胞的渗透性增强。本研究的思路基于作者最近的观察结果,即化疗可以诱导巨噬细胞的重编程,并引发血管生成相关因子表达的失调(数据未显示)。在这里,作者发现经过治疗后,与未经治疗的患者相比,接受新辅助化疗/新辅助放疗的患者的基质S100A4水平较低(29.24 ± 22.49 vs. 19.04 ± 17.97,p=0.002),表明化疗可以抑制其表达(图6A)。令人惊讶的是,对新辅助化疗/新辅助放疗有更好反应的患者,治疗后基质S100A4的表达更高(20.17(12.87,35.00)对于TRG1-2,12.78(6.31;26.52)对于TRG3-5,p=0.0438)(图6A)。新辅助化疗/新辅助放疗的反应是通过Mandard肿瘤回归分级(TRG)系统来评估的。
总结
因此,作者证明了TAM在癌症中产生的血管生成相关因子S100A4、SPP1和SPARC具有很高的预后意义。根据S100A4、SPP1和SPARC的表达水平,作者的发现有助于改善CRC患者的预后。S100A4、SPP1和SPARC可以是开发新的免疫疗法和抗血管生成治疗方法的有用靶点。