5+氧化应激+WGCNA+ceRNA+分子对接,网药纯生信也能轻松发5+?
今天给同学们分享一篇生信文章“Network Pharmacology and Bioinformatics Study of Geniposide Regulating Oxidative Stress in Colorectal Cancer”,这篇文章发表在Int J Mol Sci期刊上,影响因子为5.6。
结果解读:
丁香苷的目标网络图构建
作者分别通过Swiss Target Prediction、TargetNet、CTD(Comparative Toxicogenomics Database)和TCMSP数据库(Traditional Chinese Medicine Systems Pharmacology Database)检索到了102、473、24和7个与栀子苷相关的靶点。在合并和去重四个数据库的相关靶点后,总共获得了548个与栀子苷相关的靶点。随后,作者使用Cytoscape软件构建了栀子苷及其相关靶点的网络图,如图2所示。
基因模块的筛选和共表达网络的构建
为了确定与CRC相关的关键基因模块,作者使用WGCNA算法在健康人群和CRC患者中建立了共表达网络和模块。作者计算了GSE44076中每个基因的表达方差,然后选择了方差最显著的前25%的基因进行进一步分析。当软功率值设置为10,尺度自由R2等于0.9时,作者确定了共表达基因模块,如图3A所示。使用动态切割算法,在拓扑交集矩阵(TOM)的热图中获得了总共九个不同颜色的共表达模块,如图3B-D所示。随后,将这九个颜色模块中的基因依次应用于分析模块与临床特征(正常组和CRC组)的共表达的相似性和邻接性。此外,绿色模块与CRC之间显示出最显著的关系,其中包括5157个基因,如图3E所示。最后,作者观察到不同CRC样本中绿色模块基因之间存在正相关关系,如图3F所示。
关键基因的筛选
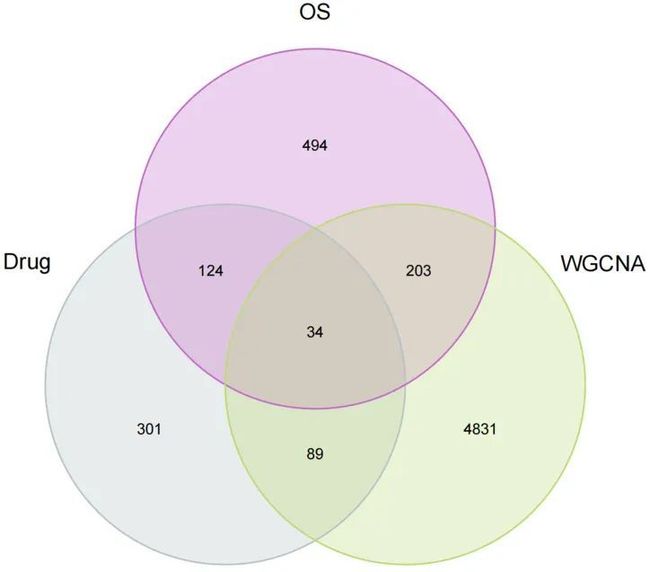
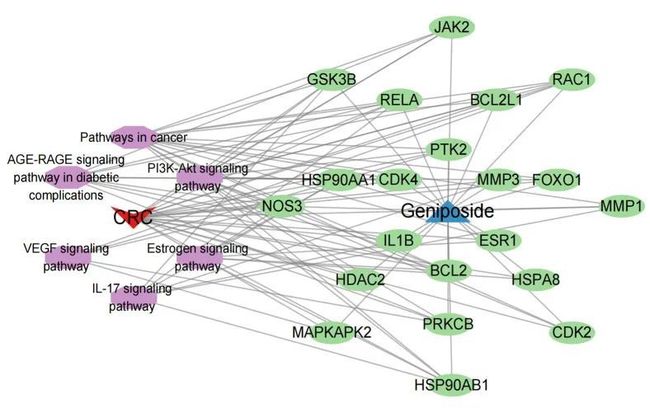
为了探索栀子苷调节氧化应激对结直肠癌的作用,作者将栀子苷的靶点与CRC中最关键的模块基因和与氧化应激相关的基因进行交叉,得到了共计34个关键基因,如图4所示,包括DNMT1、HSP90AA1、PTPN1、ESR1、PTK2、RELA、CDK4、CDK5、ADRB1、MAPKAPK2、TRPV1、CDK2、NOS3、JAK2、MIF、GSK3B、ACHE、MMP3、NR3C1、HSP90AB1、ADRB3、MMP1、BCL2、ELANE、HDAC2、RAC1、PRKCB、BCL2L1、GAPDH、HSPA8、HSPA5、CHEK1、FOXO1、IL1B。然后,作者使用Cytoscape软件构建了一个化合物-疾病-靶点网络图,如图5所示。
关键基因PPI网络构建和富集分析
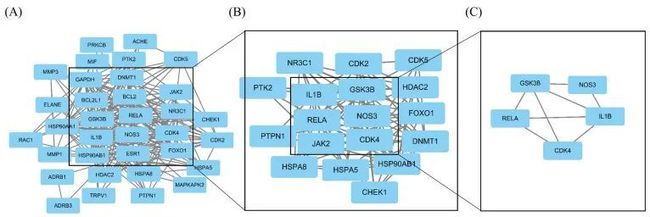
作者将上述34个关键基因导入String数据库,得到了关键基因之间的蛋白质相互作用网络,如图6所示。
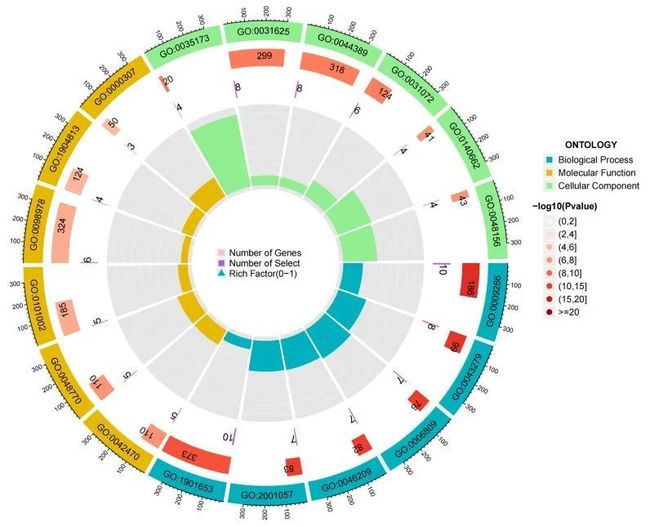
通过R语言软件的“聚类分析器”包,对调节氧化应激的34个关键基因的栀子苷抗结直肠癌的GO功能富集分析进行了研究。共获得1582个GO条目(p值<0.05),主要包括生物过程(BP)、细胞组成(CC)和分子功能(MF),如表1所示。其中,BP条目有1395个,主要涉及对温度刺激的反应、对生物碱和一氧化氮的生物合成过程等。CC条目有61个,主要与黑素体、色素颗粒、富含ficolin-1的颗粒等相关。此外,MF条目有126个,主要与组蛋白激酶活性、泛素蛋白连接酶结合、泛素样蛋白连接酶结合等相关。以上分析表明,栀子苷可能作用于这些细胞结构,影响这些生物过程,并通过调节氧化应激发挥这些分子功能,以达到抗结直肠癌的目的,如图7所示。
通过利用R语言软件的“聚类分析器”包,对34个基于丹参苷的关键基因在CRC上进行了KEGG通路富集分析。结果显示,丹参苷干预CRC的信号通路有87条(p值<0.05),主要涉及癌症信号通路、PI3K-Akt信号通路、IL-17信号通路、p53信号通路、NF-κB信号通路和NOD样受体信号通路,如图8所示。
最后,作者将复合物-疾病-治疗靶点-核心通路网络文件导入Cytoscape软件,绘制了通路网络图,更直观地展示了中药治疗CRC的活性成分的多组分-多靶点作用特征,如图9所示。
火凤燎原相关基因的筛选和相关性分析
如图10所示,作者筛选了34个关键基因,并发现当度值大于平均值时,选择了18个基因(IL1B,GSK3B,NOS3,RELA,CDK4,HSP90AB1,NR3C1,FOXO1,JAK2,CDK2,HSPA8,CDK5,HSPA5,CHEK1,HDAC2,PTK2,DNMT1,PTPN1)。如图10B-C所示,根据度值,所有前五个基因(IL1B,GSK3B,NOS3,RELA和CDK4)均大于15,被选为后续分析的关键基因。GO和KEGG的功能富集分析表明,栀子苷调节氧化应激抗结直肠癌的机制可能与细胞焦痂死有关,而氧化应激是细胞焦痂死的重要诱导方法之一。为了探索关键基因与焦痂死基因之间的相关性,作者进行了关键基因与焦痂死热点基因(IL1A,IL1B,IL18,GZMB,GZMA,GSDMB,CYCS,CHMP2B,CASP5,BAK1)的相关性分析。结果显示,IL1B,CDK4和RELA与焦痂死热点基因密切相关,如图11所示。
关键基因 ceRNA 网络构建
作者利用starBase、miRDB数据库和miRnada数据库构建了一个基于关键基因的ceRNA网络。该网络包括319个节点(5个关键基因、157个miRNA和157个lncRNA)(图12)。具体而言,共有119个lncRNA能够与miRNA hsa-miR-4318、hsa-miR-3147和hsa-miR-29a-5p竞争性结合,以调控GSK3B。在ceRNA网络中,有11个lncRNA能够与miRNA hsa-miR-495-3p、hsa-miR-326和hsa-miR-4303结合,以调控关键基因IL1B。miRNA hsa-miR-4318、hsa-miR-4280、hsa-miR-103b、hsa-miR-506-3p、hsa-miR-198、hsa-miR-568、hsa-miR-149-3p和hsa-miR-486-5p结合以调控关键基因CDK4。miRNA hsa-miR-4318、hsa-miR-4254、hsa-miR-761、hsa-miR-4297、hsa-miR-3202、hsa-miR-1303、hsa-miR-4324和hsa-miR-214-3p结合以调控关键基因NOS3。此外,还有18个lncRNA能够与hsa-miR-156-5p、hsa-miR-858-3p和hsa-miR-7-5p结合,以调控关键基因RELA。
PPI网络分析,差异表达杠杆,病理分期和Hub基因的OS分析
为了理解关键基因之间的相互关系,作者对它们进行了蛋白相互作用网络分析,如图13所示。随后,作者在GEPIA数据库中进行了差异表达水平、病理分期和生存期的分析。结果显示,CRC组中关键基因的表达显著高于正常组,p值小于0.05,如图14A所示。此外,IL1B高表达组的预后具有统计学意义,如图14B所示。病理分期显示,随着疾病进展,IL1B的mRNA水平逐渐降低,而NOS3的mRNA水平逐渐增加,如图14C所示。HPA数据库的结果显示,除了IL1B没有相应的数据外,其他关键基因在结直肠癌组织中以不同程度表达(图15)。
关键基因的免疫浸润分析
通过CYBERSORT分析了正常组和CRC组之间的免疫微环境差异。正常组和CRC组之间的免疫细胞含量差异可以在图16A、B中直观地看到。使用统计的“wilcox.test”方法比较了两组之间的差异(图16C)。嗜酸性粒细胞、巨噬细胞M0、巨噬细胞M1、巨噬细胞M2、活化肥大细胞、静止肥大细胞、中性粒细胞、浆细胞、T细胞CD4记忆活化、T细胞CD4记忆静止、T细胞CD4初级、T细胞CD8、γδT细胞、调节性T细胞(Tregs)等在两组之间存在显著差异(p值<0.05)。其中,嗜酸性粒细胞、巨噬细胞M2、浆细胞、T细胞CD4记忆静止、T细胞CD8、γδT细胞、调节性T细胞(Tregs)是CRC组中最具侵袭性的免疫细胞。M1/M2比值失衡在恶性肿瘤的形成、免疫逃逸和随后的转移治疗抵抗中具有重要意义。图16D显示了关键基因与免疫细胞之间的关系,表明关键基因与巨噬细胞M0、巨噬细胞M1和活化肥大细胞之间存在强烈的正相关,而与浆细胞、CD8 T细胞、CD4记忆静止T细胞、γδ T细胞、巨噬细胞M2、静止肥大细胞和嗜酸性粒细胞之间存在强烈的负相关。
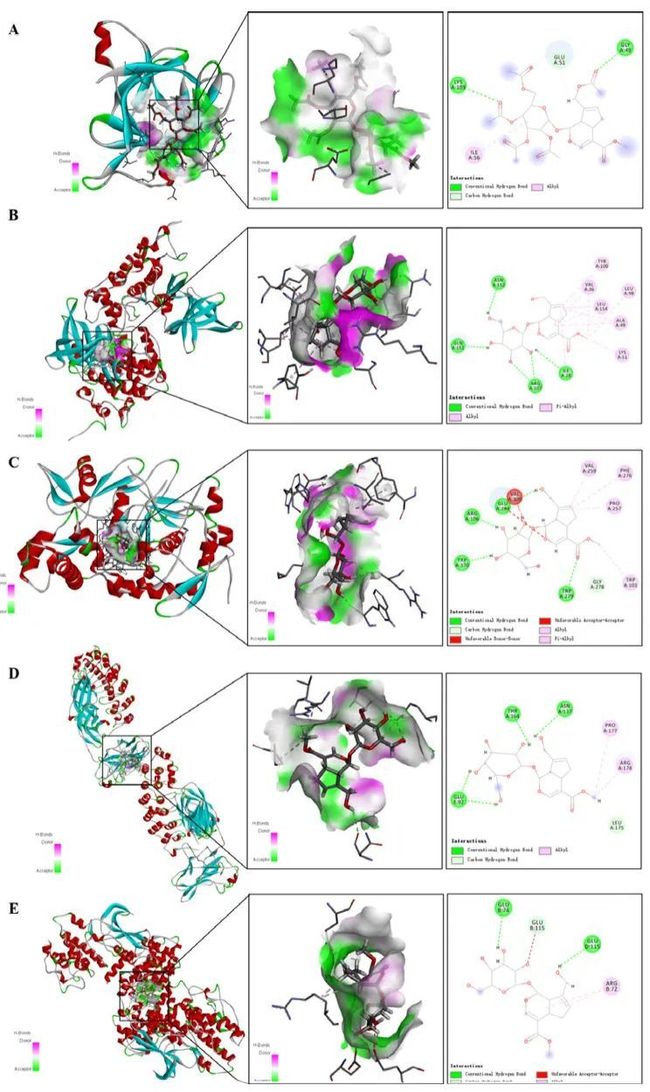
分子对接结果
IL1B_1I1B的结果:小分子与受体之间的结合能为-6.2kcal/mol,表明它具有良好的相互作用力,并主要与GLY A49和LYS A103形成氢键结合,如图17A所示。GSK3B_1J1B的结果:小分子与受体之间的结合能为-7.5 kcal/mol,表明它具有良好的结合效果。小分子主要与ASN A152、GLNA151、ARGA107、ILEA28和LYS A103形成氢键与受体蛋白相互作用,如图17B所示。NOS3_3E7S的结果:小分子与受体之间的结合能为-7.0 kcal/mol,表明它具有良好的结合效果。小分子主要与GLUA284、ARGA106、TRPA370和TRPA279相互作用,并发现明显的氢键相互作用,如图17C所示。RELA_1NFI的结果:小分子与受体之间的结合能为-6.3 kcal/mol,表明它具有良好的结合效果。小分子主要通过形成氢键和疏水键力与受体蛋白相互作用,其中包括氢键THRA164、ASNA131和GLUE92,如图17D所示。CDK4_3G33的结果:小分子与受体的结合能为-6.4 kcal/mol,表明具有良好的结合效果。小分子与受体蛋白相互作用,包括GLUB74和GLUD175形成的氢键,如图17E所示。有关栀子苷和关键基因的对接得分请参见表2。
总结
根皮苷在分子对接结果中显示出与中心基因的高结合活性。作者发现五个中心基因的mRNA水平在CRC组织中显著表达,并且ILIB的预后价值显著不同(p值<0.05)。随着病理分期的演变(从I期到IV期),IL1B的mRNA表达逐渐减少,而NOS3的mRNA表达逐渐增加。以上分析结果基本与文献报道一致。