原文链接
1,首先NMN是什么?
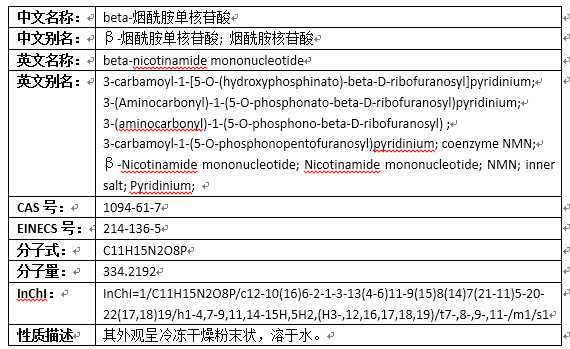
@张益豪 大佬说的很对,NMN是烟酰胺单核苷酸Nicotinamide mononucleotide的简称,更详细的信息是:
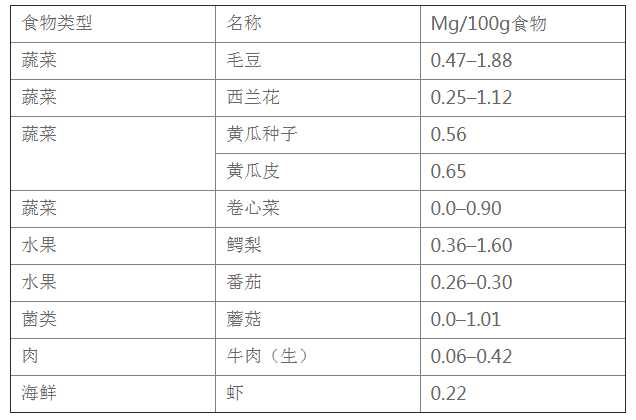
也就是NMN根本不是什么新鲜的东西,化学式什么的研究的很充分了,事实上在很多蔬菜水果中都存在的,有篇Cell对富含NMN的一些蔬菜和水果进行了测定:
常见食物NMN含量
数据来源:a href='http://www.cell.com/cell-metabolism/fulltext/S1550-4131(16)30495-8'> Long-Term Administration of Nicotinamide Mononucleotide Mitigates Age-Associated Physiological Decline in Mice.Cell Metabolism, v.24, no.6, 2016 Dec 13, p.795(12)
2,其次NMN有啥用?
NMN是NAD 的前体,其功能也主要通过NAD 体现,额,好吧,又要解释NAD ,NAD 是辅酶I,是上千种反应的辅酶,为啥叫辅酶1,不是辅酶3456,也能看出其重要性。关于NMN的逆龄啊,抗衰老啊,其实都是在围绕NAD 展开。因为NAD 是上千种反应的辅酶,所以其功能也是方方面面,我就捡几条比较重要的说一下,然后放个表供大家查阅,参考问下也会放后面,欢迎各位生化大佬调阅。
A. 提供能量
NAD 是三羧酸循环的辅酶,三羧酸循环就不用说了吧?人体95%的能量来源,NAD 对线粒体和细胞核的交流也发挥作用,线粒体嘛,生物体能量发动机。放图放图,就可以看出NAD 的作用:
B. 预防各种年龄相关的衰退
NMN修复DNA、激活长寿蛋白啊(PS,白藜芦醇只能激活长寿蛋白sirtuins1,NAD 可以激活长寿蛋白sirtuins1~7),主要机制是NAD 是三个消耗酶(PARP、cADPR和Sirtuins)的唯一底物,这这部分有点晦涩,不展开了,大家可以扒一扒下面的下面cell、nature的一些研究。
C. 关于逆转衰老
这部分大家都比较关心,是哈佛医学院抗衰老中心主任David Sinclair的一些在Science的一系列研究。直接放视频吧。放了三次视频给我删了,手动滑稽。。。。核心机制是激活Sirtuins17和DNA修复酶PARP~想要看视频的腾讯视频上搜吧,我传上去了
D,NMN功能概览
NAD 作为上种反应的辅酶,功能有很多。将相关功能贴过来~
3,补充NAD 的方式
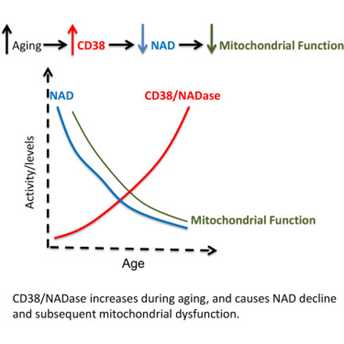
如果NMN真如2所说的那样有用(事实正是如此,后面会实例说明),那么如果补充NAD 呢?事实上NAD 随年龄增加降低,机制是CD38对NAD 的消耗增加(CD38 Dictates
Age-Related NAD Decline and Mitochondrial Dysfunction through an
SIRT3-Dependent Mechanism)这个可以回答 @张益豪 的机制问题。
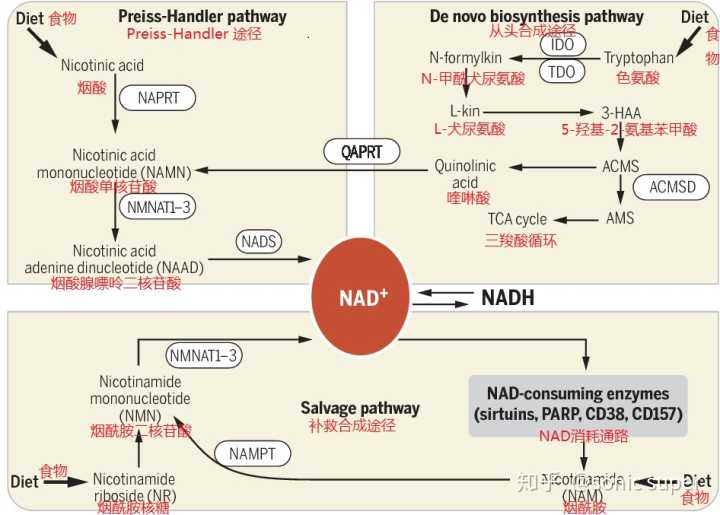
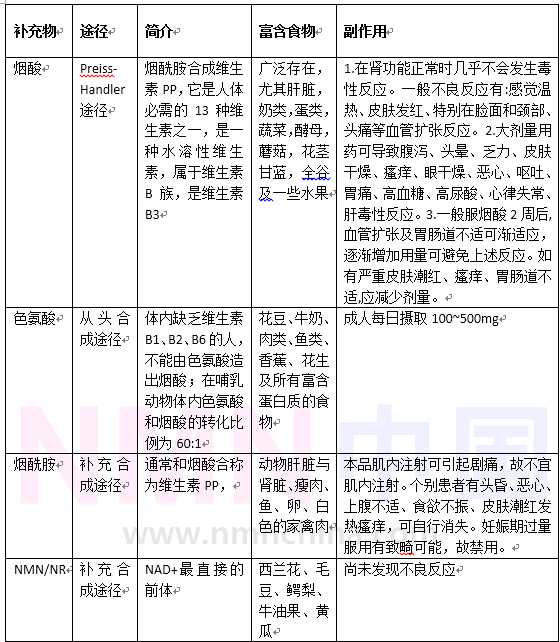
如何补充NAD 就需要了解NAD 的代谢途径,NAD 在体内有3个代谢途径,四类物质可以最终转变成NAD 。
A. Preiss-Handler途径
19571958年由Preiss及Hsndler发现,因此命名为Preiss-Handler途径。该途径从烟酸开始,经过烟酸磷酸核糖基转移酶(NAPRT)催化变成烟酸单核苷酸,经过NMNATI13酶的催化,变成烟酸腺嘌呤二核苷酸,然后再被催化成NAD 。
B. 从头合成途径
该途径又叫犬尿氨酸途径。从食物中摄取的色氨酸开始,依次经过N-甲酰犬尿氨酸、L-犬尿氨酸、5-羟基-2-氨基苯甲酸、ACMS后变成喹啉酸,然后喹啉酸进入Preiss-Handler途径。色氨酸转成N-甲酰犬尿氨酸的IDO和TDO途径是从头合成途径的限制性步骤,ACMS也可以进入三羧酸循环。
C. 补救合成途径
NAD 经过三个消耗途径(sirtuins, PARPs, and the cADPR )后变成烟酰胺,然后经过NAMPT催化后,变成NMN,NMN同样通过NMNAT1~3酶的催化转变成NAD 完成循环。有研究表明补救合成途径产生NAD 占人体NAD 总量的85%,补救合成途径中NAMPT酶是这个循环的限制步骤。
总结:
NAD 的含量在这三个独立途径下保持平衡,补救合成途径是人体NAD 主要来源。NAD 会在一个75kg的成年人体内重复合成2~4次达到3g的水平。(NAD metabolism:
Bioenergetics, signaling and manipulation for therapy (Yang, 2016))
可见补救合成途径占到NAD 生成量的85%,从补充NAD 的角度来看,有四类物质可以备选:烟酸、烟酰胺、色氨酸、NR/NMN。其中烟酸是维生素B3,烟酸和烟酰胺又称维生素PP,喝红牛和其他功能性饮料的朋友一定对烟酰胺不陌生的,爱美的妹子对烟酰胺也很熟悉,SKII、Olay小灯泡了解一下。
从Preiss-Handler和从头合成途径的角度讲,补充烟酸和色氨酸如何呢,,烟酸(NA)和GPR109A的结合会导致患者严重的潮红,而过多的摄取色氨酸、烟酰胺也会存在副作用。(Nicotinic acid, nicotinamide, and nicotinamide riboside: a molecular evaluation of NAD precursor vitamins in human nutrition.Bogan KL, Brenner C Annu Rev Nutr. 2008; 28():115-30.)烟酰胺(NAM)会造成对Sirtuins的抑制从而引起肝脏中毒。( Resistance Exercise Training Alters Mitochondrial Function in Human Skeletal Muscle)
这也正如 @Yuriko 大佬说的那样,维生素这种微量高能的物质是不要随便乱加的,所以 @张益豪 大佬说的多吃卫生素B3并不是补充NAD 的好手段,一是有副作用,二是Presiss-Handler途径补充的NAD 可能不占NAD 总量的15%。多吃肯定会增加NAD ,但是会有其他潜在影响以及效率会打折扣。而烟酰胺是从补救合成途径补充的NAD ,但是烟酰胺也是有副作用的,更为关键的是NAMPT是补救合成途径的限速酶,补充的烟酰胺无法绕过这个瓶颈。
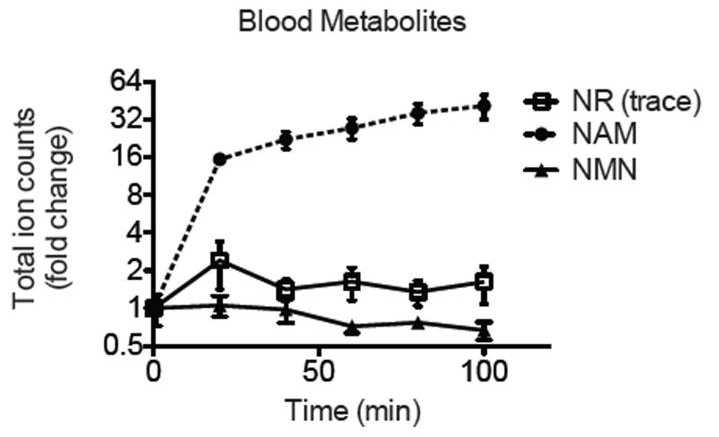
综上所述,补充NR和NMN是个不错额选择!但是NR口服后会被消化成烟酰胺,emmmm,又回到最初的起点,呆呆地站在镜子前,emememe
来源:Loss of NAD Homeostasis Leads to Progressive and Reversible Degeneration of Skeletal Muscle (Fredrick 2016)
综上,NMN是补充NAD 最理想的方式。
4,其他相关问题
NMN在日本美国都有销售,大家自行某宝某亚马逊感受一下,3000mg的量三四千了,这个不大现实的~~~~真正实现大规模产业化的也就香港一家,酶法做的,9000mg的量价格不到日本同等当量的十分之一。
其他未尽问题,我有篇NMN的review,投决会的材料,由于知乎老说我做广告,想看的私我好了~~~
关于效果,除了Nature/Cell/Science上的研究外,NMN已经供给哈佛医学院进行NASA火星探测宇航员DNA修复研究我身边人用了反馈都还不错,一开始解决这项目的时候,觉得这玩意有用么,还挺好奇的,过年给二老带了两瓶,我妈妈经常半夜醒的毛病好了(有文章介绍NMN对生物中的调教和改善作用,事实上色氨酸本身就是助水睡眠的药物,BTW 色氨酸只有在维生素B2和B6存在下才能转变成NAD ).然后我身边有老年痴呆家族史的吃了反馈记忆力提升了,然后同学妈妈化疗午睡时间从三小时到半小时
截图已删,省的又一堆人给我墨迹~
PS:
有好的医药、医疗、新能源、新材料项目,请私信我!!!不一定懂你的项目,但是学的一定认真!!!可以在科学层面上和你交流,come on,baby!
啊
[1] NAD and sirtuins in aging and disease (Imai, 2014)
[2] Declining NAD Induces a Pseudohypoxic State Disrupting
Nuclear-Mitochondrial Communication during Aging (Gomes, Sinclair,2013)
[3] un Li,
Zhenkun Lou, Vera Gorbunova, L. Aravind, Clemens Steegborn, David A. Sinclair.
A conserved NAD binding pocket that regulates protein-protein interactions
during aging. Science 355:1312,(2017)
[4] Mouchiroud L., Houtkooper R.H., Moullan N., et al.. The
NAD /Sirtuin pathway modulates longevity through activation of mitochondrial
UPR and FOXO signaling. Cell 154: 430-441 (2013).
[5] Nicotinamide Mononucleotide, a Key NAD Intermediate, Treats the
Pathophysiology of Diet- and Age-Induced Diabetes in Mice (Yoshino, 2011)
[6] Head to Head Comparison of Short-Term Treatment with the NAD( )
Precursor Nicotinamide Mononucleotide (NMN) and 6 Weeks of Exercise in Obese
Female Mice (Uddin, 2016)
[7] Evidence for a direct effect of the NAD precursor acipimox on
muscle mitochondrial function in humans. van de Weijer, T., Phielix, E., Bilet,
L., Williams, E.G., Ropelle, E.R., Bierwagen, A., Livingstone, R., Nowotny, P.,
Sparks, L.M., Paglialunga, S. et al. Diabetes. 2015; 64: 1193–1201
[8] Nicotinamide mononucleotide attenuates brain injury after
intracerebral hemorrhage by activating Nrf2/HO-1 signaling pathway (Wei, 2017)
[9] Nicotinamide mononucleotide protects against β-amyloid
oligomer-induced cognitive impairment and neuronal death (Wang, 2016)
[10] Nicotinamide mononucleotide inhibits JNK activation to reverse
Alzheimer disease (Yao, 2017)
[11] Nicotinamide
mononucleotide, an intermediate of NAD synthesis, protects the heart from
ischemia and repercussion (Yamamoto, 2014)
[12] .
Nicotinamide mononucleotide, an intermediate of NAD synthesis, protects the
heart from ischemia and repercussion
[13] Nicotinamide mononucleotide supplementation reverses vascular
dysfunction and oxidative stress with aging in mice (de Picciotto, 2016)
[14] Short-term
administration of Nicotinamide Mononucleotide preserves cardiac mitochondrial
homeostasis and prevents heart failure (Zhang, 2017)
[15] Nicotinamide mononucleotide requires SIRT3 to improve cardiac
function and bioenergetics in a Friedreich’s ataxia cardiomyopathy model
[16] Samuel W.French. Chronic alcohol binging injures the liver and
other organs by reducing NAD⁺ levels required for sirtuin's deacetylase
activity. Experimental and Molecular Pathology 100:303-306(2016)
[17] NAMPT-mediated
NAD biosynthesis is essential for vision in mice (lin, 2016)
[18] Brown
KD, Maqsood S, Huang JY, Pan Y, Harkcom W, Li W, Sauve A, Verdin E, Jaffrey SR.
Activation of SIRT3 by the NAD( ) precursor nicotinamide riboside protects from
noise-induced hearing loss. Cell metabolism. 2014;20:1059–1068