转发自http://crickcollege.com/news/172.html
写在前面
从10月底开始,由克里克学院与康昱盛主办的蛋白质组学网络大课堂正式开班了!整个课程由21堂大课组成。作为蛋白质组学纯小白一枚,小编也打算借这个机会好好学习感受一下。继第一讲“蛋白质组学研究方法概述”以后,小编继续整理了第二讲“蛋白质谱实验样品前处理”的听课笔记,分享给各位。
授课老师
这次课程的授课老师是来自复旦大学生物医学研究院的刘晓慧博士。复旦大学生物医学研究院杨芃原老师实验室是中国蛋白质组学领域综合实力最强的团队之一,刘晓慧老师就是在这里获得了她的化学生物学博士学位,并在杨老师实验室工作十余年。作为实验室的骨干力量,她拥有非常丰富的蛋白质谱实验技能与经验,并从事基于生物质谱的蛋白质和多肽定量方法的应用和开发,精通iTRAQ、MRM、MRM-HR、SWATH等相关技术,参与发表相关论文30余篇。刘老师在授课中详细分享了她在蛋白质谱实验样品前处理方面多年积累的珍贵经验与心得,这样的学习机会实属难得!
(文中所有图片均来自刘晓慧博士的讲义,并获得发表授权。)
这节课呢,刘老师讲了三个部分的内容:
--样品前处理需要达到的目的
--不同类型的样品提取方法及进展介绍
--不同预分级策略介绍
虽说第三部分“不同预分级策略介绍”应该是属于LC-MS那部分的前处理步骤,刘老师也选择在这节课上一起介绍了。那么,请大伙儿跟着小编,一起来梳理一下这节课的内容精华吧!
样品前处理目的
首先,我们来问一个问题:为什么要进行样品的前处理?
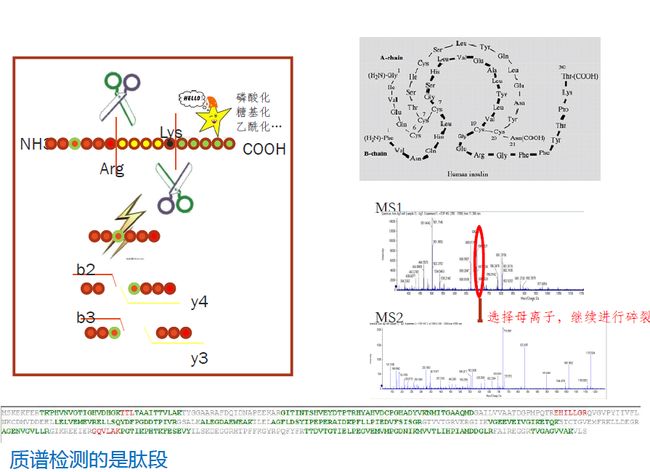
上面的图描述了整个蛋白质组学的分析流程:咱们先从组织、体液或细胞中提取蛋白质,拿到蛋白混合溶液(根据你的研究目的,可以对蛋白先做分离,或者不分离),接下来还原烷基化(还原的过程是将蛋白的二硫键打开,然后烷基化可以修饰巯基,防止游离的巯基再生成二硫键)处理,并酶解成肽段。红线以上都属于样品的制备阶段。
既然蛋白质谱实验的目的,是为了尽可能准确地对尽可能多的蛋白进行检测,那么,顺理成章的,我们为什么要做这些复杂的前处理呢,就是要减少在实验阶段对蛋白的人为降解和修饰,释放尽可能多的肽段,送进质谱来检测,对吧?
为了更好地聊这个问题,我们先来复习一下如何利用质谱检测蛋白质,以此来反推前期样品处理需要达到怎样的目的。
拿到处理好的蛋白样品以后,我们先将样品酶解成肽段,得到一级谱图,再由肽段离子与惰性气体碰撞生成碎片离子,得到二级谱图。然后我们用实验谱图与理论谱图进行匹配,从而判断肽段的氨基酸组成,然后再根据肽段反推出蛋白质。
上图的最下面是是数据库里搜索的序列,绿色部分是置信度在95%以上的肽段,红色是置信度在50%以上的肽段。基于这些置信度比较高的肽段,我们才能推断出这个蛋白存在于样品中。所以,对于每个蛋白质来说,根据实验谱图匹配到的肽段越多,对于这个蛋白的鉴定结果就越可信。
那么,样品预处理时,首要目的就是避免随机降解,才能得到用特定蛋白酶特异性剪切得到的肽段,拿这些肽段生成的实验谱图与理论谱图比对,才能得到可靠的比对结果。否则,蛋白的随机断裂位点与特异性酶切位点根本对不上,那拿到的实验谱图与理论谱图完全就是两回事,最后的结果就是,要么检测不到蛋白,要么检测到的都是错的。
样品的收集与保存
样本预处理之前,我们需要先收集和保存样品。这一步可不能马虎,如果收集的方法或者保存的方式不得当,就会严重影响后面的预处理步骤以及实验结果!以下三类样品的收集与保存尤其需要留意:
--组织样品:1)对于人体手术切除的组织,有条件的话,最好用PBS(磷酸缓冲盐溶液,作为溶剂,起溶解保护试剂的作用)取完之后直接去血。如果没有去血,可以-80℃液氮保存,干冰运输。
2)对于小鼠、大鼠、兔子之类的组织样品,建议用灌流的方式来去血,尤其是像肝脏、胃、心脏这类大的组织,可以直接用灌流的方式去血,去得最干净。其次的方案是在后期剪碎的时候去血。
话说,这里为什么要强调去血呢?因为血液中有十几种含量特别高的高丰度蛋白质,占了血液蛋白总量的95%,如果你的研究目标并不包括血液蛋白,而这部分蛋白又存在于样品中,那就悲剧了。大家回忆一下,我们第一节课的听课笔记中专门提到的数据依赖性采集(DDA),当样品中有大量高丰度蛋白的时候,来自中低丰度蛋白的肽段信号就会被大大抑制,连进入二级质谱的机会都会变得很渺茫,还怎么愉快地检测?
--细胞样品:常规实验,建议收到5*1E61E7个细胞以上的样品量(有些实验需要的样品量会少一些,后面会详细讲)。细胞取好后,首先用PBS清洗一下细胞表面,因为大部分培养基里面都含有血清,这部分血清得洗干净了先
如果是做分泌蛋白研究的话,首先用PBS清洗样品几次,再用条件培养基(不含有血清的培养基)进行培养,根据细胞情况,大概12个小时以后,离心,去掉细胞碎片,取上清,就能提取到分泌蛋白了。
--血清样品:1)血浆样品:可以通过医院常用的EDTA抗凝管进行收集,收集到的血浆会呈悬浮状态,离心去掉血细胞。
2)血清样品:现在大部分研究都直接针对血清样品,它的成份更简单,没有凝集素,没有大量的血细胞,针对性会更强。收集血清样品时,直接把血清吸到管子里,室温静置让它凝结,上清黄色部分就是血清样品啦。
好,我们收集好样品后,接下来就开始做样品前处理了。它分几步走呢?看下图:
后面会详细聊每一步,这里我们先做点儿背景铺垫,大伙儿心里先有个谱:
铺垫之一:第二步“充分溶解蛋白”尤为重要,如果蛋白没有充分溶解,能提取到的蛋白就会很少,达不到研究目的。
铺垫之二:在第一、二步,即破碎样品和溶解样品的过程中,为了减少人为操作引入的修饰,通常会准备大量的冰,进行冰上的操作。同时还需要加入蛋白酶抑制剂,防止在操作过程中蛋白被样品中自带的蛋白酶降解掉。
说到样品中自带的蛋白酶,尤其要高度重视的是胰腺样品,如果你在室温下解冻,整个样品可以直接化成水。胰腺本身含有非常丰富的胰蛋白酶,在体外的室温环境下,胰蛋白酶的活性没有谁来抑制它,于是可以完全释放天性,把组织样品里的蛋白都分解掉了!所以针对胰腺样品,要非常小心,必须在冰上操作,利用低温环境控制蛋白酶的活性。
铺垫之三:关于第三步“解旋蛋白质”。通常,蛋白质都是成球状的稳定状态,解旋蛋白质就是将球状蛋白中的二硫键打开,让它形成链状结构,以便进行下一步酶切。以下图胰岛素结构图为例,胰岛素分子通过很多二硫键形成稳定的球状结构,亲水基团主要集中在表面,而疏水基因都包裹在里面,如果用特异性酶直接作用于这些球状蛋白,包裹在里面的序列就不容易被酶作用到,酶切的效率就会很低~
如果能将这些二硫键打开,球状结构被破坏,蛋白分子就会变成链状,酶切位点才能尽可能多地暴露在酶环境里,这时候我们再加入特异性酶,就能得到更多的酶解肽段。
铺垫之四:对于第五步去除杂质,其实伴随着整个预处理的过程。杂质都是从哪里来的呢?比如,从组织中带来的杂质,提取溶液、酶解样品中带来的盐等。我们要知道,质谱是一个非常灵敏的仪器,它检测的是多肽的质荷比。所有的盐类,以及所有会进行离子化的杂质,都会干扰到肽段的检测。所以我们会要求进入质谱之前的蛋白样品非常干净。在蛋白水平及肽段水平都会进行去除杂质的步骤。
样品的破碎
好,接下来我们就从破碎样本开始,详细聊聊每一步具体应该怎么做,需要用到哪些方法、工具和试剂,以及操作的技巧和需要注意的那些小细节。
第一步 破碎样品
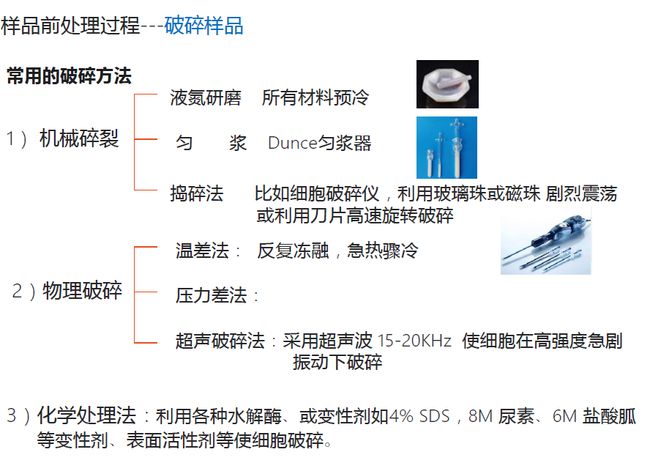
样品破碎的方法主要分三类:
1、机械碎裂:简单粗暴,把组织研 碎,比如骨骼组织,强体力活!
1)液氮研磨:适用于大部分组织样品,比如常见的胃脏样品、肠样品、肝脏样品等。把所有的器皿、研钵,以及样品,都放到-80℃环境下,然后把样品放到研钵里,倒入液氨,整个样品会冻得非常脆,然后就大力研磨,直到磨成粉末;
2)匀浆:适用于亚细胞器的破碎,使用Dunce匀浆器。注意哈,匀浆没有液氨研磨那么剧烈,除亚细胞器以外的蛋白提取,通常还是建议用液氨研磨,破碎得更充分一些。
3) 捣碎法:用研磨的方法破碎样品,如果样品量又大,那可是件非常辛苦的事情!于是一些公司推出了细胞破碎仪,利用玻璃珠或者磁珠剧烈地震荡,或者用刀片高速旋转,总之,用电力代表人力,帮助我们做样品破碎。
2、物理破碎:靠足够大的温差、压力差等方法,导致细胞膜破裂
1)温差法:通常用于含有细胞壁的样品,比如一些细菌样品,利用高温和低温的反复变化,破坏细胞壁。
2)压力差法:适用于组织样品,通过高压和低压的反复变化,实现对组织样品的破碎,
3)超声破碎法:适用于细胞层次的样品
3、化学处理法:使用各种水解酶、变性剂或表面活性剂等,破碎细胞的膜结构,导致细胞的破碎。
事实操作中呢,我们通常会将几种方法结合起来使用。比如先液氨研磨,拿去提取蛋白,检测一下蛋白含量,发现破碎不够充分,于是又再用超声的方法,或者结合比较强的变性剂的方法等等,增强样品破碎的程度,释放更多的蛋白。
说到化学处理法,我们来看看样品前处理中会用到哪些抽提试剂吧。
上面列出的一些重要的试剂,我们来详扒一下:
1) 8M尿素:这是比较强的变性剂,有时也会用6M尿素。
需要注意的是,在加入8M尿素以后,所有处理过程不能超过37℃,否则会将蛋白质的氨基胍基化,影响蛋白质的理化性质,影响后续的酶解,以及质谱检测,后果很严重!另外,如果这一步你用了8M尿素,后面又要用胰酶来做酶解,那么加入胰酶之前,一定要先将尿素稀释到1M,否则高浓度的尿素会让胰酶也变性,失去活性。
2) 硫脲:能起到助溶的效果,也是一种还原剂,它的还原性与一些试剂盒是不兼容的,比如BCA试剂盒。
Tips: 处理过程中,我们要注意每一步的溶剂是否与下一步的溶剂兼容(兼容的意思就是,能不能一起使用)。根据它们的兼容性来进行选择。
3) 4%SDS:很强的去污剂,但与胰酶不兼容,并且很难通过超滤的方法脱去的,它在超滤脱盐的过程中仍保留在蛋白样品中间。对于这类去污剂,我们通常会利用有机溶剂来去除它们,比如丙酮沉淀。
Note: 这些去污剂,在样品进入质谱前都要去除干净,否则它们会在质谱的电场下离子化,影响我们的分析。因此呢,去污剂要慎用!
4) 还原剂:功能是打开二硫键,使蛋白分子尽量从球状变成链状,增加蛋白质的溶解性,以及暴露出尽可能多的酶切位点。
5) 蛋白酶抑制剂:夏天尤其需要,当温度比较高的时候,酶的活性也会较高,蛋白样品很容易发生自降解。如果做特殊样品的处理,比如磷酸化样品或其它翻译后修饰样品的富集,要针对性地加入这一类酶的抑制剂。
6) 有机试剂:用来沉淀蛋白质,去除杂质。比如前面提到的去污剂,我们就可以利用有机试剂来去除它们;另外,针对植物样品或昆虫样品,样品本身含有很多色素,比如叶绿素,昆虫翅膀上的色素等,也可以用有机试剂将色素溶解掉,然后进行洗涤。
特别注意:整个处理过程中,所有使用的EP管、枪头、装试剂的塑料瓶,都尽量用进口的产品,尤其是当使用到强溶解性的溶液!国产的EP管上的材料(聚乙二醇)很容易被这些溶液洗脱下来,进入样品中,并且很难洗脱掉。而聚乙二醇非常容易离子化,会在质谱里形成很强的塑料峰,甚至会完全掩盖目标肽段的峰,造成检测的失败!
刘老师讲课的内容,小编今天先分享到这里,下次我们继续聊针对不同样品的蛋白提取方法、提取完的质量控制等部分,敬请期待哦!