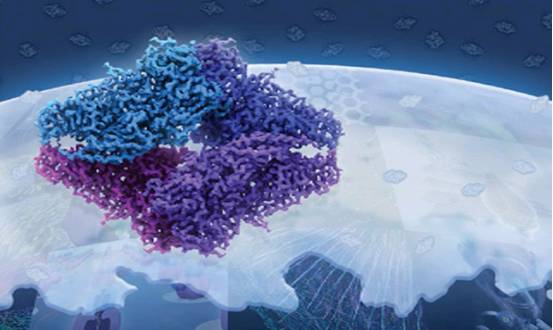
导语:
每年的岁末年初,《自然》杂志旗下子刊《自然·方法》(Nature Methods)都会盘点当年的年度科学技术。2015年最受关注的技术为冷冻电镜技术(cryo-EM),此前呼声很高的CRISPR/Cas9基因编辑技术未能折桂。
在冷冻电镜的这场技术革命中,华人科学家功不可没,在某些方面甚至独领风骚,做出了诸多重大成果。
文 |张凯(剑桥大学MRC分子生物学实验室博士)
●●●
细胞里面的生命活动井然有序,每一个部分都有其特定的结构,承担不同的功能。生物大分子则是一切生命活动的最终执行者,它们主要是核酸和蛋白。核酸携带了生命体的遗传信息,而蛋白是生命活动的主要执行者。自现代分子生物学诞生以来的半个世纪里,解析和分析生物大分子的结构、进而阐释其功能机制一直都是现代生命科学的核心问题之一。
事实上,一切自然科学都涉及物质结构及结构间的相互作用为核心的研究方向,天文学研究宇宙、星体等的结构及其相互作用,粒子物理研究物质世界的基本粒子的结构和相互作用,甚至包括应用性很强的材料科学都是以研究新型材料的结构和性质等为核心。结构生物学研究的直接目的是弄清楚生命大分子结构,从而更好地理解生命,理解这个自然界中“逆热力学第二定律”而诞生的奇迹;最终目标是公众通常关心的实用价值。
像数学物理公式不会直接造出飞机、导弹、计算机一样,蛋白质结构这样的基础研究不会直接转化为人们生产生活的必须物品。比较具体的应用,如药物设计、疫苗开发、医疗诊断和蛋白质分子性能改造(如科学实验或工业生产中酶活性稳定性优化)等是蛋白质结构研究比较容易被大众所理解的一个方向,但却只是其研究价值的一个侧面而已。
蛋白质结构如同生命科学里的数学公式和物理定律,甚至在以后会充当生命科学里面的“化学元素周期表”,除了帮助发现或设计新药等,它更重要的价值是作为最基础最上游的研究之一,通过影响一切与其密切相关的下游科学和技术,从而改变我们的世界。
结构生物学最早诞生于上个世纪中叶,它是一门通过研究生物大分子的结构与运动来阐明生命现象的学科,在其发展史上有两个里程碑式的事件,一个是DNA双螺旋结构的发现,另一个肌红蛋白(Myglobin)晶体结构的解析,这两个事件都是上个世纪最重要的革命性科学进展,均在剑桥MRC分子生物学实验室完成,并且都于1962年获得了诺贝尔奖(一个生理学或医学奖,一个化学奖)。同时它们都是最早使用X射线的方法来解析生物大分子结构,而这个方法在过去半个世纪里,一直占据结构生物学的统治地位。
在当今结构生物学研究中普遍使用的冷冻电镜,是上个世纪七八十年代开始出现、近两年飞速发展的革命性技术,它可以快速、简易、高效、高分辨率解析高度复杂的超大生物分子结构(主要是蛋白质和核酸),在很大程度上取代并且大大超越了传统的X射线晶体学方法。
革命性的冷冻电镜技术
冷冻电镜并不是这两年才建立的。在蛋白质X射线晶体学诞生大约10多年以后的1968年, 作为里程碑式的电镜三维重构方法,同样在剑桥MRC分子生物学实验室诞生,Aron Klug教授因此获得了1982年的诺贝尔化学奖。另一些突破性的技术在上世纪70年代和80年代中叶诞生,主要是冷冻成像和蛋白快速冷冻技术。这里面的代表科学家有Ken Taylor, Robert Glaeser和Jacques Dubochet等。
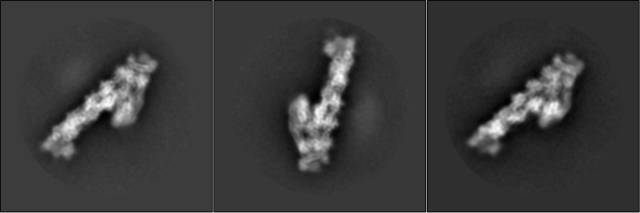
快速冷冻可以使蛋白质和所在的水溶液环境迅速从溶液态转变为玻璃态,玻璃态能使蛋白质结构保持其天然结构状态,如果以缓慢温和的方式冷冻,这个过程会形成晶体冰,生物分子的结构将被晶格力彻底损坏。低剂量冷冻成像能够保存样品的高分辨率结构信息,确保了从电镜图形中解析蛋白质结构的可能性。与此同时Joachim Frank等则在电镜图像处理算法方面奠定和发展了这项技术的理论基础。由此冷冻电镜的雏形基本建立,总的思路为:
1)样品冷冻(保持蛋白溶液态结构);
2)冷冻成像(获取二维投影图像);
3)三维重构(从二维图像通过计算得到三维密度图)。
该方法为生物大分子结构研究提供了一个和X射线晶体学完全不一样的、全新的思路。但是由于技术方法的瓶颈,在此后30多年的时间里只能做一些相对低分辨率的结构解析工作,在分辨率上一直不能和X射线晶体学比较,甚至一度被嘲笑为”blob-ology“(英文讽刺语,“一坨轮廓的技术”)。
但对于冷冻电镜来说,技术难点远非单纯冷冻。冷冻成像和图像处理算法一直都是瓶颈。从冷冻电镜技术诞生以来的近30年时间里,其一直都有进展,只是相对比较缓慢。
最重要的革命性事件大约发生在两三年前:一个是直接电子探测器的发明,另一个是高分辨率图像处理算法的改进。MRC分子生物学实验室的两位科学家Richard Henderson和Sjors Scheres在这次革命中起了关键作用(作者注:现代科技革命往往是诸多研究机构若干团队共同参与,此处仅列举关键代表,并且仅从技术角度讨论,不涉及生物学应用)。
Richard Henderson是探测器方面的先驱,而Sjors Scheres则因他设计的Relion程序而名声大噪,他们由此当选为《自然》杂志2014年“十大科学进展年度人物”。两位科学家一个从硬件,一个从软件将冷冻电镜技术推向了巅峰,将冷冻电镜技术的分辨率推向了新高度。(作者注: Henderson教授的贡献远非探测器一个方面,包括冷冻电镜理论基础、算法、软件,重要生物大分子应用,如曾首次解析视紫红质跨膜螺旋等等方面;早在20多年前,他就通过一系列理论分析,预言了冷冻电镜研究的尺度、分辨率极限、技术瓶颈等等,并且断言:冷冻电镜将超越其它一切技术方法,成为蛋白质结构研究的主导工具,如今这些预言全部应验。)
和此前使用的CCD相比,新发展的直接电子探测器不仅在电镜图形质量上有了质的飞跃,同时在速度上大幅提高,还可以以电影的形式快速记录电镜图像。这些特性同时也伴随着电镜图像处理方面的重大变革,电镜技术此前在分辨率上的一个主要瓶颈是电子束击打生物样品造成的图像漂移和辐射损伤。有了快速电影记录,我们就可以追踪图像漂移轨迹而对图像做运动矫正和辐射损伤矫正,大大提高数据质量。
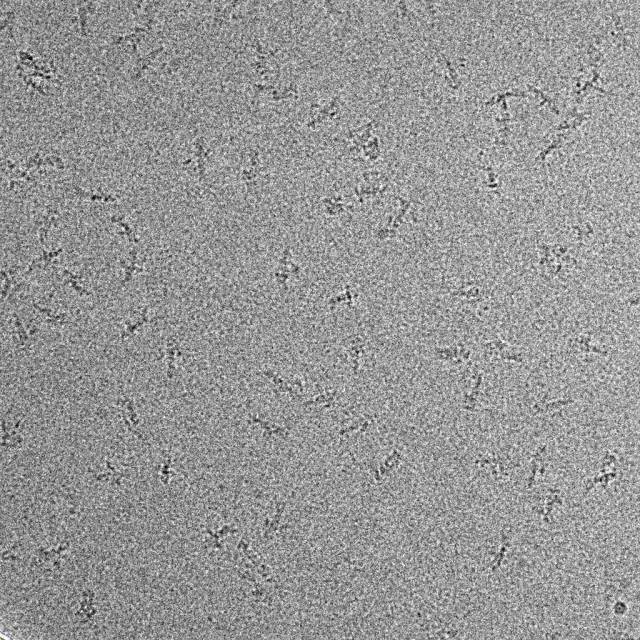
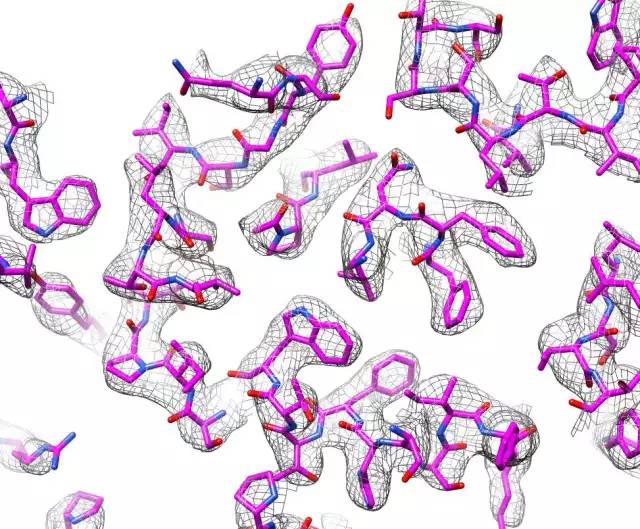
尽管如此,电镜图像处理一直都是一项极具挑战性的任务,主要的问题是冷冻电镜的图像噪音极高、信号极低,而我们的目标是从中提取近原子分辨率的结构信息,这就像在一个机器轰鸣的工厂里监测一只蚂蚁爬行的声音。冷冻电镜科学家就是要完成这项艰巨的任务,并且真的做到了。有了硬件和软件方面的双重提高,冷冻电镜的分辨率目前已得到了极大的提高,可以和晶体学相媲美;并且在其它方面已经大大超越了晶体学。
主要体现在下面几个方面:
第一,不需要结晶,研究对象范围大大扩展,研究速度大大提高。对于小分子,比方说无机盐矿物质等自发就能长出晶体,小而且稳定的蛋白质目前来说结晶并不困难,但是这类意义重大的蛋白几乎都已经解析完了,在科学上没有任何重大意义;当今时代,小蛋白已经完全不能满足科学家们强烈的探索欲望,结构生物学研究的对象越来越大,体系越来越复杂,结晶几乎成为不可能的事情,即使能结晶,也不一定衍射,有衍射也不一定能得到原子分辨率结构。
很多年前,许多蛋白质晶体科学家为了完成一项艰巨的任务,一个课题少则5到10年,多则20年,核糖体从上世纪80年代初首次长出晶体到2000年左右最终拿到原子分辨率结构整整经历了20年;线粒体呼吸链复合物I从上世纪90年代初研究,第一次报道完整晶体结构大约是20年以后。
而冷冻电镜方法跳过超大分子复合物结晶难的这层技术屏障,以直接解析复合物的溶液状态的结构为目标。
现在利用这项技术,在MRC-LMB一周时间就可以解析一个新的核糖体结构;英国皇家学会主席、MRC-LMB结构中心主任Venki Ramakrishnan 教授,因为核糖体的晶体结构研究而获得2009年诺贝尔化学奖。他的实验室在2014年发表了最后一篇晶体结构文章,此后的文章全部以冷冻电镜为主。哥伦比亚大学有一个非常执着的博士后,研究兰尼碱受体(Ryanodine Receptor)晶体结构长达十年之久,最后放弃了晶体,转向了冷冻电镜技术,同时与清华大学教授颜宁和LMB的Scheres研究组合作,几个月就解决了这个难题,并且达到近原子分辨率。
第二,样品需求量小,样品制备快,可重复性高。重要生物样品都是非常珍贵的,总体来说是以微克或者最多以毫克来计量,即使得到这点样品,也要花费生物学家几周、几个月甚至更长的时间(大多数时候都需要摸索各种条件使样品处于相对稳定的状态,以便做进一步结构研究)。
蛋白质晶体一般要求高浓度大体积,没有量变就没有质变。而同样量的蛋白可以稀释以后制备若干冷冻电镜样品,每个样品有成百上千的区域,每个区域有几百个小孔,每一个小孔甚至可以收集多张照片。解析一般蛋白的原子结构需要几万个颗粒,而对于高对称性的样品几千个颗粒就足够。
第三,可以研究天然的、动态的结构。X射线晶体学研究生物大分子结构的一个主要弱点是无法拿到天然的动态的结构,这是因为研究人员无论如何也无法绕开结晶这个过程。冷冻电镜就是要做这件事情:直接解析天然的、溶液态的、动态的(dynamic),甚至原位(in situ)的结构,从而理解生命分子如何在空间和时间两个尺度上以活的动态的方式发挥功能。
晶体学只能尝试不同的条件获得生物大分子某个或者某些固定的状态,而且容易出现晶体堆积引起的不真实相互作用方式。形象地说,冷冻电镜可以制作完整的高清电影,晶体学只能从电影里截屏。
第四,技术革命还将开启巨大的潜在医疗价值。冷冻电镜技术方法在时间和精度方面的大幅度提高有时会导致不可预测的重大科学和应用价值。比如,活体病毒结构分析如果可以在分钟级别完成,这将有可能转化为潜在的医疗检测手段:从病人体内抽取血样或感染组织细胞,几分钟以后,非常清晰明了地展现病人在细胞内部结构层面的异常状况,甚至给出局部的原子结构图,从而给出精准的治疗方案。这个想法现在可能听起来有点像笑话,或许再过若干年人们就不这样认为了。
当然冷冻电镜的革命性不仅仅体现在上述四方面,在此就不一一列举。有关冷冻电镜更加详细的介绍,可参见笔者等2010年的中文综述(《生物物理学报》,2010年7月,第26卷,第7期: 533-559)。文章中对未来几年的发展趋势所做的展望,如直接电子探测器的普及、非对称性蛋白复合物近原子分辨率结构解析、冷冻电镜相关计算性能的大规模提升等等,目前绝大多数都在过去的两三年内得以实现并飞速发展。
华人学者在冷冻电镜领域的贡献
在冷冻电镜的这场技术革命中,华人科学家功不可没,在某些方面甚至独领风骚,做出了诸多重大成果。
加州大学旧金山分校(UCSF)的华人科学家程亦凡教授在2013年底,首次利用冷冻电镜技术解析近原子分辨率膜蛋白结构,这项成果在业界引起了巨大轰动。原因在于当所有电镜结构生物学家还在讨论膜蛋白到底能不能利用冷冻电镜技术看到二级结构,也是通常我们认为的中等分辨率水平的时候,程亦凡教授研究组直接解析了TRPV1 这个膜蛋白3.3埃近原子分辨率的结构(Nature,504:107–112)。
笔者曾在该文章发表的半年前在一次国际会议上和冷冻电镜领域顶级学者深入讨论过如何获得清晰的膜蛋白α-螺旋结构,对方给出了悲观的结论:“恐怕不太可能,至少最近两年不可能”。
事实上,此前蛋白质晶体学家已经有所耳闻“冷冻电镜可能在未来几年会超越并且取代晶体学”,但是谁也没想到会是以这样快速和震撼的方式登场,这在某种程度上引发了不少蛋白质晶体学家的“职业恐慌感”。这项成果的两个共同第一作者廖茂福、曹尔虎也都是非常杰出的青年华人科学家。
加州大学洛杉矶分校的周正洪教授早在2008年到2010年左右,在这场电镜技术革命来临之前,在各项技术条件尚未成熟的情况下解析了一系列近原子分辨率病毒结构。当时采用的是传统胶片来成像,任务非常艰巨,连他还在上学的儿子也都帮忙一起洗胶片。张兴博士在这一系列稍早的重要成果中充当了先锋。早在2008年,第一个近原子分辨率的冷冻结构,也即3.8埃轮状病毒就是张兴博士作为第一作者完成的(PNAS, 105(6): 1867-1872)。从1968年Aaron Klug创立电镜三维重构理论,到2008年人们首次看到通过冷冻电镜获得近原子分辨率结构,整整用了40年。
在国内,清华大学的隋森芳院士是我国冷冻电镜领域的先驱,不仅德高望重,还培养了一大批优秀的青年科学家,包括清华大学的王宏伟教授以及MRC-LMB的白晓晨和畅磊福博士等等。王宏伟早年在隋老师实验室做研究生的时候,在我国研究设备和条件全面落后于国外的情况下依旧做出了许多非常出色的工作。
MRC-LMB的多位青年华人研究人员对冷冻电镜发展都做出了重要贡献。白晓晨博士在MRC-LMB首次使用直接电子探测设备Falcon I和Sjors Scheres博士的新程序Relion,获得了第一个不对称样品核糖体的近原子分辨率冷冻电镜结构,打响了冷冻电镜革命的第一枪,随后解析了一系列核糖体和蛋白复合物结构。畅磊福博士在LMB首次获得非核糖体不对称蛋白样品APC复合物的近原子分辨率结构,阐明了蛋白质泛素化的重要机理。笔者主要在LMB的Andrew Carter博士实验室从事动力蛋白结构和功能研究,并成功解析动力蛋白激活因子Dynactin结构,提出了目前为止动力蛋白最详尽可靠的运动和激活机制(Science, 347(6229):1441-1446. 封面文章),同时独立发展冷冻电镜技术方法。
1953年4月25日,MRC沃森和克里克在《自然》杂志发表DNA双螺旋结构,61年后的同一天,我国科学家、中科院生物物理研究所的朱平和李国红研究员在《科学》杂志以长文形式发表了30nm染色质冷冻电镜结构(DNA双螺旋之双螺旋)(Science , 344(6182): 376-380)。这项工作是冷冻电镜在核心生命科学问题中的成功应用,冷冻电镜部分的工作主要是笔者在生物物理所的同学宋峰博士完成的。
生物物理所的程凌鹏博士(当前单位为清华大学)获得国内本土第一个原子分辨率的冷冻电镜结构,构建了蚕多角体病毒(CPV)的完整三维原子模型(PNAS,108(4):1373-1378)。笔者也参与了部分工作, 被其高质量、干净的电子密度图震撼。近期程凌鹏与刘红荣博士合作,在国际上首次发表了CPV完整基因组和RNA聚合酶“原位三维结构” (Science, 2015, 349(6254):1347-50), 引起了很大轰动,这项成果是我国本土冷冻电镜技术和生物学应用的双重突破,被多名同行科学家称赞为”里程牌式发现“。
我国著名科学家施一公最近发表了一系列重大蛋白复合物的冷冻电镜结构,包括γ-secretase、spliceosome等,被誉为过去几十年我国科学家对基础生物学领域的最大贡献。
另外,在欧美和中国本土还有一大批华人学者在冷冻电镜或密切相关领域(cryoET等)做出诸多突破性成果,例如匹兹堡大学的张佩君教授(艾滋病毒结构研究),德克萨斯大学的刘俊教授(细菌运动,噬菌体结构等研究)等,由于时间和篇幅问题,无法一一介绍。
冷冻电镜的未来展望
冷冻电镜技术目前仍然在快速发展中,未来冷冻电镜能做什么取决于这项技术能发展到什么程度。现代科学技术革命的一个最大特点是发展速度极其迅速,谁也不知道明天会发生什么,当然也不能十分准确的预知一个领域的发展方向。即便如此,笔者还是对这个领域有一些预测或期待(仅技术角度,不涉及具体生物学研究)。
1)超大规模、超快速度数据采集和处理。和晶体学相比,冷冻电镜的效率在某些方面已经异常惊人。比如笔者近期与牛津大学王祥喜博士合作,在几个小时以内就可以拿到完整甲肝病毒原子结构,而此前王祥喜博士花费近一年时间结晶才最终拿到原子结构。但是科学技术发展是永无止境的……
但目前来说,结构生物学的巨大转型必须建立在速度和效率的双重前提下。这需要硬件、软件以及其它交叉学科等多方面的共同发展。
除了生物学研究应用,笔者一直致力于冷冻电镜技术的发展,最近在提高电镜数据处理结果可靠性和分辨率前提下,上千倍地提高了其中几个环节,过去几百到上千CPU小时的事情,现在几分钟到几十分钟就完成了。但是这只是部分环节,在其它方面依旧非常耗时,整个技术的各个环节如何全面高效高速地完成还需要更多的优秀人才参与。对硬件的发展方面笔者并不是很熟悉,预计在未来会出现超高速度的电子显微镜,大幅度提高电镜原始数据的数量和质量。
2)大尺度、高分辨率、高动态的生物大分子结构解析。理论上,冷冻电镜可像高清数码摄像机拍电影一样对生物大分子成像和重现其动态结构,研究深层机理。就目前而言,这一方面在技术上远未成熟。大尺度、高分辨率、高动态这几点拆解开来,每一个都不算太难,但是同时满足这几项需求几乎成为不可能的事情。但是这是未来结构生物学的方向,我们不仅仅要看简单的几张静态照片,我们还想看高清电影。
关于这一点,笔者需要强调一下结构生物学和动力学模拟的区别。结构生物学的动态结构目的是以实验手段完整复原自然状态的动态结构,理解其中机理,是从实验数据出发“重现大自然原貌”的过程,是完完全全可靠的实验结果。而动力学模拟是从已有的理论或经验性的物理学规律出发预测一个生物大分子的动态特性,存在巨大的不确定性,其结果可靠性较差。期待在未来的某个时刻,两者会像上个世纪的理论物理和实验物理一样完美地结合,相互促进。
大尺度复杂生物系统的高分辨率、动态机理研究涉及诸多学科,不是冷冻电镜一项技术就可以完成的,需要多学科科学家共同参与完成。
3)高分辨单分子及原位结构研究。目前的结构生物学,无论晶体学、冷冻电镜还是核磁共振主要还是在研究“群体”结构。冷冻电镜相对晶体学在这一方面已经有了大幅度提高,可以通过分类的方法研究群体结构中的每一类结构。但实际上每个分子在时间和空间上除了共性,也必然有特性,如果一种方法强大到可以测得单个分子的高分辨率结构,这必然导致巨大革命,使得人们发现许许多多在群体结构研究层次上无法发现也无法理解的大量规律。
注意这里强调的是单分子“高分辨率”结构,而不仅仅是单分子结构。单分子结构我们目前可以使用比如冷冻断层成像(cryoET)的手段获得,但是分辨率非常低,在如此低分辨率情况下,别说个体差异,很多群体结构差异都值得严重质疑。或许冷冻电镜技术若干年以后会实现这个目标,或许永远都不可能,或许这个目标被另外一个全新的技术彻底取代,冷冻电镜从此退出历史舞台。
冷冻电镜:一个高度交叉的学科
冷冻电镜领域一直是多学科高度交叉和相互促进才诞生的一个奇迹。数学、物理、化学、材料、计算机、软件、机械及自动化、精密仪器仪表等等缺一不可,当然最终的核心是生命科学(作者注:此处仅从结构生物学角度分析,并非泛指一般意义上生命科学是一切学科的核心)。生命科学提出问题,其它所有学科相互结合产生更好的解决方案。通过这些解决方案,发现更多神秘的生命现象,从而提出新的问题,诞生新的技术。
举个例子,冷冻电镜图像信噪比极低,没有科学家的雄心勃勃,没有大批信号分析、图像处理甚至数学家的参与是不可能完成这样艰巨的任务。同时冷冻电镜领域的一些发现或需求,也为其它领域的科学家提供灵感来源和新的研究思路。MRC-LMB作为现代分子生物学的发源地和近两年来飞速发展的冷冻电镜技术核心研究机构,其一大特点就是多学科“零距离交叉”。从半个世纪前的DNA双螺旋模型、肌红蛋白晶体结构等到近两年冷冻电镜技术革命,一直将这一理念体现得淋漓尽致。技术的发展和重大科学问题的解决几乎都是同时进行的,当然科学问题或应用价值始终是核心和最终驱动力,脱离科学和应用需求的技术发展是没有意义的。
另外一个比较具体的例子是笔者此前思考过的一个问题。在电镜领域出现直接电子探测设备之后,MRC-LMB的两台高端电镜,每天产生5到10T的数据量,近期正在调试第三台,也许不久的将来,超大数据、超快速度电镜就会投入生产,这些将会导致全世界各个研究机构普遍出现一个严重的技术问题,就是如何高效、无损、快速地进行数据压缩存储和数据处理,当然这里的无损是相对特定生物样品和特定目标分辨率而言。这或许会引起一些信号处理和图像压缩方面的研究人员的兴趣。
随着冷冻电镜对生物大分子复合物高分辨率结构研究趋于成熟,更加复杂的动态机理研究是必然趋势,这是冷冻电镜技术发展的一个潜在可能性。但是复杂生物体系的深入研究需要解决一系列数学理论、物理、计算难题,有的可能甚至超出了这些学科目前的研究范畴。近些年比较现实可行的是通过冷冻电镜手段,对特定蛋白复合物非随机情况下的高分辨连续动态构象进行分析。笔者认为,专业数学家的参与会大大加速冷冻电镜技术在这些方面的发展。
生命体高度复杂,充满很多未知的和未被阐述清楚的规律,这里面有成千上万的生物大分子复合物,每一个复合物又与其它若干分子或复合物相互作用、相互影响,深入再深入地理解生命本质一直都会是冷冻电镜的重要方向。冷冻电镜是强大的基础研究手段,它通过解析高度复杂的生物大分子结构,帮助人们更好地理解生命规律,从而影响生命科学相关的一切下游学科和技术,当然也包括更好的发现和设计药物、医疗诊断等具体应用。我们期待在不久的将来,冷冻电镜技术会对科学研究和社会发展等方方面面都产生巨大影响。
参考链接
MRC-LMB官方网站:
http://www2.mrc-lmb.cam.ac.uk/
http://www2.mrc-lmb.cam.ac.uk/achievements/lmb-nobel-prizes/
Aaron Klug(首次创立电镜三维重构方法)
https://en.wikipedia.org/wiki/Aaron_Klug
《The revolution will not be crystallized: a new method sweeps through structural biology》
http://www.nature.com/news/the-revolution-will-not-be-crystallized-a-new-method-sweeps-through-structural-biology-1.18335
Method of the Year 2015
http://www.nature.com/nmeth/journal/v13/n1/index.html#prim
饶毅:国产博士记录 (介绍程亦凡博士的博文)
http://blog.sciencenet.cn/blog-2237-749393.html
近期热文
知识分子,为更好的智趣生活。
投稿、授权事宜请联系:[email protected]。