欢迎关注公众号:oddxix
北京时间2018年10月1日17:30,诺贝尔奖委员会公布了2018年生理学或医学奖获得者名单。
艾利森与本庶佑分别作为免疫调节关键蛋白CTLA-4与PD-1的首度阐明者
获奖者简介
James P. Allison
1948年,出生于美国得克萨斯州,1973年,获得德克萨斯大学博士学位,从2012年开始,就职于德克萨斯大学MD安德森癌症中心。2014年获生命科学突破奖、唐奖生技医药奖。
Tasuku Honjo
1942年出生于日本东京,1966年,荣获医学博士学位,目前就职于日本京都大学。日本免疫学家,美国国家科学院外籍院士,日本学士院会员。现任京都大学高等研究院特别教授。亚洲百大科学家。因PD-1、活化诱导胞苷脱氨酶的有关研究举世闻名,曾获得首届唐奖生技医药奖、京都奖以及华伦·阿波特奖等重要荣誉。
获奖解读
研究者Allison和Honjo阐明了通过抑制免疫系统制动器的不同策略如何有效治疗癌症。
James P. Allison教授对一种已知蛋白(即CTLA-4蛋白)进行了深入研究,该蛋白能作为免疫系统的制动器。他意识到了可以通过抑制该蛋白,从而使机体免疫细胞来攻击肿瘤组织,随后研究者James P. Allison创建了一种治疗癌症患者的新方法。
与此同时,研究者Tasuku Honjo在免疫细胞中发现了一种特殊的蛋白质(即PD-1蛋白)。当对该蛋白质的功能仔细研究后,他发现,该蛋白质同样也能作为一种制动器。但其却发挥着不同的作用机制,而基于该研究发现所开发的疗法或许就能有效抵御癌症。
在20世纪90年代,当研究者James P. Allison在加利福尼亚大学的实验室从事研究期间,他对T细胞蛋白CTLA-4进行了深入研究,他本人是发现蛋白CTLA-4能作为T细胞制动器角色的科学家之一。如今,其它研究小组正在研究阐明是否该蛋白能作为治疗自身免疫性疾病的靶点。
而研究者Allison有着完全不同的想法,他开发出了一种特殊抗体,能够结合CTLA-4并且阻断其功能(见下图)。
如今他正在研究想要阐明是否阻断CTLA-4蛋白的功能能够释放T细胞的制动,同时释放免疫系统攻击癌细胞的能力。Allison与其同事于1994年进行了首轮试验,随后他们又对实验进行了重复,结果让人不可思议。研究者所开发的特殊抗体能够抑制制动器并且释放机体免疫系统的抗肿瘤T细胞活性,从而成功治疗了癌症小鼠。
尽管制药行业对此兴趣不大,但Allison一直在密切研究,他希望能够开发出一种适合人类的新型抗癌疗法。随后当他与其他研究人员联合研究于2010年发表了一项针对恶性黑色素瘤患者的重要临床研究成果。文章中研究者表示,多名患者身上的癌症症状消失了,而且诸如这样的研究结果此前从未在患者群体中被发现。
左上角:T细胞的激活需要T细胞受体结合到其它被识别为异物的免疫细胞的特殊结构上,而作为T细胞加速器的蛋白质则是T细胞激活所需要的;CTLA-4能作为T细胞的制动器来抑制加速器的功能。左下角:抵御CTLA-4的抗体(绿色)能够阻断制动器的功能,从而促进T细胞激活,并且攻击癌细胞。右上角:PD-1是另外一种T细胞制动器,其能抑制T细胞的激活。右下角:抵御PD-1的抗体能够抑制制动器的功能,从而促进T细胞激活,高效攻击癌细胞。
PD-1的发现及其对癌症疗法的重要性
1992年,在研究者Allison发现CTLA-4之前,来自日本的研究者Tasuku Honjo就发现了PD-1,其是T细胞表面另外一种特殊蛋白,多年来研究者Honjo一直在探索其功能。
他表示,PD-1与CTLA-4相似,其也能作为T细胞的制动器,但却有着另外一套作用机制。在动物实验中,阻断PD-1或许能作为抵御癌症的新型疗法;为此研究人员也试图利用PD-1来有效治疗癌症患者。2012年的一项关键研究明确了治疗多种不同类型癌症的疗效;研究结果非常显著,研究人员成功治疗了一些转移性的癌症患者。同时让患者的疾病症状得到了长期缓解,而这在以前基本是无法实现的。
癌症
“癌症”通常泛指所有的恶性肿瘤,多表现出细胞分化和增殖异常、生长失去控制、浸润性和转移性等特性。目前有大量的疗法能用作癌症治疗,包括外科手术、放疗和其它策略,而且其中有些癌症疗法已经获得过诺贝尔奖。比如治疗前列腺癌的激素疗法(Huggins, 1966)、化学疗法(Elion和Hitchins, 1988)、用于白血病的骨髓移植疗法(Thomas 1990)。而一些进行性的恶性肿瘤往往难以应对。因此,研究人员就迫切需要开发出新型的癌症疗法。在19世纪晚期和20世纪初期流行着一种新型理论,即激活机体免疫系统来攻击肿瘤细胞或许可以成为治疗恶性肿瘤的新方法。
免疫系统
机体免疫系统的基础特性是能够有效区分“自我”与“非自我”。因此当面对外来入侵的细菌、病毒和其它威胁时,机体免疫系统常常能有效发挥作用。T细胞是一种特殊的白细胞,也是免疫防御机制的关键成员,T细胞表面拥有特殊的受体,能结合一些异物结构。而诸如这样的结合作用能够诱发机体免疫系统参与到防御过程中去。通过添加一些扮演T细胞加速器的额外蛋白就能有效诱发一种完全成熟的免疫反应。
同时,很多研究人员都尝试进行研究来寻找特殊的蛋白质来作为T细胞制动器,从而抑制机体免疫激活。加速器和制动器之间的精细化平衡对于机体免疫系统的严密控制非常重要,其能够保证免疫系统充分参与到了抵御外来入侵者的攻击中。还能够避免免疫系统过度激活而引发健康细胞和组织出现自身免疫破坏。
肿瘤免疫治疗
肿瘤免疫治疗(Immuno-Oncology,IO)是通过调动机体的免疫系统,增强抗肿瘤免疫力,从而抑制和杀伤肿瘤细胞。肿瘤免疫治疗的代表性“PD-1/PD-L1药物”是当前肿瘤治疗领域中最具前景的方向之一。
癌细胞并不仅仅是一群生长失去控制的细胞;为了自身的生存,它们积极地参与与免疫系统之间的斗争。能够逃避免疫系统检测是癌症的一种特征。
在一项新的研究中,来自美国宾夕法尼亚大学的研究人员发现癌细胞释放生物“无人机”---在血液中循环的被称作外泌体 (exosome)的小囊泡,这些小囊泡携带着PD-L1蛋白,这种蛋白导致T细胞在到达肿瘤并进行战斗之前精疲力竭---来协助这种斗争。
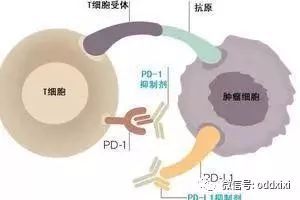
癌症治疗中最成功的创新之一是使用免疫检查点抑制剂药物,这类药物旨在阻止癌细胞抑制免疫系统而让肿瘤茁壮成长和扩散的企图。这类药物的主要靶标之一是PD-1,即一种位于T细胞表面上的蛋白。在肿瘤细胞的表面上,它们表达一种被称为PD-L1的对应分子,它与T 细胞表面上的PD-1蛋白相互作用,有效地关闭了T细胞的抗癌反应。使用免疫检查点抑制剂阻断这种相互作用让T细胞重新活跃,从而允许它们在肿瘤中能够释放出杀伤癌细胞的能力。
尽管已知癌细胞在它们的表面上携带PD-L1,但是在这项新的研究中,这些研究人员发现来自人类黑色素瘤细胞的外泌体也在它们的表面上携带着PD-L1。外泌体PD-L1可直接结合T细胞并抑制这些T细胞的功能。鉴定出肿瘤细胞分泌的外泌体PD-L1为免疫检查点机制提供了一次重大更新,并对肿瘤免疫逃避提供了新见解。
相关研究结果于2018年8月8 日在线发表在Nature期刊上,论文标题为“Exosomal PD-L1 contributes to immunosuppression and is associated with anti-PD-1 response”。
论文通信作者为宾夕法尼亚大学文理学院生物学教授Wei Guo博士和宾夕法尼亚大学佩雷尔曼医学院病理学与实验室医学 教授Xiaowei Xu博士。
PD-1抑制剂,包括PD-1抗体和PD-L1抗体,是一类免疫治疗的新药。主要的作用机制,是阻断PD-1和PD-L1之间的相互作用,因为这两个蛋白的相互作用,会帮助恶性肿瘤逃脱免疫系统的追杀,典型的“金蝉脱壳”。PD-1/PD-L1抗体,通过阻断这种“欺骗的伪装”,促进病人自身的免疫系统杀伤肿瘤。
简单来说,肿瘤细胞为了逃避人体免疫的追杀,在自身表面产生了一种被称为“PD-L1”的蛋白,相当于一个假的“良民证”。这个蛋白与免疫细胞表面的PD-1蛋白相结合,就会让人体免疫系统产生“这是良民”的错觉,从而放过肿瘤细胞,任其疯狂繁殖。
通过使用PD-1\PD-L1抑制剂,使得肿瘤细胞的“良民证”失效(如上图)。这样肿瘤细胞就会被免疫细胞果断识破,对其持续围剿,从而达到病情缓解甚至治愈。
2015年8月20日,近91岁高龄的美国前总统吉米·卡特宣布自己确诊罹患晚期黑色素瘤,转移到脑中的4个瘤块约2毫米大小,准备向世界告别。幸运的是此时神药横空出世,他在PD-1药物的治疗下,3个月之后肿瘤奇迹般的消失了。直到今天,并无任何复发迹象。
肿瘤免疫治疗已成为继手术、化疗、放疗、靶向治疗后肿瘤治疗领域的又一重要手段。但PD-1/PD-L1抑制剂在临床实践中却面临很多的问题,比如治疗周期长,进口药物费用高昂(美国的治疗费用大约15万美金/年,相当于人民币接近100万)。中国目前看一年的费用也在50万人民币上下。贵也就算了,关键是——还不是对每个患者都有效!
针对大部分实体瘤,PD-1抗体的有效率大概10%-50%。用在不合适的人身上,不但不能缓解病情,还可能延误病情,造成疾病进展。
生物标志物
生物标志物(biomarker)作为最直接快速有效的检测手段,为了让患者能受到准确有效的治疗,生物标志物就担起了筛选患者、分类患者的重担,准确找出有药物响应的患者,让他们尽早接受最好的治疗。
目前研究较为深入的与PD-1抗体疗效相关性较大的生物标志物主要是:
(1) PD-L1阳性表达情况(PD-L1伴随诊断)
PD-L1是一种在肿瘤细胞表面表达的蛋白,而免疫T细胞的表面表达PD-1蛋白。
神奇的免疫治疗其实就是通过单克隆抗体保护PD-1,因此,PD-L1蛋白高表达的肿瘤细胞无疑就是免疫治疗的靶子。现在这是最热的免疫治疗标志物。相关临床研究表明,PD-L1的表达与PD-L1/PD-1抑制剂的疗效相关,随着PD-L1表达升高疗效增加,疾病控制时间延长,而且预后改善。现已开展的很多关于PD-L1检测的临床试验表明,PD-L1表达阳性对预测免疫治疗在非小细胞肺癌、黑色素瘤、胃癌、食管鳞状细胞癌等多瘤种的疗效上都起到重要作用。
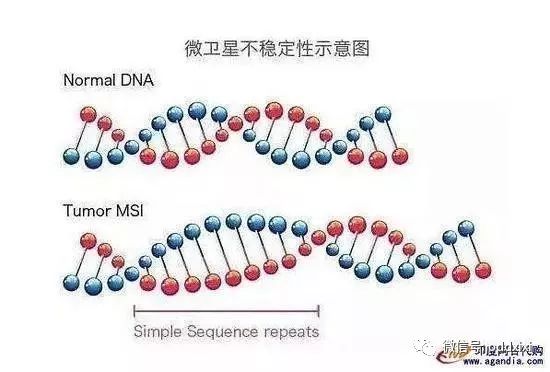
(2) MSI
微卫星不稳定性(Microsatellite instability,MSI)也是明星生物标志物之一,微卫星序列(Microsatellite,MS)在真核生物基因组中约占5%,是基因重组和变异的来源。
MSI便是由于在遗传物质复制过程中,各种错误的累积所致。肿瘤细胞的DNA突变多表现在微卫星序列异常,免疫细胞一眼就看出来有问题。MSI最大的问题是应用很少,只有在很少的癌种很苛刻的条件下才能使用,而且对于样本要求很高,很多时候需要手术或者穿刺。
(3) TMB
肿瘤突变负荷(Tumor mutation burden,TMB)是肿瘤组织每兆碱基中突变的数目。原理和MSI非常相似,只不过突变不在MS上,而在全基因组之中。因此,TMB高也是预测使用PD-1抗体是否有效的一个重要生物标志物。
只是TMB检测更昂贵,而且检验标准非常不统一。而且不同癌种的TMB水平也很不一样。另外年龄也是一个很大的影响因素,年龄越高TMB越高,会影响正常值。
(4) EBV
EBV就是EB病毒(Epstein-Barr virus,EBV)。EBV是鼻咽癌和胃癌中经常出现的外来入侵者。病毒的DNA会插入到人细胞DNA基因组序列中,导致细胞增殖异常。
根据文献中提供的PD/SD/PR/CR的四种患者用药效果,我们计算每一个生物标志物的敏感性和特异性,得出:
PD-L1的敏感性=100%,特异性=63.16%
MSI的敏感性=40%,特异性=97.62%
TMB的敏感性=42.86%,特异性=94.87%
EBV的敏感性=40%,特异性=100%
PD-L1的敏感性100%,患者不会漏诊,大大提高了药物的有效性,是优秀的生物标志物。目前病理上PD-L1检测虽然有效,但还不是完美的。有以下几个缺点:
不够标准化:病理的判读还是过于依赖病理医生的个人经验。
假阴性:越来越多的数据证明IHC的结果有比较多的假阴性,尤其在活检穿刺的样品。由于PD-L1表达在组织上的空间异质性,穿刺样品由于组织量的局限,经常导致假阴性。
无法取得组织。大约有40%的患者因为不愿意,或者实际操作的原因,都获得不到组织样本。
即使有了组织样本,由于时效性以及取样痛苦性,不能经常获得动态、实时的数据。
针对这一问题的解决方案就在于液体活检。利用灵敏的液体活检CTC检测技术,可以检测出游离于外周血中的肿瘤细胞,再进行分析,就精准可以测出CTC上的PD-L1表达.
转载请注明出处
作者:oddxix
微信公众号:oddxix
欢迎关注oddxix
有趣的灵魂等着你~
参考:
https://baijiahao.baidu.com/s?id=1613823179502010756&wfr=spider&for=pc
https://mp.weixin.qq.com/s/6jlsmgnRaAZRZ2vfQzRSqQ
https://mp.weixin.qq.com/s/2a1k-fFKchM3FGUvFJjYHA
[1]Kim S T, Cristescu R, Bass A J, et al.Comprehensive molecular characterization of clinical responses to PD-1inhibition in metastatic gastric cancer[J]。 Nature Medicine, 2018。
[2]Yue C, Jiang Y, Li P, Wang Y, Xue J, Li N, Li D, Wang R, Dang Y, Hu Z, Yang Y, Xu J。 Dynamic change of PD-L1 expression on circulating tumor cells in advanced solid tumor patients undergoing PD-1 blockade therapy。 Oncoimmunology。 2018
[3]Ishida, Y., Agata, Y., Shibahara, K., & Honjo, T. (1992). Induced expression of PD-1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death. EMBO J., 11(11), 3887–3895.
[4]Leach, D. R., Krummel, M. F., & Allison, J. P. (1996). Enhancement of antitumor immunity by CTLA-4 blockade. Science, 271(5256), 1734–1736.
[5]Kwon, E. D., Hurwitz, A. A., Foster, B. A., Madias, C., Feldhaus, A. L., Greenberg, N. M., Burg, M.B. & Allison, J.P. (1997). Manipulation of T cell costimulatory and inhibitory signals for immunotherapy of prostate cancer. Proc Natl Acad Sci USA, 94(15), 8099–8103.
[6]Nishimura, H., Nose, M., Hiai, H., Minato, N., & Honjo, T. (1999). Development of Lupus-like Autoimmune Diseases by Disruption of the PD-1 gene encoding an ITIM motif-carrying immunoreceptor. Immunity, 11, 141–151.
[7]Freeman, G.J., Long, A.J., Iwai, Y., Bourque, K., Chernova, T., Nishimura, H., Fitz, L.J., Malenkovich, N., Okazaki, T., Byrne, M.C., Horton, H.F., Fouser, L., Carter, L., Ling, V., Bowman, M.R., Carreno, B.M., Collins, M., Wood, C.R. & Honjo, T. (2000). Engagement of the PD-1 immunoinhibitory receptor by a novel B7 family member leads to negative regulation of lymphocyte activation. J Exp Med, 192(7), 1027–
[8]Hodi, F.S., Mihm, M.C., Soiffer, R.J., Haluska, F.G., Butler, M., Seiden, M.V., Davis, T., Henry-Spires, R., MacRae, S., Willman, A., Padera, R., Jaklitsch, M.T., Shankar, S., Chen, T.C., Korman, A., Allison, J.P. & Dranoff, G. (2003). Biologic activity of cytotoxic T lymphocyte-associated antigen 4 antibody blockade in previously vaccinated metastatic melanoma and ovarian carcinoma patients. Proc Natl Acad Sci USA, 100(8), 4712-4717.
[9]Iwai, Y., Terawaki, S., & Honjo, T. (2005). PD-1 blockade inhibits hematogenous spread of poorly immunogenic tumor cells by enhanced recruitment of effector T cells. Int Immunol, 17(2), 133–144.