全球加速跑 研发新冠疫苗

 各显神通 作者
|Cactus
各显神通 作者
|Cactus
“或许到9月,我们能有一种在紧急情况下可以使用的(新冠)疫苗。”4月23日,中国疾控中心主任高福在接受CGTN采访时说。他表示,若疫情在之后卷土重来,即便到时候仍处于第二或第三阶段临床试验,但这些疫苗将可以用于医疗人员等特定的人群。他还预测,明年初也许就能研发出可用于健康人群的疫苗。
高福所预测的速度,在人类疫苗研发的历史上都属罕见。要知道,最近几年人类的疫苗研发往往耗时数年。但这一次,人类必须提速。好在技术的进步以及特殊情况下研发流程的优化,让全球不同背景的研发者都可以跑步前进研发新冠疫苗。
根据WHO官网不断更新的全球疫苗临床实验进展清单,截止4月20日,以下5款疫苗研发状态位于前列:
中国康希诺生物公司的Ad5-nCoV 腺病毒载体疫苗
美国Inovio公司的INO-4800 DNA疫苗
中国生物武汉生物制品研究所的灭活疫苗
北京科兴中维生物技术公司Sinovac的“克尔来福”灭活疫苗
美国生物技术公司Moderna的RNA疫苗
在这5款疫苗中,腺病毒载体疫苗有埃博拉研发先例,目前研发进展最快;核酸疫苗属于新型疫苗,在早期展现快速研发优势,但仍未有已上市品种验证;灭活疫苗技术最为传统,是本次疫苗研发最稳妥的方案。
 来自WHO官网发布的全球新冠疫苗试验候选清单
来自WHO官网发布的全球新冠疫苗试验候选清单

中国:多管齐下
目前国内在疫苗研发上采用多管齐下的策略,由灭活疫苗、重组蛋白疫苗、腺病毒载体疫苗、减毒流感病毒载体活疫苗、核酸疫苗5条技术路线稳步推进,而目前进入临床阶段的疫苗主要有3种。
进度最快的是中国康希诺生物公司与中国工程院院士、军事科学院陈薇院士团队牵头研发的腺病毒载体疫苗“Ad5-nCov”。这种疫苗相当于通过基因工程技术人造了一个新的病毒。科学家在一个已经确定不会对人体带来严重伤害,且可以承载异源基因的病毒身上,加入从新冠病毒中通过基因测序工程得到的抗原基因。这样,当把它注射进体内时,免疫系统可以识别诱导产生免疫应答,同时人体也不会染上新冠病毒。
刚结束的I期临床实验主要考察疫苗对于人体耐受性和安全性,以青壮年群体为主。该疫苗已于4月9日开始招募II期临床实验志愿者,是全球首个启动II期临床研究的新冠疫苗品种。II期实验放开了此前60岁的年龄上限并扩大了实验人群数量,延长了观察时间,将对志愿者进行连续几个月甚至半年的跟踪监测,以评估不同剂量的疫苗要打多少才能产生抗体免疫,以及疫苗的有效保护时长。

另外两款灭活疫苗,分别来自中国生物武汉生物制品研究和北京科兴中维生物Sinovac技术公司,4月14日获得国家药品监督管理局I、II期合并的临床试验许可。灭活疫苗是用物理、化学方法杀死病原微生物,但仍保持其免疫原性。相当于把病毒“杀死”,再把它的尸体放到体内,刺激免疫系统认识它提前做好抗体准备。
不过这种疫苗存在一定风险,如果灭的不够彻底或者过头了,反而会让人体感染或者无法识别。而且由于它需要建立在获取理想的病毒毒株之上,才能展开研究。由于研发过程涉及对真实病毒毒株的处理,因此风险较高,在实验室中不容有任何闪失。
中国生物武汉生物制品研究所的疫苗项目名为“新型冠状病毒灭活疫苗(Vero细胞)随机、双盲、安慰剂平行对照I / II期临床试验”。其研究在河南武陟县人民医院进行,有32名志愿者加入试验,其目的为了评价6岁及以上健康人群接种的安全性,初步探索免疫原性和持久性。据北京日报报道,“由于临床前研究的数据较为充分,同时为了提升研发速度,国家食品药品监督管理总局开通了“绿色通道”,一次性批准了两期临床试验。”
北京科兴中维生物技术公司Sinovac(以下简称 Sinovac)的灭活疫苗“克尔来福”4月16日在江苏省徐州市睢宁县正式启动I期实验,共招募144名18至59岁的健康志愿者,并完成疫苗接种。这款疫苗第一阶段试验设有随机、双盲、安慰剂对照试验。参与疫苗接种的志愿者将有2/3的几率接种中高两种剂量的疫苗,1/3的几率接种安慰剂。
根据其最新发布、但尚未完成同行评审的试验论文结果的描述,此灭活疫苗分别在小鼠、大鼠、恒河猴上接种,发现都产生了有效免疫应答。研究人员指出,这些抗体同样有效地中和了从中国,意大利,瑞士,西班牙和英国的COVID-19患者体内分离出的其他病毒毒株。目前,Sinovac公司仍有很多试验需要进一步评估,他们希望在5月中旬开始招募1000多人的II期研究,并在6月底之前取得结果。
 新冠灭活疫苗(vero细胞)
新冠灭活疫苗(vero细胞)

美国:不需要毒株的mRNA疫苗
作为全球大流行性疾病,各国都希望能率先研发出疫苗。一般来说,疫情最早爆发的地区会更早拿到理想的毒株用于疫苗研究,会在疫苗研发上更快。但随着基因工程技术的突飞猛进,在没有毒株的情况下,基于公开的病毒基因测序结果,疫苗研发也可以快速展开。
这也是为何美国较中国疫情大规模爆发更晚,但疫苗的人体实验却几乎同时展开的原因。
美国在疫苗研发上以两款核酸疫苗试验为主。核酸疫苗分为RNA疫苗和 DNA疫苗,这类疫苗是将编码抗原蛋白的 RNA 或 DNA 片段直接导入人体细胞内,并不是直接注射病毒抗原。
美国第一个进入临床试验的新冠病毒疫苗是美国生物技术公司Moderna的RNA疫苗“mRNA-1273”。这种疫苗不含病毒任何蛋白成分,因此理论上安全性很高。研究人员需要破译新冠病毒的基因序列,然后用mRNA作为一个“翻译器”,将其注射进入宿主细胞后,表达生成出具有新冠病毒形态和功能的病毒蛋白以此刺激免疫细胞识别。不过由于mRNA的翻译表达不稳定,在“翻译”过程中容易变异,因此这类疫苗成功研发的难度也很大。
据当地时间4月22日的报道,该疫苗已开启第二轮注射试验。美国国立卫生研究院正在将试验扩大到60名56岁以上的成年人。参与试验的志愿者将被进行13个月的随访,以确保他们对疫苗没有副作用或其他反应。
另一款DNA疫苗“INO-48006”来自美国生物制药公司Inovio,由比尔盖茨基金会资助研发,是新冠疫苗全球研究中的首款DNA候选疫苗。
Inovio应该是全球最早涉入疫苗研究的公司,公司表示1月10日中国研究人员公开公布COVID-19的基因组测序后的三个小时内,他们就创建了INO-4800疫苗,4月16日该疫苗进入I 期临床试验,共有40名志愿者参加,他们每4周间隔接受两剂疫苗。
这种DNA疫苗可以快速大批量制备、成本低,注射进细胞核内相当于让人体基因插入一段补丁,让我们自带免疫功能。不过在运输体能的过程中这段补丁容易降解或者失效,亦或是病毒升级后,这段补丁失去作用也很难取出难以预测发生什么,因此需要进行动物试验比较保险。
 Moderna研发的新冠疫苗mRNA-1273
Moderna研发的新冠疫苗mRNA-1273
据知名医药网站Fiercepharma的报道,全球分析公司Clarivate 在考察了Moderna和Inovio,这两家在疫苗研发上表现突出的公司后得出结论:任何一种候选疫苗,都需要至少五年的时间才能通过全面的监管批准来完成开发过程。
Clarivate估计Moderna研发的疫苗“mRNA-1273”的成功可能性仅为5%,批准的时间范围为5.2年,侧面反映mRNA疫苗是一种未经证实的新型疫苗方法。的确Moderna在研发这款疫苗时赌了一把,其跳过动物试验直接进入人体临床试验。
然而Moderna已经获得了生物医学高级研究与开发管理局(BARDA)的4.83亿美元资助,以加速后期试验和生产。Inovio也于近期从流行病防范创新联盟(CEPI)获得了900万美元的拨款,其目的是为了加快将疫苗推向市场。且公司股价截止美国时间4月23日下午上涨了10.4%,全部基于努力开发用于COVID-19的疫苗。不过Inovio在市场上没有经过批准的产品,且不能完全保证其研究的新冠疫苗将获得监管部门的批准,更不用说它将是唯一获得批准的产品。
Clarivate的分析结果同样表示,治疗新冠的有效药物可能会在任何疫苗之前上市,疫苗在批准前必须建立长期的安全性。不过FDA也可能根据情况下发紧急使用批准使得新冠疫苗快速投放市场。


“不让一个人掉队”
为了应对未来新冠病毒再次爆发的可能,目前全球正在“疯狂”寻找疫苗。
英国是为数不多的进入新冠疫苗人体临床试验的国家,且目前已经审批通过了27个针对对抗新冠病毒的研究项目。英国卫生部长表示,为全球寻找疫苗英国投入了比任何其他国家更多的钱。
4月23日,德国生物技术公司BioNtech与美国制药公司辉瑞联合开发的新冠疫苗“BNT162”将在德国展开临床试验。
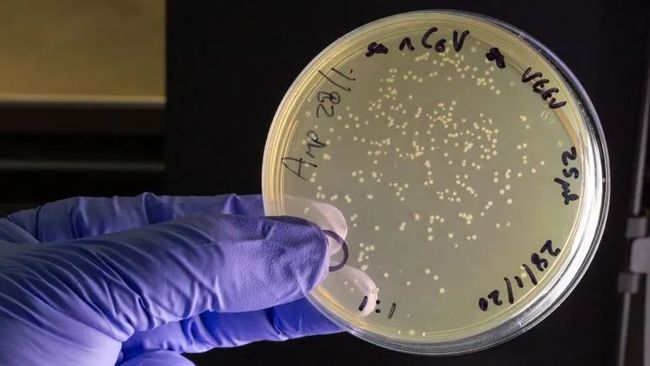 帝国理工大学用于培养COVID-19疫苗的平板培养物
帝国理工大学用于培养COVID-19疫苗的平板培养物
菲律宾总统杜特尔特也表示将投入更多资金用于新冠肺炎疫苗的研发,向当地大学和总医院的实验室提供大量补助金,以推进新冠肺炎的治疗工作。甚至承诺给予能够成功研发疫苗的个人1000万比索(约合人民币139万元)的奖励。
根据流行病防范创新联盟(CEPI)的7位研究人员在《Nature Review Drug Discover》刊发的文章,截至2020年4月8日全球共有115个候选的新冠疫苗处于不同开发阶段。其中78个项目研发状态为活跃,这些疫苗开发者中36家来自北美、14家来自中国、14家来自除中国外的亚太地区,另外14家来自欧洲。
面对这种全球竞赛的趋势,世界卫生组织4月24日提醒人们在这个紧要关头加强合作的重要性。世卫组织以及其他合作机构发出的合作倡议指出,当前人类的任务不仅是加快研发,而且要让所有人公平地获取安全、高质量、有效且负担得起的新冠应对工具,包括诊断和治疗工具及疫苗。
“确保在与新冠病毒斗争中没有一个人掉队。”
往期精彩文章推荐

长按关注
品玩官方公众号
科技创新者的每日必读