本文来自文献《Single-Cell RNA Sequencing to Understand Host−Pathogen Interactions 》(2018年发表于Infectious Diseases)的分享。看完这篇综述之后收获挺多的,本来想从中挑选一篇文章试着跟随作者的研究过程进行学习,记录作者进行实验和分析时候的技术细节。然而奋战了2天之后觉得我真不是那块料,本身自己对单细胞测序技术就没有一个很好的理解,做分享简直就是误人子弟。于是放弃了之前的念头,还是分享这篇综述所讲的内容吧。对于做感染性疾病研究,想在自己的研究上加上单细胞分析的朋友们,可能有所帮助。
研究病原体为什么要用单细胞测序?
为什么要做单细胞测序,其实已经是不言而喻的了,从下面一幅图也能体现出来。类似肿瘤的异质性,微生物,如细菌也存在很强的菌群异质性,除了细菌的亚克隆之外,还有合并感染等复杂的现象。如图所示的三种细胞群体特征,可能在bulk测序后得到相同的表型,因此而掩盖了真实的现象。一个典型的例子出现在大肠杆菌E.coli双稳态(bistability)的研究中。双稳态描述了一种可逆的双峰基因表达,导致两个不同的共存亚群。面对抗生素暴露,一小部分细菌群体会转化成持久细胞(persister cells),仍然以极低的生长速度存活。
除了细菌的菌群异质性和已知的宿主(免疫)细胞的异质性,细菌在宿主细胞中的寄生状态的多样性和动态变化又使得这类研究的复杂程度更上一层楼。当细菌接触到宿主细胞时,细菌可能内化,也可能不发生内化。当细菌内化发生了,宿主细胞作出的应答有可能是生存,清除或者死亡。生存状态下,细菌在宿主细胞内的可能发生增殖,也可能被抑制。死亡状态下,细菌可能共亡也可能逃逸。不同的感染结局可能由于细菌的表达谱差异或者宿主细胞的表达谱差异导致。而相同的感染结局也有可能是来源于具有表达差异的不同病原体-宿主组合。听完是不是觉得特别想吐血?单细胞测序就像一个放大镜一样,可以让我们更细致的观察病原体感染的过程。因此我们非常需要它。
越来越多的单细胞测序方法涌现出来,对测序过程中任何环节的偏倚有了越来越好的修正方案。此外还有商业化的测序平台,如Fluidigm's C1系统和10x Genomics,使单细胞测序从细胞分选、裂解、RNA提取、cDNA合成到建库测序变成流水线作业。针对单细胞的成套数据分析方法也不断被开发出来,如Seurat和SCDE已整合了单细胞测序数据分析的多步分析流程。
就像是当年人类基因组计划的升级版,多项单细胞层面的研究计划目前正在进行中,如Chan Zuckerberg研究所支持的The Human Cell Atlas,NIH支持的Human BioMolecular Atlas Program。这些计划中科学家们将对所有人体细胞类型和组织类型进行DNA、RNA和蛋白水平的研究,从而在细胞水平研究复杂机体的生物奥秘。除此之外,针对感染和免疫领域,Immunological Genome Project项目计划针对小鼠模型,检测所有免疫细胞亚型的表达谱数据,建立数据库,为研究免疫细胞行为,进化和发现新的免疫细胞亚型提供支持。该数据库收录了小鼠模型在不同感染疾病状态下,免疫细胞的单细胞测序数据。
微生物病原体与宿主关系的研究进展(举例)
最早的两篇从单细胞层面研究宿主-细菌相互关系的文章研究了鼠伤寒沙门氏菌和宿主巨噬细胞的相互作用。研究中仅对宿主细胞进行了单细胞测序,而病原菌则是利用荧光标记进行检测。Avraham等人研究发现细菌的变异性决定了宿主细胞的应答差异。感染的巨噬细胞的转录组分析揭示了一组双峰表达基因,它们富集在I型干扰素应答反应功能下,并且仅在三分之一的感染细胞中被诱导。该应答反应状态与细菌的PhoPQ双组分系统密切相关,由细菌表面LPS介导。研究进一步发现宿主细胞如果内化了高PhoPQ活性的细菌,则呈高I型干扰素应答反应;而宿主细胞如果内化了低PhoPQ活性的细菌,则呈低I型干扰素应答反应。研究证明了宿主的细胞的免疫应答反应差异是来源于感染细菌的菌群差异,而非宿主细胞的的异质性。Saliba等人则通过bulk dual-RNAseq发现内化的增殖型和非增殖型沙门氏菌可以引起宿主巨噬细胞不同的表型,有利于自己的生存。
文章作者认为目前研究进展所揭示的问题还比较初级,他提出了更多的研究议题有待我们去挖掘。这些都是写基金写本子非常好的主题,简直就是写作的源泉,我罗列一下。
从细菌的角度:为什么细菌选择性的感染某些细胞,而不是所有的细胞?为什么细菌在一些细胞中被清除,而在另一些中进行增殖?寄生的细菌是如何调控宿主细胞,帮助它们进行抗生素抵抗的?
从宿主细胞的角度:如何鉴定感染的细胞和“旁观者”?宿主细胞的应答差异是由什么导致的?如果宿主细胞屈服,是什么决定了细胞死亡的模式?
病毒与宿主关系的研究进展(举例)
病毒感染与细菌感染不同,病毒在感染前和感染过程中,其转录本不存在异质性。它们的异质性存在于核酸序列层面。它们可能来源于病毒亚群的核苷酸多态性,vmRNA(viral mRNA)的突变,病毒基因组拷贝数差异等。有些病毒,如流感病毒,它们的vmRNA也有尾部加poly A的特征,得益于此,常规的sc-RNAseq方法可以同时捕获病毒RNA,和宿主细胞mRNA共同进行建库和测序。通过比对病毒vmRNA序列,可以鉴定宿主细胞的感染状态。通过UMI计算vmRNA的丰度,可以获得宿主细胞的病毒载量信息。
Steuerman等人通过对感染流感病毒2天后的小鼠肺细胞进行单细胞测序,通过聚类对细胞亚群进行分类,结合细胞中的vmRNA水平,获得细胞的病毒载量信息,他们发现几乎所有类型的细胞中都可以检测到vmRNA,涵盖了62%的上皮细胞到22%的T细胞。这一发现挑战了传统的认知,认为流感病毒主要感染上皮细胞。这可能是由于以往研究是利用病毒表达的GFP报告基因,在其他类型的细胞中难以检测到造成的。这篇文章同时从侧面证明了利用单细胞进行病原菌研究的必要性,单细胞测序相比传统技术能拥有的更高的精度。研究人员还发现,上皮细胞的病毒载量差别能达到2个数量级,而在其他非上皮细胞中病毒载量通常很低。
另外一项研究中,Russell利用体外感染流感病毒的上皮细胞进行单细胞测序。体外试验在基因组水平上限定了流感病毒的单克隆性,最大限度的控制了病毒异质性导致的混杂因素。他们仍然观察到vmRNA在细胞之间载量的巨大差异。大部分感染的细胞仅检测到<0.1% vmRNA,而有些细胞中能检测到50%的vmRNA。他们发现病毒载量的差异与病毒的基因表达和宿主感染相关的基因表达并不相关,而是和宿主氧化应激,G2-M细胞周期等基因的表达相关。这些结果背后的原因有待进一步研究。
从这两篇文章出发,作者又提出了一些有待被解答的问题。同样,它们也适合作为未来研究的主题。为什么有的细胞有高的病毒vmRNA载量,而其他细胞却似乎能限制病毒基因表达?vmRNA的差异导致了什么样的生物学结局?细胞中的病毒复制量是否从整理上决定宿主的感染结局?细胞裂解和潜伏感染之间的转化是如何调控的?
研究病原体为什么(有时候)用不了单细胞测序?
尽管sc-RNAseq技术发展迅猛,获得了越来越多的应用场景。比如一种名为Nuc-seq的方法可以对冰冻组织样本的细胞核进行分离标记,从而解除了单细胞研究只能做新鲜组织的限制。一种对细菌基因组分析的液滴法微流控技术,SiC-seq,也拓展到细菌单细胞转录组的应用领域。然而似乎技术的进步还没有普及到研究病原体-宿主相互作用领域。最理想的研究方案是能够对配对的宿主细胞及其内化的病原体进行同时测序(paired dual sc-RNAseq),如图c所示。
这种理想方案不能实现的原因之一来自于病原体(尤其是细菌)在宿主细胞中的表达丰度太低,并且与宿主细胞的mRNA含量形成巨大的悬殊。通过改进建库方法,算法流程以及增加测序深度取得了一些进展。scDual-seq技术的开发者声称,他们利用单个细胞和单个菌的纯化的RNA进行建库,该方法能够测序检测到470个沙门氏菌的转录本,提示尽管基因覆盖度较低,但针对单个细菌的检测是可行的。此外他们对内化了1-10个沙门氏菌的细胞进行测序,获得的转录本量和细菌数显示出了比较好的线性关系。但是该技术还没有经过体内实验验证。在自然状态下,绝大多数的细菌感染呈现宿主细胞和细菌1 vs 1的状态。低丰度的细菌转录本是目前技术发展最主要的挑战。
dual-sc-RNAseq的另一项挑战也是针对细菌的,它看似平凡,但非常困难。这一困难挡在了测序所有流程的最前面——细菌核酸提取的困难。由于具有夹馍,细胞壁等细胞结构,细菌的裂解变得困难。物理裂解法由于需要更大体积的溶剂无法配套常规的液滴法机械分选,化学裂解法则容易导致RNA降解或者污染,从而无法进行后续的建库实验。
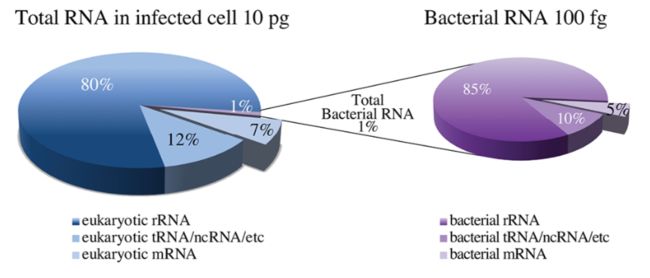
病原体RNA量和宿主RNA量之间悬殊的差异也是dual sc-RNAseq的挑战之一。下图示意真核细胞RNA和细菌RNA的丰度关系。一个哺乳动物细胞大约含有10pg的总RNA,而单个细菌却只有100fg的总RNA,约为哺乳动物的百分之一。因此,在一个宿主细胞感染一个细菌的情况下,细菌的mRNA实际只占总提取RNA中的约0.05%。举个例子,病原菌中表达量最大的转录本,其含量和宿主细胞中表达量最小的转录本相当。因此可想而知,提高文库构建的效率,是提高基因覆盖率和检测率的关键。同时我们需要提高检测样本的细胞数来获得具有统计学意义的结果。尽管通过计算机工具和算法能有效降低分析所需的细胞数目,但这非常依赖所给定的病原菌的基因组注释信息的完整程度。
除了宿主细胞RNA对病原体RNA的稀释作用,病原体mRNA的捕获还存在另一项挑战。和真核细胞一样,细菌mRNA也只占其总RNA的5-10%。对于真核细胞,其mRNA具有ploy A尾的特征,因此通过互补的poly T引物可以很好的对其进行富集和捕获。而原核细胞(细菌)的mRNA并没有poly A尾。因此常规建库无可避免的会引入大量的rRNA和tRNA。这个难题可以通过加大测序深度,反向去除rRNA或者利用探针正向捕获病原体mRNA来解决。
和细菌不同,有些病毒的vmRNA具有poly A尾的特征,如登革热病毒,西尼罗河病毒和丙型肝炎病毒。因此在研究它们和宿主之间的关系时,就有了得天独厚的优势。但是,这个特点并不覆盖所有的病毒种类。除此之外,研究发现病毒的基因组会出现类似于单核苷酸多态性的突变,而这种微小的变异会影响宿主的应答。因此在研究病毒时需要有更好的计算工具能够在单细胞水平去分析病毒基因组多样性与宿主应答之间的关系。
总结
单细胞RNAseq革命拓宽了我们对细胞异质性的理解,并且认识到稀有细胞类型在所有生物学领域(包括宿主- 病原体相互作用)的存在和重要性。 这篇综述强调了宿主和病原体各自的异质性导致了他们遭遇后的无数可能的结果。 单细胞视角研究细胞行为将是我们研究复杂生理和病理状态下的生物学现象未来主要的研究手段。