Cell子刊:微生物来源的细菌素靶向宿主抗早期断奶仔猪腹泻研究
微生物来源的细菌素靶向宿主抗早期断奶仔猪腹泻研究
导读
仔猪的早期断奶可以缩短猪的屠宰周期并改善母猪的繁殖性能,然而早期断奶容易导致应激性腹泻,仔猪死亡率上升,生长性能降低。使用抗生素可以预防仔猪断奶腹泻,但由于病原菌抗生素抗性和抗生素残留问题,寻找替代抗生素的益生菌来预防仔猪腹泻是个新思路。华中农业大学农业晏向华教授课题组运用粪便微生物移植技术研究早期断奶仔猪肠道微生物介导的腹泻抗性机理,发现了两种介导抗腹泻的细菌Lactobacillus gasseri LA39和Lactobacillus frumenti可作为潜在抗生素替代物,这对实施肠道菌群干预改善早期断奶仔猪肠道健康具有重要意义。
论文信息
原名:A Microbiota-Derived Bacteriocin Targets the Host to Confer Diarrhea Resistance in Early-Weaned Piglets
译名:微生物来源的细菌素靶向宿主抗早期断奶仔猪腹泻研究
期刊:Cell Host & Microbe
IF:15.753
发表时间:2018年12月13日
通讯作者:晏向华
DOI: 10.1016/j.chom.2018.11.006.
背景
早期断奶策略缩短了猪的屠宰周期,提高了母猪的繁殖性能,已普遍应用于生猪生产。然而,早期断奶引起的应激会导致腹泻,从而增加仔猪死亡率和降低生长性能。在过去的几十年中,抗生素被有效地用于治疗腹泻或改善断奶仔猪的生长性能。然而早期的抗生素治疗不仅破坏了肠道菌群的组成,影响了宿主肠道微生物群落的代谢稳态,更严重的是抗药性病原体和抗生素残留在食品中的传播。因此,在畜牧业中逐渐禁止使用抗生素。瑞典于1986年禁止在畜牧业中使用抗生素,欧盟自2006年起全面禁止在畜牧业中使用抗生素。然而,自1986年以来,瑞典早期断奶仔猪的腹泻发病率增加了50%,饲养成本增加了8%-15%。因此,寻找预防早期断奶仔猪腹泻的抗生素替代品对畜牧业和食品安全至关重要。2013年,该课题组研究发现将健康的从江香猪CM(Congjiang Miniature)粪便微生物移植到商品杂交仔猪LY(Landrace×Yorkshire)肠道内,可显著降低仔猪早期断奶腹泻发生率。与此同时,仔猪粪便微生物区系发生显著变化,即LY仔猪粪便微生物多样性、物种组成、基因功能等向从CM仔猪的粪便微生物区系转变。课题组就此展开研究,筛选与腹泻抗性相关的关键候选微生物,以及对断奶仔猪肠道微生物介导的腹泻抗性分子机制的阐明。
实验设计
对LY与CM仔猪进行实验分组:
①LY:LY仔猪,不经任何处理,n=3;
②LY(saline): LY仔猪,day10-18隔日口服生理盐水,n=3;
③LY(high dose): LY仔猪,day10-18隔日口服高浓度CM仔猪粪菌悬液,n=3;
④LY(low dose): LY仔猪,day10-18隔日口服低浓度CM仔猪粪菌悬液,n=3;
⑤LY(oxytetracycline): LY仔猪,day21日肌肉注射长效土霉素,n=3;
⑥CM :CM仔猪,不经任何处理,n=3;
以上各组在仔猪断奶后第3、5、6、8、11天收集粪便样本
主要方法:16S V4、ITS基因扩增测序、构建突变菌株、QPCR、Western blotting、co-IP、细胞因子检测
主要分析: 物种注释、Venn图、功能预测、pCoA分析、LEfSe分析、alpha多样性等
结论
1.FMT导致LY仔猪腹泻减少,肠道微生物群组成改变
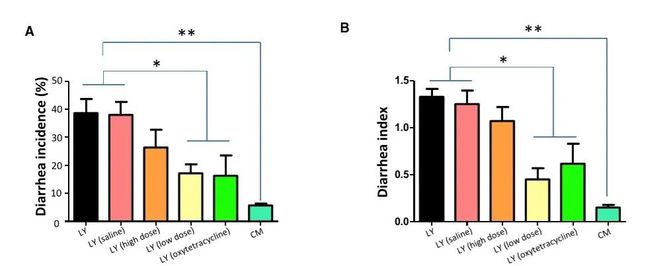
将耐受腹泻的本地品种健康仔猪CM的粪菌移植进商品化引入的杂交品种LY,在早期断奶之前通过口服给药的方式,结果表明,将CM仔猪的粪菌(低剂量)转移到LY仔猪,可显著降低早期断奶仔猪的腹泻率和腹泻指数。(腹泻率和腹泻指数是评定动物腹泻情况的指标,腹泻率越大、腹泻指数越高,表示动物腹泻越严重)(图1A和1B)
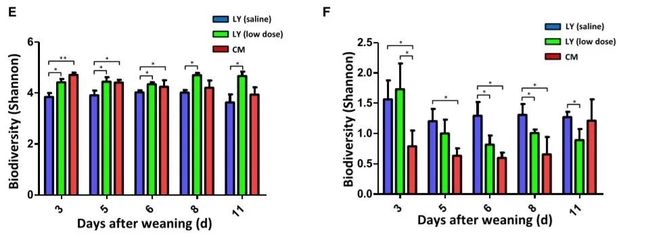
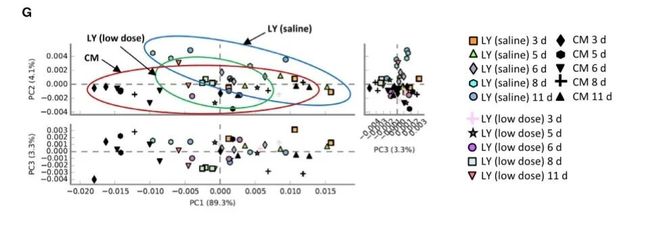
对移植后LY品系仔猪小肠内菌群进行16s rDNA和ITS基因扩增测序,分析了仔猪肠道微生物群在早期断奶后3、5、6、8、11天这5个时间点。数据表明,FMT导致肠道微生物α多样性(尤其是细菌α多样性)以及β多样性(尤其是细菌β多样性)从LY仔猪转移向CM仔猪(图1C-F)。同时肠道细菌群落功能从LY仔猪向CM仔猪变化(图1G)。综上所述,LY品系移植后肠道内菌群多样性向CM品系转变。
图1. FMT可减轻腹泻,并引起早期断奶后1-11天
仔猪肠道微生物组成发生变化
2.功能菌株的筛选
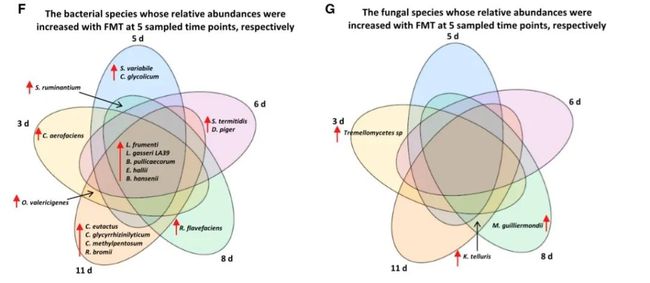
为了筛选对早期断奶应激性腹泻具有抵抗力的特定肠道微生物,通过对对照组与移植后LY系仔猪肠道菌群进行对比,数据显示,在早期断奶后至少一个取样时间点(3、5、6、8和11天),低剂量LY仔猪体内17种细菌的相对丰度显著高于生理盐水仔猪(图2F)。其中5种细菌(L.frumenti、L.gasseri LA39、白痢丁酸杆菌、hallii真杆菌和hansenii蓝尾菌)在早期断奶后的所有取样时间点,在LY(低剂量)仔猪中的相对丰度均显著高于LY(生理盐水)仔猪(图2F)。然而在断奶后的任何取样时间点,LY(低剂量)仔猪中没有真菌物种的相对丰度显著高于LY(生理盐水)仔猪(图2G)。确定了这五种细菌与早期断奶应激引起的腹泻的抵抗力密切相关。
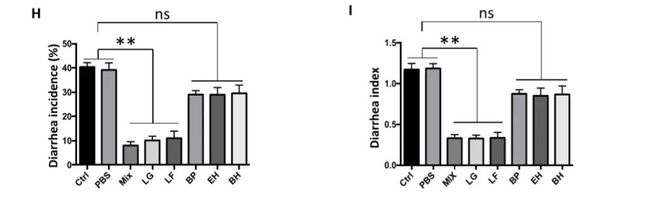
随后研究人员将5种菌种分别进行移植,发现乳酸菌Lactobacillus.gasseriLA39或Lactobacillus.frumenti单独移植即可促使仔猪产生腹泻耐受。(图2H和2I)。
图2.对仔猪腹泻抗性特定微生物的筛选与验证
3.机制的研究
3.1 肠道微生物介导的腹泻抗性依赖于分泌环状gassericin A
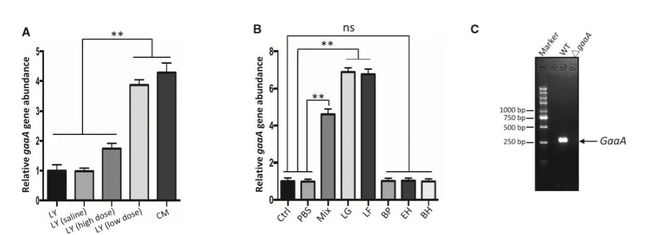
作者接下来研究了L.gasseri LA39和L.frumenti介导的早期断奶仔猪腹泻抗性的机制。有研究人员发现L. gasseri LA39和L. frumenti 可分泌环状gassericin A细菌素,作者假设L.gasseri LA39介导的腹泻抵抗可能来自gassericin A对肠上皮细胞液体吸收和分泌的过程的影响。研究发现,LY(低剂量)仔猪和CM仔猪的粪便细菌gassericin A编码基因(gaaA)丰度显著高于LY(生理盐水)仔猪和LY仔猪(图3A)。五菌群(Mix)组和L.gasseri LA39组的粪菌gaaA基因丰度均显著高于对照组和PBS组(图3B),说明分泌型gassericin A可能有助于早期断奶仔猪的腹泻抵抗。而将gaaA敲除后菌种再次移植无法引起对腹泻的耐受(图3C-F)。此外,将可表达gassericin A的重组大肠杆菌植入仔猪肠道也可引起腹泻的耐受,以及无菌小鼠实验的结果均表明,gassericin a对gasseri-LA39介导的无菌小鼠腹泻抵抗至关重要。图I、J数据表明,L.frumenti也编码了gaaA基因和分泌的环状肽gassericin A。
图3. gasseri-LA39和L.frumenti介导的早期断奶仔猪
腹泻抗性依赖于gasserinA的分泌
3.2 胃泌素A与肠上皮细胞质膜结合,促进肠液吸收,减少肠液分泌。
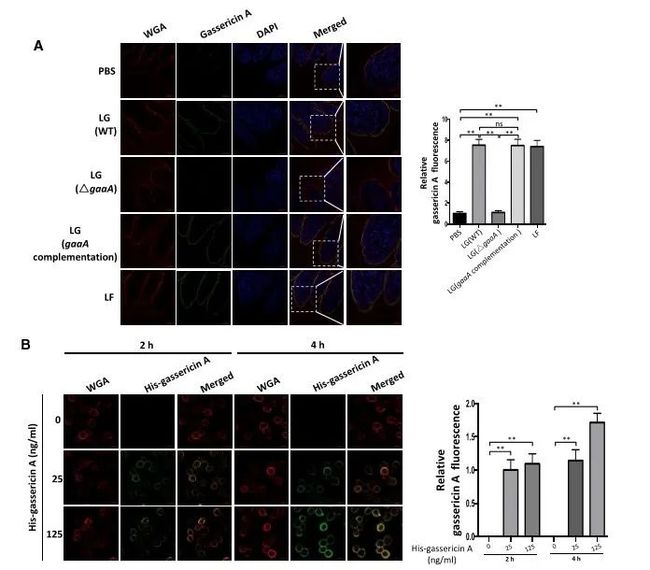
与十二指肠和回肠相比,空肠是早期仔猪腹泻引起肠道炎症和组织形态学损害的主要部位。作者使用空肠上皮细胞来研究早期断奶仔猪gassericin A介导的腹泻抵抗的潜在机制。经体内和体外培养后免疫荧光发现gassericin A均可以结合于空肠上皮细胞质膜(图4A图4B)。使用gassericin A处理猪空肠细胞系IPEC-J2后可检测到IPEC-J2细胞中参与与肠液吸收相关的蛋白质(NHE3、SLC5A1、DRA、PAT1)的表达上调,与肠液分泌相关的蛋白质(NKCC1、CFTR、CaCC1)的表达下调(图4C和4D)。gassericin A处理后明显降低了胞内cAMP、cGMP量,Ca2+水平没有显著变化。同时,研究人员利用体内数据也从蛋白水平验证以及无菌小鼠实验均表明gassericin A改变了上皮细胞参与液体吸收分泌的蛋白表。
图4. gassericin A与仔猪肠上皮细胞质膜结合,增加肠液吸收,减少肠液分泌
3.3 Gassericin A通过KRT19受体激活雷帕霉素机制靶点介导的磷酸二酯酶活性而降低细胞环核苷酸水平,从而增加肠液吸收和减少肠液分泌。
通过KRT19将gassericin A与细胞质膜结合是促进gassericin A介导的肠液吸收和减少分泌的关键。为了揭示gassericin A如何与肠上皮细胞质膜结合,我们用His标记的gassericin A和未标记的gassericin A作为诱饵进行免疫沉淀分析,以寻找它们相互作用的蛋白质。研究发现IPEC-J2细胞中的KRT18或KRT19可能与gassericin A相互作用(图5A)。免疫共沉淀(coIP)试验证实,gassericin A与KRT19(一种位于细胞质膜和细胞质中的蛋白质)相互作用,而不是KRT18(图5B)。进一步分析gassericin A与IPEC-J2细胞质膜中的KRT19相互作用(图5C)。而敲除或者抗体封闭KRT19后,gassericin A处理无法下调胞质内cAMP和cGMP丰度、肠液吸收增强和肠液分泌减少。
图5. gassericin A可结合于空肠上皮细胞膜表面KRT19蛋白
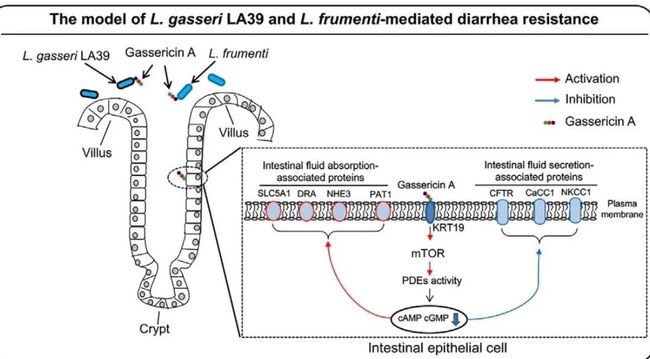
作者接下来研究了雷帕霉素介导的肠液吸收和分泌改变的机制肠上皮细胞质膜中gassericin A与KRT19的结合。Gassericin A介导的环核苷酸水平降低可能是由于环化酶分泌减少或磷酸二酯酶(PDEs)降解增加所致。研究人员观察到gassericin A处理引起磷酸二酯酶活性增加,使cAMP和cGMP水解增加,而未影响环化酶活性。进一步证实该机制依赖于mTOR通路,数据显示,mTOR磷酸化及其两个下游蛋白的磷酸化显著上调,这表明用gassericin A处理后mTOR活性显著增强。而使用雷帕霉素抑制mTOR活性后则逆转了gassericin A对cAMP和cGMP下调作用。总之,这些发现揭示了gassericin A与肠上皮细胞质膜中KRT19蛋白结合,然后通过激活mTOR介导的PDE活性降低细胞环核苷酸水平,从而增加肠液吸收和减少肠液分泌(见上图)。
总结
哺乳动物肠道微生物数量众多、功能强大,这些微生物有助于维护宿主的健康,越来越多的研究表明利用肠道微生物群的靶向重组有对抗胃肠道疾病的潜力。在临床医学上,粪菌移植是治疗艰难梭菌感染(CDI)、炎症性肠病和肠易激综合征等胃肠道疾病的重要方法,然而粪菌移植的治病机制以及肠道微生物的作用机制仍待阐明。在该文发表之前,晏向华教授课题组就于Front Microbiol发文建立了标准的猪菌群移植体系,包括健康供体猪的选择,以及粪便的稀释与储存等详细内容。就稀释倍数(浓度、剂量)而言,本文使用低剂量粪便悬浮液的FMT的抗腹泻作用更显著,高剂量的的微生物移植有可能破环原有肠道稳态,这也提示我们,在使用FMT或益生菌进行肠道微生物靶向治疗时,最佳的微生物剂量需要被考虑。
本研究不仅系统地研究了粪菌移植对早期断奶仔猪肠道微生物组成(细菌与真菌)的影响,筛选出了gasseri-LA39和L.frumenti作为早期仔猪腹泻抗性相关的潜在微生物;而且更深入地在分子层面探索了具体机制:gasseri-LA39和L.frumenti分泌的gassericin A以宿主肠上皮细胞为靶点,与肠上皮细胞质膜中KRT19蛋白结合,然后通过激活mTOR介导的PDE活性降低细胞环核苷酸水平,增加肠液吸收和减少肠液分泌,从而赋予早期断奶仔猪腹泻抵抗力。同时在无菌小鼠上也证明gassericin A可抗腹泻,运用动物模型进行粪菌移植探究肠道菌群与疾病或机体性状间联系是研究的热点,将无菌动物作为粪菌移植受体是探究肠道菌群与疾病性状间联系的关键。越来越多的证据表明,肠道微生物功能在宿主物种之间保守,本研究的结果不仅提供了可预防仔猪腹泻的替代抗生素的益生菌,也为有腹泻风险的哺乳动物提供了一种潜在的预防策略,可以说使用益生菌精确控制肠道微生物群已成为胃肠道疾病治疗的一个有前途的策略。
猜你喜欢
10000+:菌群分析 宝宝与猫狗 梅毒狂想曲 提DNA发Nature Cell专刊 肠道指挥大脑
系列教程:微生物组入门 Biostar 微生物组 宏基因组
专业技能:学术图表 高分文章 生信宝典 不可或缺的人
一文读懂:宏基因组 寄生虫益处 进化树
必备技能:提问 搜索 Endnote
文献阅读 热心肠 SemanticScholar Geenmedical
扩增子分析:图表解读 分析流程 统计绘图
16S功能预测 PICRUSt FAPROTAX Bugbase Tax4Fun
在线工具:16S预测培养基 生信绘图
科研经验:云笔记 云协作 公众号
编程模板: Shell R Perl
生物科普: 肠道细菌 人体上的生命 生命大跃进 细胞暗战 人体奥秘
写在后面
为鼓励读者交流、快速解决科研困难,我们建立了“宏基因组”专业讨论群,目前己有国内外5000+ 一线科研人员加入。参与讨论,获得专业解答,欢迎分享此文至朋友圈,并扫码加主编好友带你入群,务必备注“姓名-单位-研究方向-职称/年级”。PI请明示身份,另有海内外微生物相关PI群供大佬合作交流。技术问题寻求帮助,首先阅读《如何优雅的提问》学习解决问题思路,仍未解决群内讨论,问题不私聊,帮助同行。
![]()
学习16S扩增子、宏基因组科研思路和分析实战,关注“宏基因组”
![]() 点击阅读原文,跳转最新文章目录阅读
点击阅读原文,跳转最新文章目录阅读