姓名:祝双 学号:16040520067
文章转载自https://www.ithome.com/html/discovery/328710.htm:新浪科技作者:晨风/悠悠责编:守一
【嵌牛导读】:北京时间10月4日消息,据国外媒体报道,诺贝尔化学奖刚刚揭晓!2017年诺贝尔化学奖授予雅克·杜邦内特(Jacques Dubochet),约阿希姆·弗兰克(Joachim Frank),以及理查德·亨德森(Richard Henderson),以表彰他们“在开发用于溶液中生物分子高分辨率结构测定的冷冻电镜技术方面的贡献”。
【嵌牛鼻子】:化学,原子
【嵌牛提问】:原子层面的生物化学研究有何现实意义
【嵌牛正文】:
他们在原子层面看清了生命的本质
2017年的诺贝尔化学奖授予雅克·杜邦内特(Jacques Dubochet),约阿希姆·弗兰克(Joachim Frank),以及理查德·亨德森(Richard Henderson),以表彰他们“在开发用于溶液中生物分子高分辨率结构测定的冷冻电镜技术方面的贡献”。这是一种呈现生物分子三维立体图像的技术方法。使用冷冻电镜技术,研究人员能够将运动中的生物分子进行冷冻,并在原子层面上进行高分辨率成像。这项技术将生物化学带入了一个崭新时代。
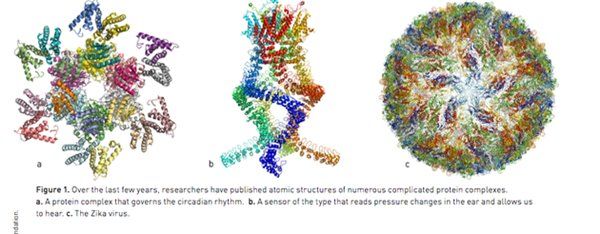
图一:过去几年间,科学家陆续发布了多种复杂蛋白质复合体的原子结构。a。一种控制昼夜节律的蛋白质复合体。b。一种可感知耳中压力变化、使我们听到声音的感应器。c。寨卡病毒。
在过去的数年间,大量令人惊叹的分子结构充斥着各类文献(如图一):沙门氏菌用于侵袭细胞的注射端;导致化疗以及抗生素失效的蛋白质结构图;以及掌管生物昼夜节律的复杂分子结构等等。这里所展示的还只不过是冷冻电镜技术(cryo-EM)应用领域内很少的案例。当研究人员开始怀疑寨卡病毒和发生在巴西境内导致大量新生儿出现大脑损伤的“小头症”有关联时,他们利用冷冻电镜技术对病毒进行了直接成像。在短短数月内,原子层面分辨率的寨卡病毒的立体三维图像便产生出来了,科学家们基于这些成果迅速研发相应药物。
雅克·杜邦内特、约阿希姆·弗兰克以及理查德·亨德森的突破性贡献让冷冻电镜技术得以成为现实。这项技术将生物化学技术带入了一个崭新的时,让科学家们获取高分辨率生物分子图像变得前所未有的容易。
图像是知识的载体和基础。在20世纪上半叶,生物分子——比如说蛋白质,DNA以及RNA都是生物化学地图上无法填充的空白区。科学家们知道这些物质在细胞内扮演者关键性作用,但我们无从知晓这些物质本身究竟是什么样的结构。直到1950年代,当英国剑桥大学的科学家们开始探索利用X射线研究蛋白质晶体结构时,这一问题才开始崭露曙光——这是历史上第一次,人类开始有可能将这些物质繁复缠绕的复杂结构用可视化的方式呈现出来。
到了上世纪1980年代,X射线晶体学成像方法得到了核磁共振(NMR)技术的帮助,用于研究固体状态或者溶液中的蛋白质结构。这项技术不仅揭示蛋白质的结构,还能研究蛋白质的运动及其与其他分子之间的相互作用。正是因为有了这两种技术的帮助,我们现在才会有囊括了数以千计生物分子模型的数据库可以使用,这些数据库现在被应用在从技术研究到制药公司的各行各业。
然而,这两种技术都有着基础性缺陷。对溶液内样品使用核磁共振技术对样品本身有限制,它只能应用于相对较小的蛋白质。而X射线晶体学方法要求必须首先将样品制作为晶体,比如进行低温冻结。即便如此,最终拍摄出来的图像看上去的效果仍然就像早期相机拍出的黑白照片,科学家们很难从这些模糊不清的图像中提取到关于蛋白质动态下的有价值信息。
另外,很多分子是很难制备成晶体样本的,这一缺陷最终让理查德·亨德森在1970年代下决心放弃X射线晶体学方法——而这,正是今年诺贝尔化学奖获奖成果故事的开端。
亨德森另辟蹊径
理查德·亨德森在英国剑桥大学获得X射线晶体学领域的博士学位。他利用这种方法对蛋白质进行成像,但是当他尝试对一种自然地内嵌于细胞膜上的蛋白质进行晶体制备时,却遭遇到巨大困难。膜蛋白难以操控。它们一旦离开原有的自然环境,也就是细胞膜之后,它们就会萎缩成一团毫无用处的物质。
理查德·亨德森尝试成像的第一种膜蛋白难以制备足够用量的样本,而第二种膜蛋白则难以结晶。在经过数年的徒劳沮丧之后,亨德森开始尝试他最后的一种“杀手锏”——电子显微镜。在当时,电子显微镜是否真的能够在这一领域使用仍然是一个有争议的话题。这项技术被称为透射电镜,其原理或多或少与传统的显微镜类似,不同的只是会有一束电子束流射向样品,而不是传统显微镜那样是一束光线。
电子的波长远小于光子,因此电子显微镜能够分辨非常微小的结构——甚至是单个的原子。理论上讲,电子显微镜的分辨率要满足亨德森拍摄膜蛋白结构的需求是绰绰有余的,但是在现实中,这一目标却几乎是无法实现的。
当电子显微镜在1930年代被最早发明出来时,科学家们认为其只适合对“死的”物质进行研究。获得高分辨率图像所需的强烈电子束流会破坏生物材料样品,而如果降低电子束流强度,成像质量则会大幅下降。
除此之外,电子显微镜需要用到真空腔,而这也不适合应用于生物分子,因为在这样的环境下生物分子周围的水会迅速挥发掉。而当生物分子干涸时,它们的结构将崩塌,丧失自然结构特征,从而让成像结果变得毫无意义。所有这一切几乎都在告诉亨德森,他的大胆尝试注定将要失败。但是,他的尝试却由于他当时选中进行研究的蛋白质类型比较特殊而出现了转机,他研究的对象是细菌视紫红质。
这样还不够好
细菌视紫红质是一种内嵌在光合作用有机体细胞膜上的紫色蛋白质,其能够捕捉太阳光线中的能量。亨德森不再试图像以前那样将其从细胞膜上剥离,而是将其直接连同其所在的细胞膜一起放置到电子显微镜下进行观察。由于该蛋白质此时仍然处于细胞膜上的自然环境下,它继续保持着自己的自然立体结构。亨德森小组用葡萄糖溶液覆盖样本表面以防止其在真空腔内干涸。
但是强大的电子束流是一个问题,不过研究组从这种蛋白质在细胞膜上内嵌方式中获得了启发。他们没有采用高强度电子束流,而是使用了强度更低的束流。这样得到的图像对比度很差,无法分辨单个分子,但研究组利用了一个此前已知的事实,那就是这种蛋白质在细胞膜上是规整排列且朝向一致的。当所有蛋白质都发生同向衍射时,基于衍射模式计算,研究组能够反推得到更加精细的图像——这种方法与在X射线晶体学成像技术中使用的数学方法是类似的。
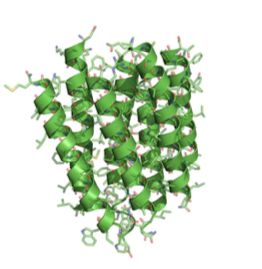
图二:图为1975年发布的首个细菌视紫红质粗略模型。图源《自然》第257期28至32页。
下一步,研究组将细胞膜样品再次放置到电子显微镜下,从很多不同的角度进行拍摄。通过这种方法,到1975年时他们已经能够得到细菌视紫红质的三维立体结构图像了(图2)。从图像中可以清晰观察到蛋白质链条是如何在细胞膜上来回穿行的。这是历史上使用电子显微镜获得的最佳蛋白质图像。很多人对这样的高分辨率图像印象深刻(其图像分辨率达到了7埃水平,相当于0.0000007毫米)。这是一个惊人的成就,但在亨德森看来,这样的结果还不够好。他的目标是达到X射线晶体学成像方法通常能够达到的分辨率水平——大约3埃左右,并且他坚信利用电子显微镜成像技术,这个目标是可以实现的。
第一张原子层面分辨率图像
在接下来的数年间,电子显微镜技术逐渐完善。镜片质量得到了改善,低温冷冻技术也有了新的进步。在进行观察之前,先利用液氮对样本进行快速冷冻,从而避免其受到电子束流的损伤。得益于这些技术进步,理查德·亨德森逐渐为她研究的细菌视紫红质蛋白图像加入更多细节。为了获得最佳分辨率,亨德森遍访世界各地最好的电子显微镜设备。最终,到了1990年,在他发表第一份细菌视紫红质立体模型整整15年后,亨德森达成了自己当年许下的目标:他对外发布了分辨率达到原子层面的细菌视紫红质立体图像(图三)。
图三:1990年,亨德森发布了原子级分辨率的细菌视紫红质结构。
通过这些工作,亨德森证明了,利用冷冻电镜技术是可以拍摄出分辨率媲美X射线晶体学传统方法的图像的。这是一项重要的里程碑。然而,这一成功有一个前提,那就是他选择的蛋白质很特殊,细菌视紫红质是有规则地内嵌在细胞膜上的。但是其他蛋白质却并非如此。
这个问题很重要,因为它决定了这种方法是否具有普适性,是否能够被推广应用:科学家们有可能利用电子显微镜获得那些分布上没有规律的蛋白质的三维立体结构图像吗?亨德森坚信这个问题的答案是肯定的,而他的同行们认为亨德森的想法太过乐观了。
与此同时,在大西洋的彼岸,纽约州卫生署。约阿希姆·弗兰克也一直在思考着同样的问题。在1975年,他发展出一种理论方法,能够将电子显微镜获得的二维平面模糊图像进行分析和叠加处理,最终得到更高分辨率的三维立体图像。但弗兰克最终花费了超过10年时间才逐渐将这一方法一步步完善。
弗兰克的图像分析算法
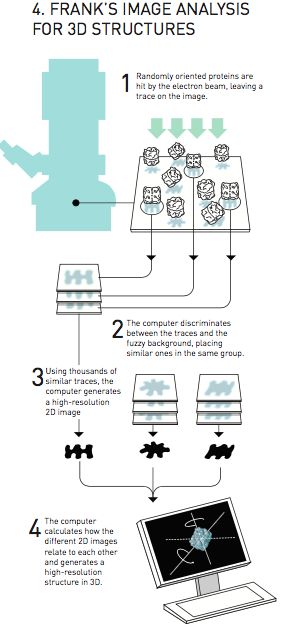
图四:弗兰克生成三维结构的图像分析法
约阿希姆·弗兰克的方法(图四)基本原理是让计算机去自动分析电子显微镜获得的模糊二维图像,识别其中的蛋白质与周遭背景。他开发出一套数学方法,能够让计算机识别在图像中反复出现的模式。随后计算机将相类似的图像模式归类到一起并将这些图像中的信息进行合并叠加,从而生成更加清晰地图像。
通过这种方法,弗兰克获得了一系列高分辨率的二维图像。这些图像展示的是同一种蛋白质,但是角度不同。整套算法软件到1981年终于完成。下一步,弗兰克必须弄清楚这些不同角度的二维图像之间是如何相互关联的,基于这些信息,他要尝试将这些二维图像合并并构建三位立体图像。弗兰克在1980年代中期对外发布了部分他开发的图像算法,并基于这一算法发布了核糖体的表面结构模型,这是一种在细胞内的细胞器,主要功能是合成蛋白质。
约阿希姆·弗兰克的图像处理方法对于冷冻电镜技术的发展是基础性的。
现在,让我们把时间再回溯到1978年,此时的弗兰克正忙于完善他的图像处理算法软件,而就在这一年,今年诺贝尔化学奖的第三位获奖人雅克??杜邦内特被设在德国海德堡的欧洲分子生物学实验室录用了。杜邦内特将要解决的是电子显微镜领域的另外一个基础性问题:当被放置于真空腔内时,生物样本是如何干涸并遭到破坏的?
杜邦内特的玻璃化方法
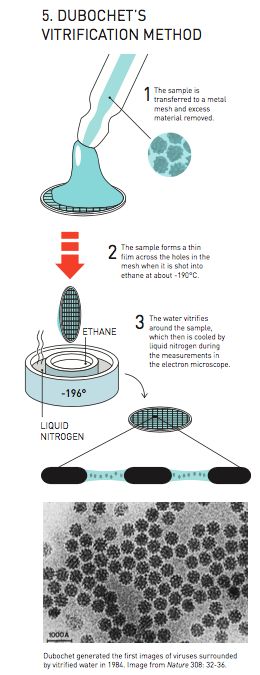
1984年杜邦内特首次通过玻璃水方法拍摄到样本周围的病毒。
在1975年,亨德森使用葡萄糖来保护样品,防止他的细胞膜样品干涸。但这种方法不适用于水溶性的生物分子。其他研究者曾经尝试冷冻样品,因为冰的蒸发速度要比水慢,但冰的晶体结构会扰乱电子束流,导致产生的图像是无效的。
水的蒸发问题让人为难,然而雅克??杜邦内特却看到了一个潜在解决方案:快速冷却水,使其在液态形式下固化,形成一种玻璃,而不是晶体。
玻璃材料是一种固体材料,但事实上却是液体,因为它具有混乱无序的分子。杜邦内特意识到,如果将水变成玻璃——也叫做“玻璃水”,电子束将均匀衍射,并提供一个标准背景。
最初,研究小组试图在零下196摄氏度的液氮中玻璃化微小水滴,但一直没能成功,最后用乙烷代替液氮后才最终实现,而乙烷本身则需要先用液氮来进行冷却。在显微镜下,他们观察到一种前所未见的情景。他们一开始认为这应该是乙烷,但是当液滴经过轻微加热,其分子却突然出现重新排列,形成了一种熟悉的冰晶结构。这是一项重要的成就,因为当时很多研究人员认为不可能实现水滴的玻璃化,而现在我们认为,玻璃化的水是宇宙中最常见的水的形式。
一种简单技术提升对比度
在1982年取得技术突破之后,杜邦内特的研究小组快速研制一种基础性技术,该技术仍用于冷冻电子显微镜(cryo-EM)。他们将生物样本制成溶液——期初是不同类型的病毒。这些溶液涂抹在金属网上形成薄膜。随后使用一种类似弹弓的结构将其射入液态乙烷快速冷却,从而使薄膜水玻璃化。
1984年,杜邦内特首次发布了不同病毒的结构图像,有圆形,有六边形。这些图像中病毒图像均与背景玻璃水存在清晰反差。到这里为止,生物材料就比较容易通过电子显微镜进行观察了。很快,各地的科学家们便开始前往杜邦内特的实验室学习这项最新的技术。
从“水滴学”到大变革
冷冻电镜最重要的问题是拍摄图像的质量较低。1991年,约阿希姆??弗兰克使用杜邦内特的玻璃化方法成像核糖体,并使用自己的软件分析这些图像,他获得一个分辨率为40??(??= 10^-10m)的三维立体图像。
这是电子显微镜领域令人振奋的一项突破,但是图像仅能显示核糖体轮廓。坦白地讲,它更像一团色块,分辨率上完全不能与X射线晶体学的原子级分辨率相提并论。
由于冷冻电镜除了观察不平整的表面之外,罕有用武之地,因此这种方法有时被嘲笑是“只能看见一坨东西的技术”(blobology)。
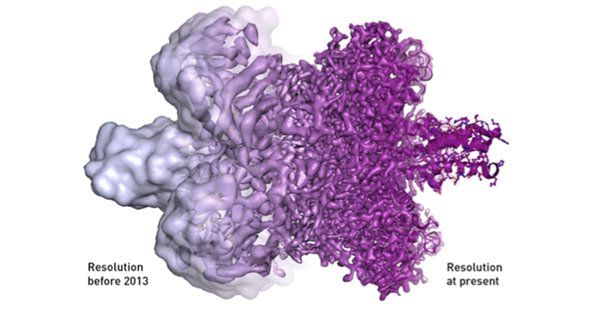
然而,很大程度上是由于理查德·亨德森坚信有朝一日电子显微镜将能够提供原子层面分辨率的图像并不断进行着尝试,电子显微镜技术经历着不断进步,它的分辨率正一埃一埃地不断改善,最后一个障碍在2013年被成功突破——一种全新的电子显微镜问世了(图六)。
图六
洞察细胞的每个隐秘角落
现在,梦想已成现实。我们正面对生物化学领域的爆炸式发展。冷冻电镜的诸多优势使其具有了革命性的意义:杜邦内特的玻璃化技术使用相对容易,同时需要的样本量较少;由于快速冷冻过程,生物分子在过程中冻结,研究人员拍摄一系列图像,能够捕捉到该进程的不同部分。
基于这种方法,他们制造“薄膜”,能够揭晓蛋白质如何移动,以及与其它分子发生交互。使用冷冻电子显微镜,能够更容易地描述膜蛋白,膜蛋白经常作为药物和较大分子复合物的实验标靶。然而,较小的蛋白质无法在电子显微镜下研究,但是它们可以使用核磁共振波谱学或者X射线晶体学进行可视化。
之后约阿希姆·弗兰克提出了他的普通成像处理技术策略,他指出,如果这项技术能够非常完美,那么对于一位科学家而言,其应用领域是“没有限制的”。
现在,海阔任鱼跃,天高任鸟飞——雅克·杜邦内特、约阿希姆·弗兰克和理查德·亨德森所研发的这项技术将带给人类最大的益处。我们将能够以原子层面的分辨率洞察细胞的每一个隐秘角落,生物化学将迎来一个光辉的未来!