腹泻症状是大多数患者通过稀便(从可流动到水样),尽管也存在异常频繁的排便(每天2次排便)。腹泻代表肠功能的改变,由于多种原因,肠道对水的净吸收减少,导致粪便含水量高。肠易激综合征(irritable bowel syndrome,IBS)是一组持续或间歇发作,以腹痛、腹胀、排便习惯和(或)大便性状改变为临床表现,而缺乏胃肠道结构和生化异常的肠道功能紊乱性疾病。个体IBS患者中发现产生症状的特定机制是困难的,因为缺乏具有足够敏感性和特异性的测试来鉴定这些原因,并且证明鉴定该机制可以导致迅速而有效率的治疗。
近日,一篇发表发表于《The Journal of Clinical Investigation》来自中国香港特区香港浸会大学中医学院的研究成果:A Clostridia-rich microbiota enhances bile acid excretion in diarrhea-predominant irritable bowel syndrome(富含梭菌的微生物群促进腹泻型肠易激综合征胆汁酸排泄),其结果阐明了富含梭状芽胞杆菌的微生物群可以通过靶向反馈调控粪便胆汁酸的合成来诱导粪便胆汁酸的过度排泄。研究结果还提示了一种新的治疗策略,即以粪便胆汁酸转化细菌为靶点治疗腹泻型肠易激综合征患者的胆汁酸腹泻。研究人员认为,准确描述肠道微生物区系及其代谢物,结合肠道微生物区系的结构和功能特征,将提高现有肠易激综合征基于症状的治疗的精确度。
摘要
粪便胆汁酸(BAs)过多被认为是腹泻型肠易激综合征(IBS-D)的发病机制之一。然而,导致BA排泄过多的因素仍未完全研究。这篇研究证实了富含梭状芽孢杆菌的微生物群导致IBS-D患者BA排泄过多。通过BA相关代谢分析和宏基因组学分析,发现24.5%的IBS-D患者存在总BAs排泄过多和粪便中BA转化菌改变。通过一系列的动物和细胞实验,阐明了富含梭状芽胞杆菌的微生物群可以通过靶向反馈调控BA的合成来诱导BA的过度排泄。研究结果还提示了一种新的治疗策略,即以BA转化细菌为靶点治疗IBS-D患者的BAD。
背景
以排便习惯不规则为特征的肠易激综合征(IBS)影响着全球10%的人口,其中以腹泻为主的IBS(IBS-D)在西方国家和亚洲的患病率较高。临床研究表明,在IBS患者中,粪便总胆汁酸的增加与腹痛和结肠传输加速运动显著相关。动物研究表明,BAs直接诱导结肠运动加速和内脏超敏反应。相反,使用隔离剂减少BA的分泌可以部分缓解IBS-D患者的症状。这些观察结果证明了BA在IBS发展过程中的重要性。然而,过量的BA分泌是如何产生的还不完全清楚。通常情况下,BA主要由限速酶胆固醇7α羟化酶(CYP7A1)合成,然后与肝脏中的氨基酸结合。大部分结合的BA被释放到肠道,从远端回肠被重新吸收,并通过门静脉回流到肝脏,这一过程被称为肠肝循环。少量逃过肠道吸收的BAs最终每日随粪便排出,可通过肝新生合成补充。肝脏和回肠中的BA合成速率受法尼醇X受体介导(FXR介导)反馈机制的可逆控制。肠道菌群在胃肠道中负责初级BAs向次级BAs的转化,并与宿主相互作用以控制BA的合成。
实验设计
1.受试者和样本采集
290名符合罗马IV诊断标准的IBS-D成人患者和91名健康受试者(HC)提供空腹血液和早晨第一次粪便。被要求在抽样前至少一个月停止使用抗生素、益生菌、益生元和其他与肠道菌群相关的补充剂。人体样本(血清和粪便)用干冰运送到实验室,并在-80°C冷冻。其中粪便总胆汁酸排泄量(≥为10.61molmol/g)的71名IBS-D患者归为BA+IBS-D组,剩余219名粪便胆汁酸排泄量正常(<10.61mol/g)的IBS-D患者归为BA-IBS-D组。
2.粪便移植实验
ABX由万古霉素(50
mg/kg)、新霉素(100 mg/kg)、甲硝唑(100
mg/kg)、两性霉素B(1 mg/kg)和氨苄西林(1
mg/mL)组成。成年雄性C57BL/6J小鼠在粪便移植前连续10天给予ABX,诱导为伪无菌小鼠模型(共71只)。HC和IBS-D供体(n=11-12个/组)的粪便样本分别制备为微生物菌群PBS悬液(50 mg/mL)。用2 0 0μL菌群悬浮液每日灌胃,连续5天。在基线(ABX干预前)、FMT前(ABX干预后)和FMT后收集粪便样本,以监测细菌密度。最后,麻醉后收集盲肠内容物检测BA转化菌的丰度和活性。收集其他标本(肝脏、回肠和回肠内容物)以分析BAs和/或BA相关基因和蛋白。
3.菌群定植实验
选用18只成年雄性C57BL/6J小鼠(n=6只/组)。通过16S核糖体序列分析,鉴定出一株典型的BA转化梭菌(C.scindens;ATCC,35704)。该菌株用脑心浸液肉汤(BHI,BD Biosciences)在厌氧条件下培养。在确认其体外BA转化活性后,每天给1组小鼠灌胃1×108cfu/mL的C.scindens菌PBS悬液,连续7天。另一组小鼠给予0.1
mg/mL的万古霉素,并以PBS为对照。
4.
BA对小鼠的干预实验
40只成年雄性C57BL/6J小鼠分为5组(n=8/组)。4个实验组分别以50 mg/kg体重的TCA、TCDCA、TUDCA或它们的混合物(T-bas)灌胃8周。第5组为生理盐水对照组。治疗结束后,取肝、回肠组织标本,用实时定量PCR方法分析FXR、FGF19、SHP和BA合成酶(CYP7A1、CYP8B1)基因。
5.肝细胞和肠上皮细胞制备
L-02(肝细胞系)和NCI-H716(上皮细胞系)分别用含10%Gibco胎牛血清的DMEM培养基和RPMI 1640培养基培养在塑料培养皿中。分别用万古霉素(10μM~40 0μM)和C. scindens (活体和热灭活)处理L-02细胞24h,检测它们对肝脏CYP7A1表达的影响。根据BAS激活FXR的EC50值范围,分别用50μ的M-TCA、TCDCA、TUDCA和T-bAS处理L-02和NCI-H716细胞24h,分析BA-牛磺酸偶联物对FXR、FGF19、SHP、CYP7A1和CYP8B1表达的影响。分别用GUDCA、GCDCA、GCA、CA、UDCA和7-KDCA处理NCI-H716细胞24h,观察其对肠上皮细胞FXR和FGF19表达的影响。
6.粪便宏基因组数据处理和统计学分析
去掉低质量的碱基和人类基因组,剩下83.59%的高质量序列。微生物多样性的测定和分类群的鉴定使用已发表的人类肠道微生物组基因目录数据库对比后分析。通过BLASTP对KEGG基因数据库(V79)进行功能同源基因(KO)预测。根据各自基因的相对丰度计算了门、属、种和KO的相对丰度。Shapiro-Wilk检验,判断人类粪便总胆汁酸的分布。基于Prism 7的斯皮尔曼相关系数分析总粪便总胆汁酸与其他生化和细菌特征的关系。Benjamin-Hochberg方法对微分类群和BA转化基因组进行了分析。临床定量特征、代谢产物和基因的变异,在多组比较时采用非参数Kruskal-Wallis检验,两组比较时采用Mann-Whitney检验。具有统计学意义的差异被定义为P<0.05
主要结果
1.
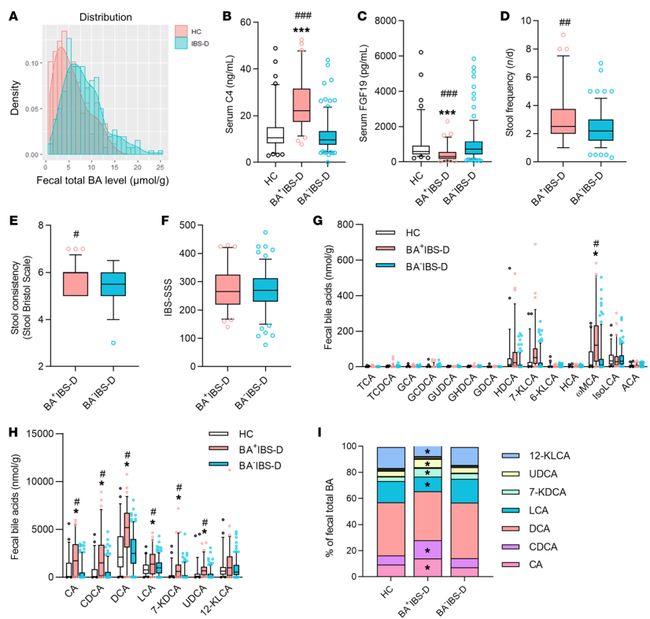
IBS-D患者胆汁酸合成增强,同时伴有过多的胆汁酸排泄和腹泻症状加重。肠道菌群衍生的胆汁酸的组成(如GUDCA、UDCA、7-KDCA等)发生了变化。BA+IBS-D患者血清和粪便中BA转化菌群异常,提示肠内转化胆汁酸菌群的异常可能是该病的病因之一。
A).正常对照组(HC)和IBS-D患者组的粪便总胆汁酸分布直方图。IBS-D组和HC组的粪便总胆汁酸排泄量呈偏态分布(经Shapiro-Wilk检验,P<0.05)
B)C).分别为血清7-羟基-4-胆甾烯-3-酮(C4)和成纤维细胞生长因子19的浓度在各组间的分布。)。BA+IBS-D组的血清C4升高,FGF19降低。
D)E)F).通过排便频率(D)、布里斯托大便分类法(E)、IBS严重程度评分系统(F)评估BA+IBS-D组和BA-IBS-D组之间的肠道症状严重程度。在BA+IBS-D组中,粪便总胆汁酸水平与血清C4水平和腹泻症状评分(Bristol大便规模和排便频率)呈正相关,而与血清FGF19水平呈负相关。
G)H).粪便中占优势的胆汁酸成分的绝对含量。I).粪便中占优势的胆汁酸成分在各组间占的比例。图例中仅显示了占胆汁酸总数1%以上的成分,I这些组分在BA+IBS-D组中都有显著增加。
显著性标记:与HC组比较(*P < 0.05, ***P < 0.005);与BA-IBS-D组比较(#P < 0.05, ##P < 0.01,
###P < 0.005)
2.在BA+IBS-D组中存在一个特定的富含梭菌的微生物群,具有不同的基因组,用于BA去结合、C7异构化和脱羟基。IBS-D队列中富含梭状芽孢杆菌的微生物群与胆汁酸合成和排泄的增加有关。
A).与HC和BA-IBS-D组相比,BA+IBS-D组的粪便微生物群落表现出更高的Bray-Curtis差异。在BA+IBS-D亚组中,肠道生态系统的不稳定性更大。
B).BA+IBS-D组 厚壁菌门与拟杆菌门的比值显著升高。
C)D)E).分别为转化胆汁酸的基因组和细菌的相对丰度。Alistipes和Bacteroides菌的相对丰度降低主要与cgh基因有关。编码7α-羟基类固醇脱氢酶(7α-hsdh)的hdhA基因丰度增加归因于大肠杆菌、梭菌、布鲁氏菌、瘤胃球菌和梭状芽孢杆菌种类的增加。
F)G). IBS-D队列中细菌丰度与生化指标之间的斯皮尔曼相关性。梭状芽孢杆菌的属和种分类的相对丰度与粪便总胆汁酸和血清C4浓度呈正相关,与血清FGF19水平呈负相关。
显著性标记:与HC组比较(*P < 0.05, ***P < 0.005);与BA-IBS-D组比较(#P < 0.05, ##P < 0.01)。斯皮尔曼相关系数的统计学意义定义为P<0.05
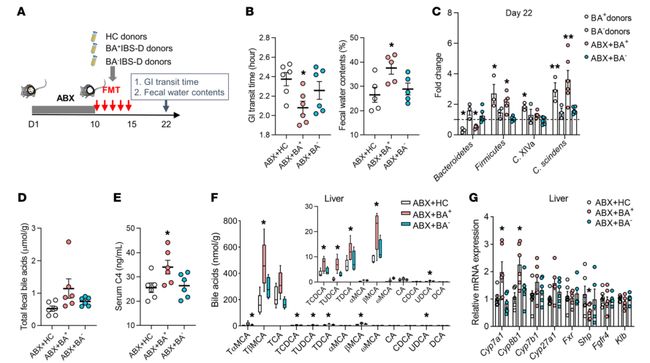
3.移植富含梭状芽孢杆菌的微生物群可以诱导受体小鼠腹泻样表型,促进胆汁酸的合成和排泄,但这些作用可能不依赖于胆汁酸的回肠吸收和肝反馈抑制。
A). ABX诱导伪无菌小鼠粪便微生物区系移植的实验程序(n=6/组)。接受HC供体粪便微生物群的小鼠归为ABX+HC组,接受BA+IBS-D和BA-IBS-D供体粪便微生物群处理的小鼠分别归为ABX+BA+和ABX+BA-两组
B). 小鼠的胃肠道转运时间和粪便含水量。微生物移植一周后,BA+IBS-D微生物群受体小鼠的胃肠道转运时间缩短,粪便含水量增加。这与供体的腹泻症状相似。
C). 基于qPCR分析,供体和受体小鼠粪便中胆汁酸相关细菌的相对水平。受体的胆汁酸转化细菌的粪便特征与BA+IBS-D供体相似,拟杆菌的丰度降低,而厚壁菌门、梭菌集群XIVa和梭状芽胞杆菌的丰度升高。
D)E). 小鼠粪便总胆汁酸和血清C4水平。F). 小鼠肝脏中胆汁酸谱。BA+IBS-D微生物群受体小鼠的粪便总胆汁酸和血清C4增加,肝脏和回肠腔中牛磺酸结合的BAs(T-βMCA、TCA、TCDCA和TUDCA)升高。
G). 胆汁酸合成调节因子在小鼠肝组织中的相关基因表达。在BA+IBS-D微生物群受体中,肝脏组织中Cyp7a1mRNA和Cyp8b1mRNA的基因表达增加,但Shp和回肠组织中Fgf15的基因表达降低。
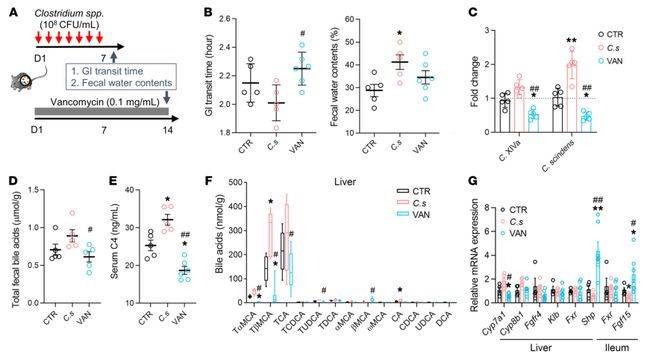
4.梭状芽孢杆菌的定植对小鼠胆汁酸合成和排泄的调控作用。梭状芽孢杆菌对胆汁酸排泄增加和腹泻样表型的影响参与了法尼醇X受体(FXR)介导的胆汁酸合成的反馈控制。
A).通过导入Clostridium Scindens菌株(C.s)或注射万古霉素(0.1 mg/mL,VAN)来调控梭状芽胞杆菌。对照(CTR)
B). 梭状芽孢杆菌处理小鼠的胃肠道转运时间和粪便含水量。与经赋形剂处理的小鼠(CTR)相比,梭状芽胞杆菌的定植显著降低了粪便稠度。万古霉素的治疗显著降低了胃肠道转运速度。
C). 基于qPCR分析,供体和受体小鼠粪便中胆汁酸相关细菌的相对水平。与CTR组相比,梭状芽胞杆菌定植小鼠的盲肠中的Clostridium
Scindens菌丰度显著增加,经万古霉素处理的小鼠盲肠中梭状芽孢杆菌的数量明显减少。
D)E). 小鼠粪便总胆汁酸和血清C4水平。在梭状芽胞杆菌定植小鼠中,粪便总胆汁酸和血清C4浓度显著增加,但经万古霉素处理的小鼠中,这些都降低了。
F). 小鼠肝脏中胆汁酸谱。牛磺酸结合的BAs(T-βMCA、TCA和TUDCA)在梭状芽胞杆菌定植小鼠中的肝脏和回肠腔中显著增加,而万古霉素处理的小鼠中则显著降低。
G). 胆汁酸合成调节因子在受体小鼠肝组织中的相关基因表达。Cyp7a1mRNA在梭状芽胞杆菌定植小鼠肝脏中表达升高,但在万古霉素处理的小鼠中显著降低。Fgf15mRNA在梭状芽胞杆菌定植小鼠回肠中表达降低。FGFR4和KLB在各组间的表达差异无统计学意义。
5.梭状芽胞杆菌衍生的胆汁酸组分对肠道FXR负反馈信号的有抑制作用。富含梭状芽孢杆菌的微生物群导致某些次级BA(例如UDCA、UDCA结合物和7-KDCA)比例较高,这些BAs可以减弱肠道FXR/FGF19信号,从而促进IBS-D患者肝脏合成和粪便排泄的增强。
A)B). 牛磺酸偶联BAs干预FXR基因及其靶基因在小鼠肝脏和回肠的表达。TUDCA降低了小鼠回肠中FXR基因的表达。TCDCA、TUDCA和T-BAs降低小鼠回肠中Fgf15表达,升高肝脏中Cyp7a1表达。4种BA处理对肝脏FXR表达均无影响,但TUDCA可增加Shp在肝脏中的表达。
C). Western blot显示FXR和FGF19在从小鼠富含梭状芽孢杆菌的微生物群中衍生出的胆汁酸-牛磺酸偶联物处理的肠细胞中的表达。T –BAs是TCA, TCDCA和TUDCA的组合。TUDCA和T-BAs都显著降低了NCI-H716肠细胞中FGF19的表达,这与体内观察结果相似。
D).FXR和FGF19基因在人体富含梭状芽胞杆菌的肠上皮细胞中的表达。E). 在FXR激动剂CDCA和梭菌衍生物胆汁酸的联合作用下肠上皮细胞FGF19基因表达的研究。CDCA和CA激活FXR并显著上调FGF19的表达。其它BAs对FXR无影响,但能有效拮抗CDCA诱导的FXR激活。
结论
这项研究在BA+IBS-D患者中发现了一种富含梭菌的微生物群,其BA转化活性不平衡。富含梭状芽孢杆菌的肠道菌群失调与BA合成/排泄增加有很强的相关性。富含梭状芽孢杆菌的粪便微生物群移植或梭状芽孢杆菌的定植显著促进了小鼠受体BA的合成和排泄。机制实验表明,梭状芽孢杆菌衍生的BAs可减弱肠道BA反馈抑制。研究人员认为,准确描述肠道微生物区系及其代谢物,结合肠道微生物区系的结构和功能特征,将提高现有IBS基于症状的治疗的精确度。