Alteration in TET1 as potential biomarker for immune checkpoint blockade in multiple cancers
(TET1突变可以作为肿瘤ICI治疗的潜在标志物)
- 文章详细信息:
1.背景介绍:
靶向CTLA-4或PD-1/PD-L1途径的免疫检查点抑制剂(ICI)在治疗不同类型的癌症中取得了令人瞩目的成功。但是,临床反应各不相同,目前,PD-L1表达,高微卫星不稳定性(MSI-H),肿瘤突变负担(TMB),和特定突变基因在预测ICI治疗反应者中显示出预测性效用。然而,迄今为止,只有PD-L1和MSI-H已通过临床验证。因此,迫切需要更多可预测的生物标志物。越来越多的证据指向DNA甲基化和肿瘤治疗之间的联系。最近有报道称DNA甲基化标记物与PD-1治疗的非小细胞肺癌(NSCLC)的功效有关。然而,迄今为止,缺乏关于DNA甲基化相关基因的基因组改变与ICI反应的关联的临床证据。在这项研究中,作者系统地收集和合并大量基因组和临床数据,以评估DNA甲基化关键基因突变对ICI治疗的预测作用。作者发现,DNA羟甲基化酶TET1中的突变在ICI治疗的肿瘤患者有着更好的临床获益,更长的无进展生存期(PFS)和总生存期(OS)。
2.数据和方法:
2.1 数据来源
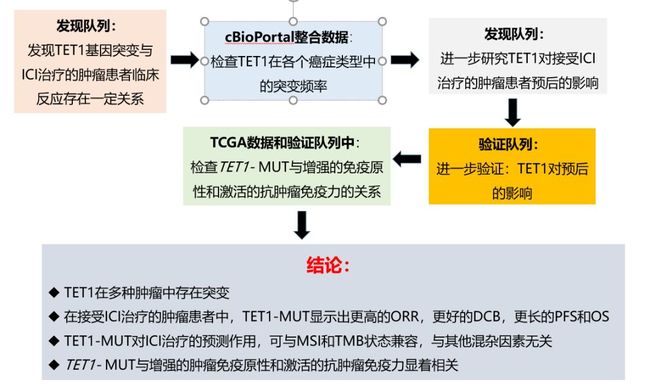
作者的数据分为发现队列、验证队列(由Samstein等人数据组成,来自MSKCC数据库)、TCGA数据、cBioPortal网站过滤后的数据整合。
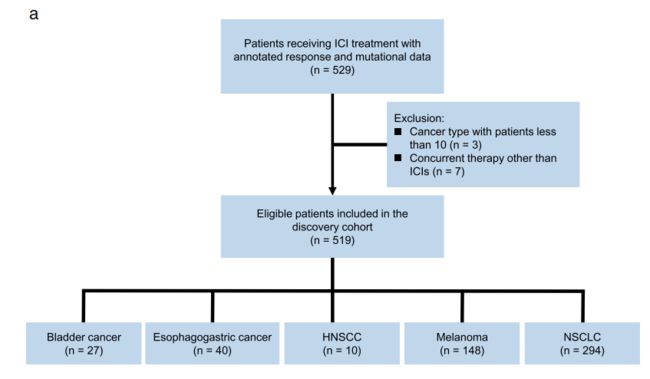
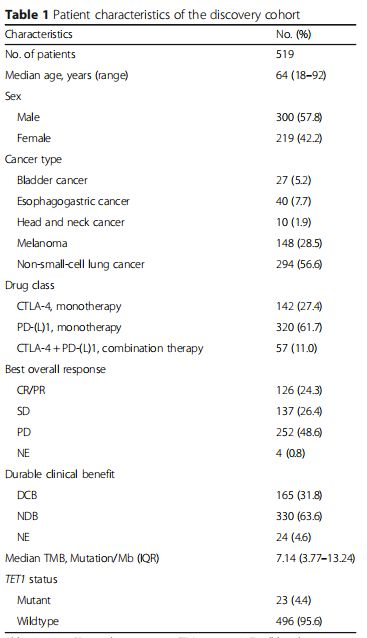
Fig1a图是发现队列:来自于六个已经发表的研究数据的529例病例,排除了癌症类型数量少于10名的患者(n = 3)和接受除ICI之外同时接受其他治疗的患者(n = 7)后,最终发现队列共纳入519例数据。主要为MSK-IMPACT panel测序以及全基因组测序(WES)。
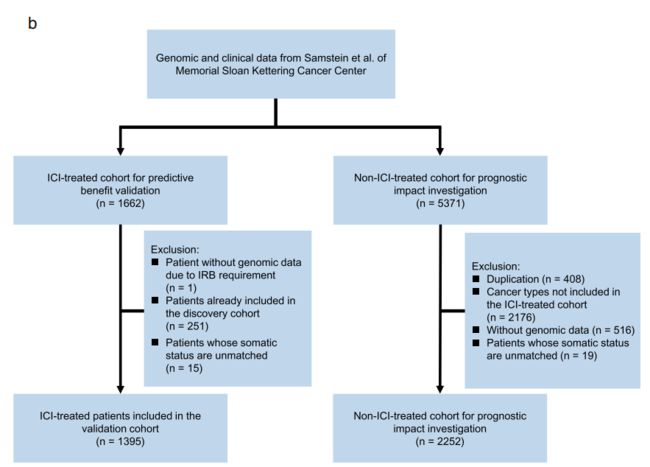
Fig1b图是验证队列:MSKCC数据库里Samstein等人的数据,分为未经过ICI治疗(2252例)和经过ICI治疗的(1395例),最终验证队列共纳入3646例数据。
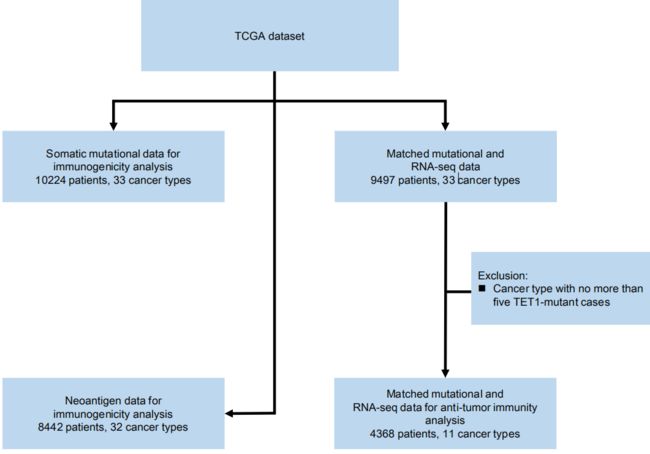
TCGA数据(补充图):
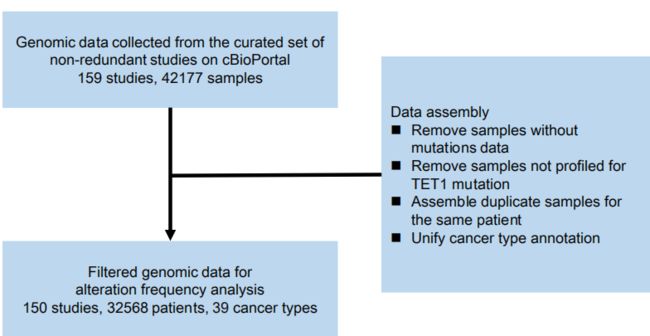
cBioPortal网站过滤后的基因组数据(补充图):
2.2 不同临床数据TMB的标准化
TMB定义为所检查基因组的每兆碱基(Mb)的非同义体细胞,编码,碱基取代和indel突变的总数。对于通过WES测序的样品,非同义突变的总数通过覆盖足够深度的兆碱基进行归一化;对于以MSK-IMPACT panel进行测序的样品,将识别出的非同义突变的总数标准化为MSK-IMPACT panel的外显子覆盖率(在341-, 410-, 468-gene panels分别0.98, 1.06, 1.22 Mb)
2.3 临床结果评估指标
主要临床结果为ORR,DCB,PFS和OS。
ORR:使用实体瘤反应评估标准(RECIST)1.1版评估ORR。
DCB:分为持续性临床获益(DCB;持续> 6个月的完全缓解CR /部分缓解PR或稳定疾病SD)或没有持久性受益(NDB,持续的疾病进展PD或SD ≤6个月)。
NE:未进展且在随访6个月之前接受检查的患者被视为不可评估(NE)。
PFS:从患者开始免疫治疗的日期到任何原因的进展或死亡进行评估
OS:在发现队列和验证队列中,从ICI治疗开始之日起计算OS,在最后一次接触之日对未死亡的患者进行检查。(Note:在来自Samstein等人的未经ICI治疗的队列中,OS是从首次输注化疗之日起计算的,而在TCGA队列中,OS是从首次诊断之日算起的)
2.4 肿瘤免疫原性和抗肿瘤免疫力分析
为了研究TET1-MUT肿瘤的肿瘤免疫微环境,作者在TCGA数据集中进一步比较了TMB,新抗原负荷,肿瘤浸润性白细胞,TET1- MUT和TET1- WT肿瘤之间的免疫特征和免疫相关基因的表达。
TMB采用为未经归一化的体细胞非同义突变计数的总数
新抗原负荷定义为相关数据里确定的预测的新抗原总数。
R包MCP计数器用于估计肿瘤浸润白细胞的丰度。
使用R包GSVA来确定每个免疫特征的单个样本基因集富集(ssGSEA)得分。
免疫相关基因及其表达水平被量化为FPKM(每百万个映射片段的外显子模型的每千碱基碱基的片段数)并进行log2转化。
2.5 统计分析
用Fisher精确检验来评估具有应答的特定突变基因的富集程度(CR / PR与PD / SD),并控制P值的错误发现率(FDR)。
使用Fisher精确检验检查TET1状态与ORR或DCB 之间的关联。
TET1-MUT和TET1-WET的无进展生存率和总生存率患者通过Kaplan-Meier方法,对数秩检验和Cox比例风险回归分析进行分析,并针对可用的混杂因素进行了调整,包括:1)发现队列中的年龄,性别,癌症类型和TMB;2)验证队列中的年龄,性别,癌症类型,TMB状态和MSI状态;3)在未经ICI治疗的Samstein等人的队列中,性别,癌症类型,TMB状况;4)年龄,性别,种族,癌症类型,组织学等级,肿瘤分期,TMB和TCGA队列中首次诊断的年份。
评估了TET1状况与以下因素之间的相互作用,包括年龄(≤60岁与≥60岁),性别(男性与女性),癌症类型(黑色素瘤,膀胱癌,NSCLC与其他癌症),TMB状况(低与高 )和药物类别(单一疗法与联合疗法)。
使用Mann-Whitney U检验检查了TET1- MUT和TET1- WT肿瘤之间的TMB,新抗原负荷,肿瘤浸润性白细胞,免疫标记或免疫相关基因表达的差异。显着性设定为0.05,所有统计检验均是双面的。
3.结果:
3.1TET1基因突变与ICI治疗的临床反应有关
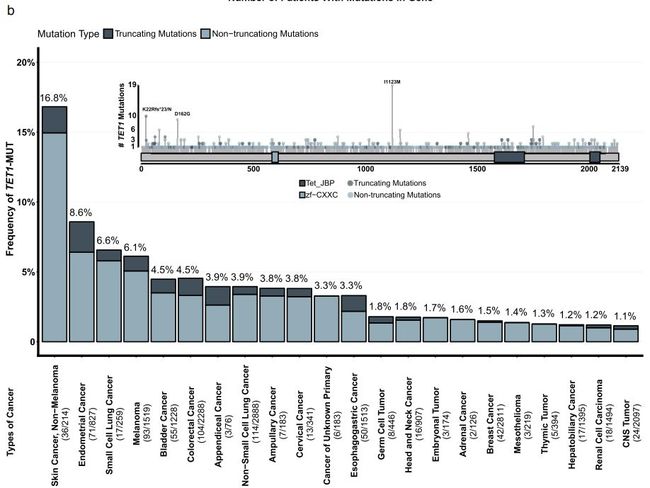
首先,作者在发现队列进行反应相关突变的的分析,Table1为发现队列的临床特征,从下面Fig2a可以看出TET1-MUT在CR/PR富集,预示着TET1突变可能是ICI治疗的潜在预测生物标志物。然后作者收集cBioPortal网站相关的基因组数据来进一步验证TET1在多种癌症类型的突变频率(150项研究, 32568例, 39种癌症类型),Fig2b图棒棒图部分说明:TET1的体细胞突变均匀分布,没有任何带注释的功能性热点突变。柱状图部分则进一步显示在不同癌症中突变的比率。皮肤,肺,胃肠道和泌尿生殖系统是突变率最高。 以上结果说明,TET1突变在各种类型肿瘤中普遍存在,且与ICI治疗临床反应存在联系。
Table1:发现队列数据的临床特征:
Fig2:
a图为:来自于发现队列的数据,临床反应相关的突变CR/PR vs PD/SD (两尾Fisher精确检验,CR / PR患者 为n = 126例,PD / SD患者为n = 389例). 灰色虚线表示调整后的错误发现率P = 0.05(Fisher的精确检验)。b图为:cBioPortal网站相关的基因组数据。对于每种癌症类型,其突变频率高于1%的TET1-MUT肿瘤比例。条形图上方的数字表示改变的频率,接近癌症名称的数字表示TET1-MUT患者的数量和患者总数。“CNStumor”表示中枢神经系统肿瘤。“Truncating mutations”包括无意,不间断,剪接位点突变以及移码插入和删除;“non-truncating mutations”包括错义突变以及框内插入和删除。
3.2 TET1-MUT对ICI治疗的预测功能(发现队列)
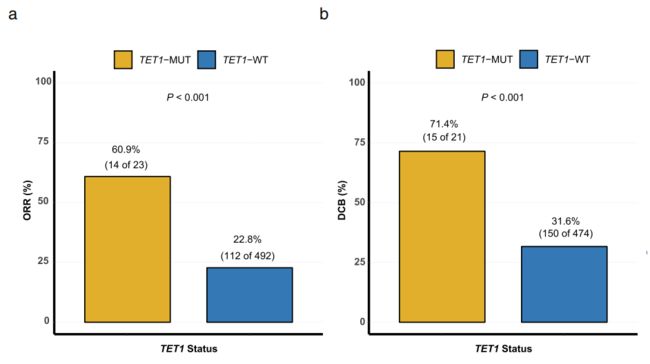
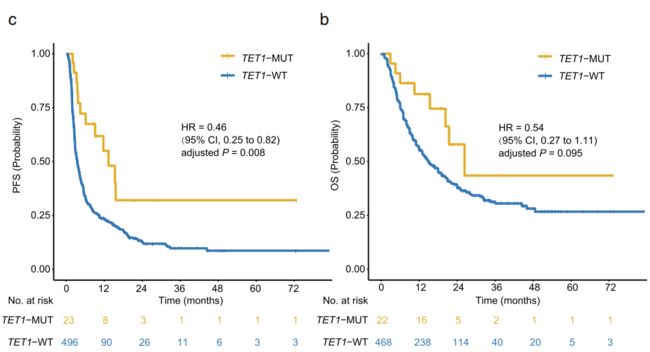
为了进一步研究TET1突变与ICI治疗临床反应存在在具体联系,作者在发现队列中进一步评估了相对应的临床结果。从Fig3a、b中,我们可以看出TET1突变的患者较TET1野生型患者有更好的ORR和DCB,Fig3c、d中可以看出TET1突变的患者教TET1野生型患者有更好的PFS(危险比(HR)= 0.46 [95%CI,0.25-0.82] ,P=0.008)、OS( HR = 0.54 [95%CI,0.27至1.11],P = 0.095)。以上结果说明,TET1突变在ICI治疗的患者中显示出更好的临床反应和预后。
Fig3:数据皆来自发现队列:
a图:直方图描绘了在TET1- MUT和TET1- WT组中达到客观反应(ORR)的患者比例。(n = 515;4名总体反应最佳的患者无法评估)b图:直方图描绘了在TET1- MUT和TET1- WT组中获得持续临床获益(DCB)的患者比例。(n = 495;24例具有持久临床获益的患者无法评估)c图:Kaplan-Meier评估发现队列中患者的无进展生存期(PFS)。(n = 519)d图:Kaplan-Meier在发现队列中比较了TET1- MUT 患者和相应的WT对应患者的总生存期(OS)。(n = 490;29位患者无可用的OS信息)
3.3 TET1-MUT预测功能的验证(验证队列)
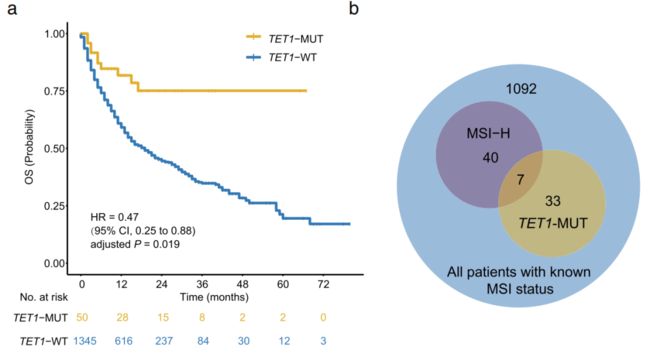
为进一步了解TET1的预测功能,作者在验证队列中进一步验证。首先,在验证队列的经过ICI治疗的队列里比较TET1-MUT和TET1-WT在OS上的差异,Fig4a说明:TET1在ICI治疗的肿瘤患者中,突变型比野生型有着更长的OS(调整混杂因素后,HR:0.47,95%CI:0.25-0.88,P=0.019)在该ICI治疗的验证队列中,患者已知状态MSI的共有1172名,如Fig4b所示:其中47人MSI-H,而40是TET1-MUT,只有7例均为MSI-H和TET1-MUT。
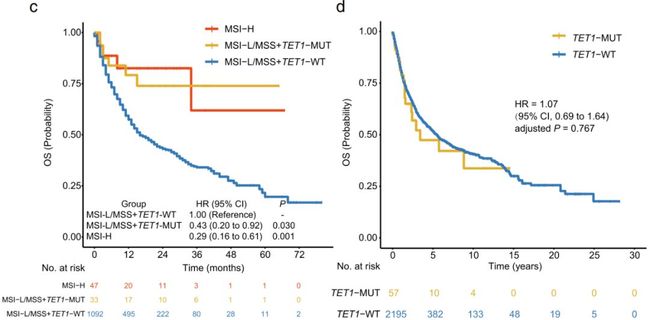
因此,作者进一步分析了涉及到MSI状态后TET1对预后的影响,如Fig4c示:在患者低微卫星不稳定性(MSI-L)或微卫星稳定(MSS)时,TET1-MUT患者的OS仍然显著长于TET1-WT型,且和MSI-H的患者生存相似。这表明TET1 -MUT可能可与MSI-H一起作为预后标志物。
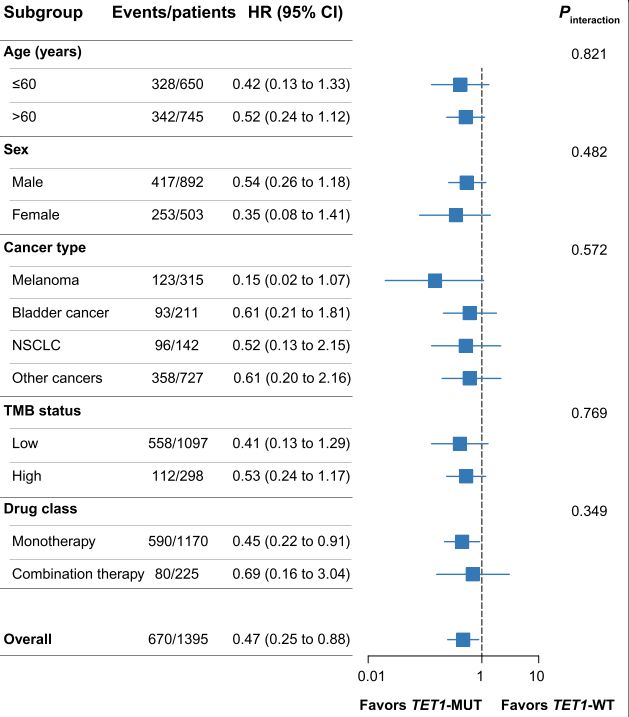
同时在年龄,性别,癌症类型,TMB状态和药物类别的亚组中,如Fig5所示:TET1- MUT相对于TET1- WT 的有利临床结果也很突出且一致。
最后,作者在验证队列未接受ICI治疗的队列里进一步TET1突变与野生型的生存差异,如Fig4d所示:在未经ICI治疗的队列里,TET1-WUT与TET1-WT在OS上无差异。
以上结果进一步证明,TET1可以作为ICI治疗的肿瘤患者的预后标志物。
Fig 4:数据来自验证队列
a图:Kaplan-Meier曲线比较了验证队列中TET1- MUT 患者和TET1- WT患者的总生存期(OS)b图:Venn图显示在验证队列的已知MSI状态的患者中同时存在MSI-H和TET1-MUTc图:Kaplan-Meier曲线比较了验证队列中MSI-H,MSI-L / MSS和TET1 - MUT中的 OS,以及MSI-L / MSS和TET1- WT组中的OSd图:Kaplan-Meier曲线研究了TET1-MUT在非ICI治疗的队列中对Samstein等人的预后影响
Fig5:森林图:年龄,性别,癌症类型,TMB状态和药物类别的亚组
3.4 TET1-MUT与增强的免疫原性和激活的抗肿瘤免疫力有关
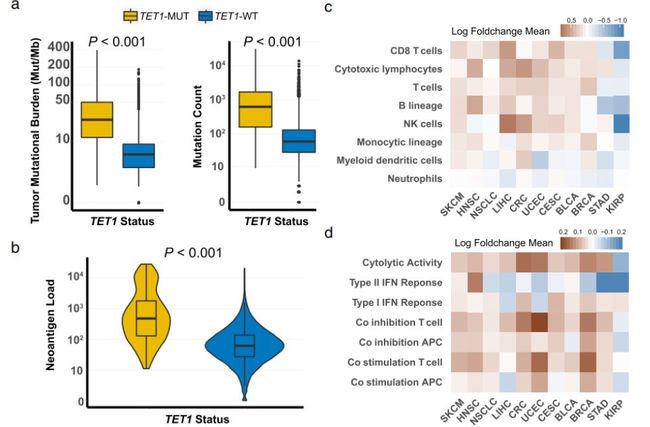
为了表征TET1-MUT肿瘤的肿瘤免疫微环境,作者分别在Samstein的验证队列和TCGA数据里比较了TET1-MUT和TET1-WT肿瘤之间的肿瘤免疫原性和抗肿瘤免疫性。如Fig6a示:左边来自于Samstein的队列,右边来自于TCGA队列,显示TET1-MUT肿瘤的TMB水平均显着高于TET1-WT肿瘤;同时,如Fig6b所示:TET1-MUT肿瘤中的新抗原负荷也显着更高(来自TCGA数据),表明TET1-MUT与增强的肿瘤免疫原性有关。
更深层的,作者进一步分析了免疫浸润细胞的区别,如Fig6C示:肿瘤浸润性T淋巴细胞,特别是细胞毒性淋巴细胞在TET1-MUT较-WT更丰富.
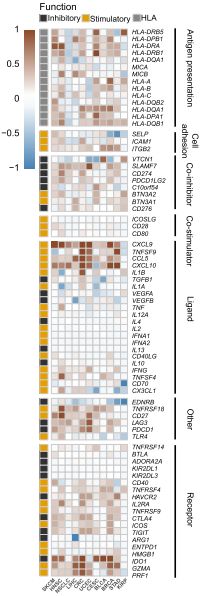
此外,作者进一步行免疫特征分析,如Fig6d所示:TET1-MUT肿瘤中的溶细胞活性信号也显着更高,同时调节信号也普遍上调,包括抗原提呈细胞和T细胞的共抑制和共刺激因子 。作者还彻底检查了TET1-MUT和TET1-WT肿瘤之间的免疫相关基因表达模式的差异,如Fig6e所示:与免疫浸润和标记相一致,TET1-MUT肿瘤中的许多刺激性免疫调节剂通常被上调,例如趋化因子(CXCL9,CXCL10,CCL5)和细胞溶解活性相关基因(PRF1,GZMA);免疫检查点,例如CTLA4,LAG3和在TET1- MUT肿瘤中,针对TIT1- WT肿瘤的TIGIT也被上调。
以上结果说明:TET1- MUT与增强的肿瘤免疫原性和相对较热的免疫微环境密切相关。
Fig6:数据来自TCGA数据、Samstein的队列验证队列
a图:左边来自于Samstein的队列,右边来自于TCGA队列,在TET1-MUT与TET1-WT之间TMB的比较b图:TCGA队列,TET1- MUT和TET1- WT之间新抗原负荷的比较c图:TCGA队列,在多种癌症类型中,与TET1-WT与TET1-MUT之间平均肿瘤浸润白细胞MCP计数器得分的log2转换倍数变化。d图:TCGA队列,TET1-MUT肿瘤与TET1-WT肿瘤的平均免疫特征ssGSEA得分的log2转换倍数变化e图:热图描绘了不同癌症类型的TET1-MUT和TET1-WT肿瘤之间免疫相关基因mRNA表达的平均差异。热图的x轴表示不同的癌症类型,y轴表示肿瘤浸润的白细胞,免疫标记或基因名称。每个方块代表每种癌症类型中TET1-MUT和TET1-WT肿瘤之间每个指示的肿瘤浸润性白细胞,免疫标记或免疫相关基因的倍数变化或差异。红色表示上调,而蓝色表示下调