AJP:双相情感障碍高遗传风险年轻人结构连接的纵向变化
最近对双相情感障碍或高遗传风险患者的研究表明,支持认知和情感过程的关键大脑网络之间存在结构性连接不良。了解这些网络在双相情感障碍发病高峰年龄范围内的纵向轨迹可以为疾病发作或恢复机制提供信息。
方法:在基线和2年后在两个队列中的183名年龄在12-30岁的个体中获取纵向扩散加权MRI和表型数据:97名未患病的双相情感障碍一级亲属(高危组)和86名没有精神疾病家族史的个体(对照组)。使用纤维追踪提取全脑结构网络,并使用基于网络的统计和混合线性模型研究这些网络的纵向变化。
结果:两组都表现出广泛的纵向变化,包括结构连接的增加和减少,这与共同的神经发育过程一致。除了这些共同的变化之外,高风险参与者在左下额叶和额中叶区域,左纹状体和丘脑结构,左梭形以及右顶叶和枕部区域的网络中显示出连接性减弱。这些区域之间的连接在对照组中得到加强,而在高危组中则减弱,转向已确诊双相情感障碍的队列。有边际证据表明,在随访前首次出现躁狂或轻躁狂发作的患者中,网络减弱更大。
结论:从青春期到成年早期的神经发育与结构大脑网络的实质性重组有关。这些成熟过程的差异发生在双相情感障碍高遗传风险个体的多系统网络中。这可能代表了理解疾病适应力(resilience)和预测向双相情感障碍转变的新候选物。本文发表在American Journal ofPsychiatry杂志。
1.引言
双相情感障碍是一种严重且相对常见的精神障碍,具有很强的家族成分,其特征在于情绪和认知的发作性障碍。对双相情感障碍神经生物学的研究越来越多地纳入了脑网络或连接组学的研究。最近对双相情感障碍的结构和功能成像研究显示,连接障碍集中在关键的情绪和认知枢纽(hubs),如岛叶和额下回。这种连接不良导致情绪回路和认知控制网络之间整合的丧失,反映了该疾病的标志性情感和神经认知障碍。
对双相情感障碍中神经生物学差异的解释是复杂的,因为这些差异可能反映了生物学危险因素,疾病的后果或其药物治疗的影响。双相情感障碍患者未患病的一级亲属与发展成双相情感障碍的比值比约7-14。因此,由年轻、未患病的双相情感障碍亲属组成的神经影像学研究是有价值的,因为它们包括后来将转变为双相情感障碍但尚未暴露于急性疾病或精神药物的生物学影响的高危个体。与对照组相比,评估高危人群白质体积的研究报告了额叶回,内囊和胼胝体的差异,反映了灰质变化,如皮质变薄。纵向研究表明,高遗传风险人群的神经生物学差异是动态进化的。例如,高风险参与者右额叶皮层皮质加速变薄和体积减少,包括额下回,外侧眶额叶皮层,额极和喙额中回。
最近对高风险队列的研究也采用了连接组学,使用扩散加权MRI序列来研究白质的连通性和完整性。使用局部扩散衍生指数(如各向异性分数[fractional anisotropy])的研究报告了特定白质束(如绞窄筋膜[uncinate fasciculus]、皮质脊髓束[corticospinal tract]、扣带和胼胝体)的广泛变化以及局部干扰。全脑纤维追踪允许重建结构性脑网络,这是对高危队列中连接组学的更直接研究。最近一项针对年轻高危个体的研究发现,以额下回和岛叶皮层为中心的网络中结构连接较弱,边缘网络中的连接性较强。值得注意的是,高危队列中的脑网络差异与已建立的双相情感障碍中的脑网络差异不同,尽管两者都包括参与情绪处理和情感调节的区域,例如岛叶,海马体,杏仁核和扣带皮质。
双相情感障碍发病的年龄范围与大脑发育的最后阶段以及随之而来的结构性脑网络重组重叠。这种重组分阶段发生,从儿童晚期的感觉运动回路转向青春期后的多模(heteromodal)和联合皮层。这些变化在成年早期趋于平稳,因此显示出非线性、年龄依赖性特征,行为相关性从获得新技能转向行为的复杂性和认知控制的成熟。神经精神疾病(如双相情感障碍)的概念模型表明,它们在此过程中被框定为干扰(disturbances),即“神经发育错线(neurodevelopmental miswiring)”。
需要纵向研究来消除稳定的横断面组差异与在神经发育期间或发病后出现的个体差异。只有少数研究研究了双相情感障碍高风险人群的白质变化。苏格兰双相情感障碍家庭研究报告称,在2年内,患双相情感障碍风险的个体,患有重度抑郁症的人,以及控制对象,在2年内,广泛大脑区域的各向异性分数降低。然而,各组之间的轨迹没有差异。我们小组最近报告说,在2年内,高危年轻人和对照组脑室周围高信号的患病率显著增加。同样,在轨迹上没有明显的组间差异。
使用从弥散加权MRI推断的全脑结构网络,我们研究了2年间隔内的连接组学变化,将基线时没有这种疾病的双相情感障碍患者的年轻一级亲属(高危组)与来自无精神疾病家庭的对照受试者进行了比较。因此,我们的队列包括跨越发病高峰年龄的青少年和年轻人,他们本身处于双相情感障碍的高风险中。我们首先报告了整个研究队列中大脑连接的线性和非线性重组。然后,我们报告了这种重组中的组间差异,假设这些差异在基线和随访之间经历第一次情绪发作(重度抑郁发作或躁狂或轻躁狂发作)的高危人群中更为明显。我们将这些变化与已确诊的双相情感障碍组进行比较,该组的年龄与我们的随访队列相匹配。这些分析可能有助于完善我们对双相情感障碍高遗传风险年轻人神经发育过程的理解,并确定关键的保护因素和脆弱性。
2.方法
2.1参与者和研究设计
受试者包括两组12-30岁的个体,他们进行了基线和随访扫描:高风险受试者(N = 97),他们是先前DSM-IV诊断为双相I或II障碍者(proband,先证)的一级亲属,但基线时本身没有双相情感障碍,以及对照受试者(N = 86),来自没有精神疾病史的家庭。在高危人群中,80%有父母先证,20%有兄弟姐妹先证。样本中两个对照组家庭和17个高危家庭有一个以上的兄弟姐妹。
该研究在澳大利亚悉尼的新南威尔士大学人类研究伦理委员会(HREC Protocol 09/097)的批准下进行。从所有参与者那里获得书面知情同意,对于16岁或以下的参与者,额外获得父母同意。
2.2 MRI采集和追踪
弥散MRI数据是使用3-T飞利浦Achieva X MRI扫描仪采集的。对32张定向扩散加权图像进行了一次采集(b=1000 s/mm2,TR=7767 ms,TE=68 ms),将生成的图像重建,产生1 mm×1 mm×2.5 mm的体素。用于从这些数据构建全脑结构网络的预处理流程类似于我们的基线研究和其他出版研究。简而言之,扩散加权MRI序列数据首先使用MRtrix3(https://github.com/MRtrix3/mrtrix3/releases/tag/3.0_RC3)和FSL(版本5.0.11)进行预处理,包括去噪、涡流和运动校正以及偏置场校正(https://github.com/breakspear/diffusion-pipeline/tree/bipolarlongitudinal)。估计了来自多种组织类型(白质、脑脊液)的信号响应。然后使用约束球形反卷积(Constrained spherical deconvolution, CSD)和概率纤维追踪图(probabilistic tractography, iFOD2)产生500万个代表大脑区域之间结构连接的全脑流线。
【补充材料】涡流和运动校正函数:FSLeddy(使用--repol);偏置场校正函数:dwibiascorrect(-fsl);图像质量检查:fslview(https://github.com/AlistairPerry/dwi2connectome/blob/master/miscscripts/QC_wfslview_basic)。
为了提供局部纤维方向的估计,使用无监督算法(即没有解剖学先验)获得了多种组织类型(各向异性白质和各向同性灰质和CSF)的相对信号响应。然后对平均白质和脑脊液信号贡献进行区分,并使用约束球形反卷积(lmax = 6,msmt_csd)来提供纤维取向分布函数。iFOD2概率流线算法被用于通过随机采样每个候选路径上的点处固有的方向不确定性来生成全脑纤维传播(post bug-fix,c.f. https://github.com/MRtrix3/mrtrix3/issues/1204)。跟踪参数如下:步长= 0.2毫米,最小长度= 10毫米,最大长度= 250毫米,FOD终止阈值= 0.1,曲率约束= 1毫米半径,每个受试者有500万条流线从整个大脑中的随机种子初始化大脑mask。
标准解剖学自动标记(anatomical automated labeling, AAL)模板被细分为512个大小大致均匀的皮质和皮质下划分区域。通过将每个受试者的各向异性分数图像重新定位到FMRIB FA模板,然后与个体的全脑纤维追踪相结合以生成加权结构网络,获得受试者特定的划分。每个加权网络边对应于与成对区域相交的流线总数,由这些区域之间的距离进行调整。
为了减少误报连接,使用组一致性方法对生成的连接矩阵进行阈值处理。这确保了所有被试具有相同的边,仅在其权重上有所不同,从而避免了单个边中被试之间的差异(零或权重值)。基于一致性的阈值还保留了使用直接组织学(histological)方法时明显的对边强度的远距离效应。根据我们之前对该队列的横断面研究,结构网络的阈值为10%。
2.3基于网络的统计
对于统计推断,我们将一般线性模型与基于网络的统计(network-based statistics, NBS)结合使用,NBS是一种基于排列的方法,用于控制我们整个大脑结构网络中大量边的家族误差(family-wise error, FWE)。
为了研究整个队列中连通性的纵向变化,对时间的主要影响(基线到随访)进行了双样本的单尾t检验。为了检验这些变化中的组间差异,然后计算组和时间之间的单尾相互作用检验。进行单尾检验以消除随时间或组增加与减少的连接的歧义。对于每个比较,运行一个基础模型,该模型不包括年龄作为协变量。我们还运行了单独的模型,其中以扫描时的年龄作为协变量。由于预计整个队列中连接性会发生重大纵向变化(此模型中的增加和减少),因此对该模型实施了t=3.5(对应于未校正的p<0.0004)的保守高度阈值,而对于主要交互模型,则使用NBS中的默认设置,即t=3.0的高度阈值(对应于未校正的p<0.002)。然后使用置换检验执行拓扑推理(使用网络空间范围),以控制p<0.05的FWE。所有模型都使用5000次置换。
运行线性混合效应模型以研究当前精神药物、当前情绪发作(二值变量,是/否)、当前情绪状态(连续变量,儿童抑郁量表[Children’s Depression Inventory, CDI],蒙哥马利-奥斯伯格抑郁评分量表[Montgomery-Åsberg Depression Rating Scale, MADRS]和年轻躁狂评分量表[Young Mania Rating Scale, YMRS]分数)在NBS确定的网络上的潜在混淆。线性混合效应模型以平均网络权重作为因变量,组(对照和高风险组),时间或其相互作用作为固定效应。家庭相关性被作为随机效应包括在内,以适应因同一家庭的兄弟姐妹而产生的家庭内部相关性。为每个潜在的混杂因素运行单独的模型。
我们队列的年龄范围延伸到认知和神经发育的最后阶段,因此延伸到发育活跃网络的加强和修剪的稳定。为了识别非线性年龄效应,二次多项式被拟合到所有加权边的强度作为年龄的函数,从而最小化平方误差之和。在每组和时间点的所有边进行保守的Bonferroni校正后,发现显示统计学上显著正或负曲率的边(FWE校正p<0.05)。
2.4结构网络表征与控制
双相情感障碍可以被概念化为情绪和执行回路产生的情绪和认知控制的失调。大脑网络在形式上是“可控的”,从某种意义上说,给定适当的输入,它们支持的活动状态可以被操纵,从一个稳定状态到另一个稳定状态(见图3A)。网络可控性可以使用线性控制理论进行操作,从而定量估计一个稳定的复杂系统在不同活动状态之间转移所需的能量,以及估计相反情况下,不稳定的网络在存在内在波动的情况下易受动摇的脆弱性。我们按照既定的算法计算了大脑网络的可控性,重点关注子网络中显示纵向组差异的大脑区域。网络计算和脑区划分模板数据是公开的(https://github.com/AlistairPerry/CNHRLongitudinal)。线性混合模型与当前精神药物、当前情绪发作和当前情绪状态一起使用作为滋扰协变量。
【补充材料】网络可控性:我们实施了线性网络控制理论的措施,以了解高风险结构连通性差异的动态后果。线性控制理论假设神经动力学可以通过区域活动的线性离散时间模型来近似。响应于外源输入,神经元扰动沿结构投影的传播由下式给出:
其中 ( )表示网络节点i在时间t的状态。W表示加权结构连通性矩阵,元素Wij表示节点i和j之间的连通性。输入向量B标识网络中的控制节点(那些接收扰动的节点),我们研究中的节点一次控制一个。u(t)是在时间t施加到控制节点集B的能量。
为了确保所有单个结构网络的线性稳定性,我们通过除以比跨所有受试者的连接矩阵W计算的最大特征值大10%的数字来归一化所有网络边权重(Wij)。
有关初始可控性研究中使用的代码,请参见
https://complexsystemsupenn.com/s/controllability_code-smb8.zip (ave_control.m)
网络计算和分区数据参见
https://github.com/AlistairPerry/CNHRLongitudinal。
2.5临床转化和亚组分析
我们进行了探索性亚组分析,以研究新的精神障碍对任何组间效应的高风险贡献的影响。对于这些分析,根据以下标准划分高危组:1)任何情绪发作的新发(重度抑郁或躁狂/轻躁狂发作);2)躁狂/轻躁狂发作的新发;3)从基线到随访,任何DSM-IV疾病新发。为了将新病例与以前的发作进行比较,我们还将高风险队列分为4)基线时有或没有终生情绪发作的队列。对于这些小样本的子组,我们使用贝叶斯重复测量方差分析(https://jasp-stats.org,100万个样本)来确定有利于亚组中效应的相对证据(贝叶斯因子Bayes factor,BF)。
3.结果
3.1人口统计和临床数据
高危组和对照组在年龄、智商、性别分布或扫描间隔时间方面没有显著差异(表1)。至少一次重度抑郁发作,终生DSM-IV诊断或焦虑症的终生发生率在高风险组显著高于对照组,与高危人群的先前研究报告一致。18名高危受试者经历了任何DSM-IV疾病的新发病,8名从基线到随访经历了第一次情绪发作。其中,4人首次发作DSM-IV躁狂或轻躁狂发作,3人新发重度抑郁发作,1人两者兼而有之。因此,有5个转换成了双相情感障碍。
表1.基线和随访人口统计和临床数据
3.2纵向效应
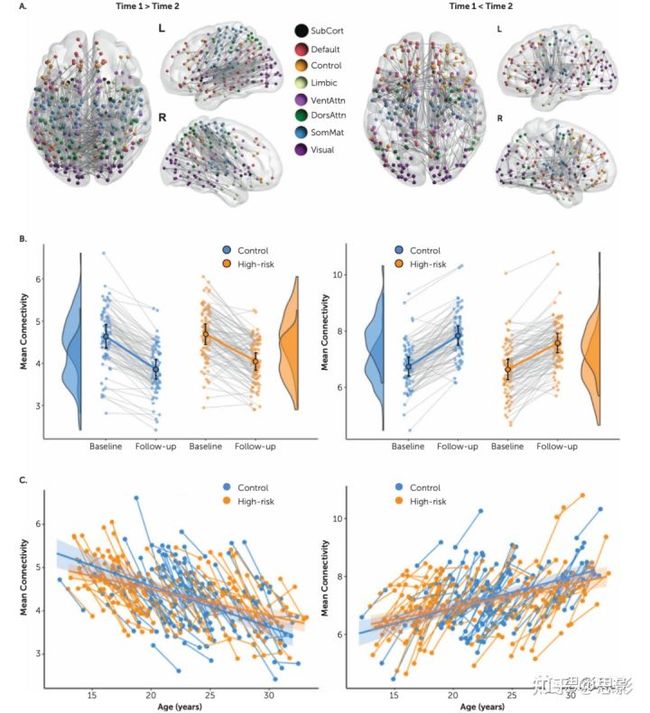
对时间主要效应的双样本t检验揭示了两组之间结构连通性的实质性重组。在默认高度阈值为t=3.0的情况下,随访时约850条边(占总数的6.5%)明显强于基线时,1145条边(占总数的8.8%)明显变弱(FWE校正后的p<0.001)。连接边变化显著的大型网络也经受住了更保守的搜索(高度)阈值(t=3.5)(图1),最终在阈值大于t=4.0时分裂成不同的网络,尽管它们继续包含分布式皮质系统。这些影响发生在两组的几乎所有参与者中(图1B)。纵向变化的连接边包括所有主要的皮质系统,并包括大量的半球内和半球间效应。纵向减弱的连接边(T1>T2)主要位于后部和中央区域,特别是躯体运动皮层。纵向加强的网络连接边(T2>T1)位于更吻侧(rostrally)的范围内,认知控制系统的参与程度更高。这些网络显示出强烈的性别效应,女性在两个网络中都“领先”男性——随着年龄的增长而降低的网络中两个时间点的权重都较小(p<0.005),随着年龄的增长而增加的网络中的权重较大(p<0.003),这与众所周知的女性大脑比男性更快地成熟趋势一致。时间和性别没有显著的交互效应(p>0.3),表明这种年龄-性别差距在基线和随访之间的2年内相对稳定。
图1.高风险组和对照组之间结构连通性的纵向变化。
在面板A中,连接边分布显示强度显著下降(T1 > T2,左侧图像集)和增加(T2 > T1,右侧图像集)。颜色根据功能隶属关系显示节点的编码。SubCort=皮质下;Default=默认模式网络;VentAttn=腹侧注意网络;DorsAttn=背侧注意网络;SomMat=感觉运动网络。
面板B显示了该网络在两个时间点和相应组分布中所有个体的相应平均连通性强度。圆圈和误差线显示均值和95%置信区间。这些网络源自相对保守的高度阈值t=3.5。雨云图(raincloud plots)是使用R软件包生成的。面板C显示了所有个体的网络连接强度,作为其基线和随访时年龄的函数,以及相应的组回归斜率和置信区间。由于与年龄的共线性,因时间效应选择的连接边也显示平均年龄效应(在T1和T2之间),但对于单个时间效应,参与者之间会丰富这些边。因此,平均而言,单个时间效应比组水平回归更陡峭。
虽然高风险组和对照组年龄匹配,但它们涵盖了广泛的发育活跃年龄范围(12-30岁)。这种对比汇总了涵盖整个年龄范围的时间变化,这些变化在两组之间共享(图1C)。为了识别无论年龄如何都纵向变化的连接边,我们在控制扫描时的年龄后进行了补充分析。这种“年龄不变”的纵向对比揭示了一个较小的,离散的连接边网络,连接双侧皮质中线结构,包括双侧中扣带和前扣带,楔前叶和尾状核(FWE校正的p<0.024)。通过对我们队列的整个年龄范围的随访,该网络捕获了两组中额外2年神经发育的影响。因此,这种回归了年龄对比的较小和较弱的性质表明,纵向网络变化在神经发育的不同阶段在大脑中动态移动。
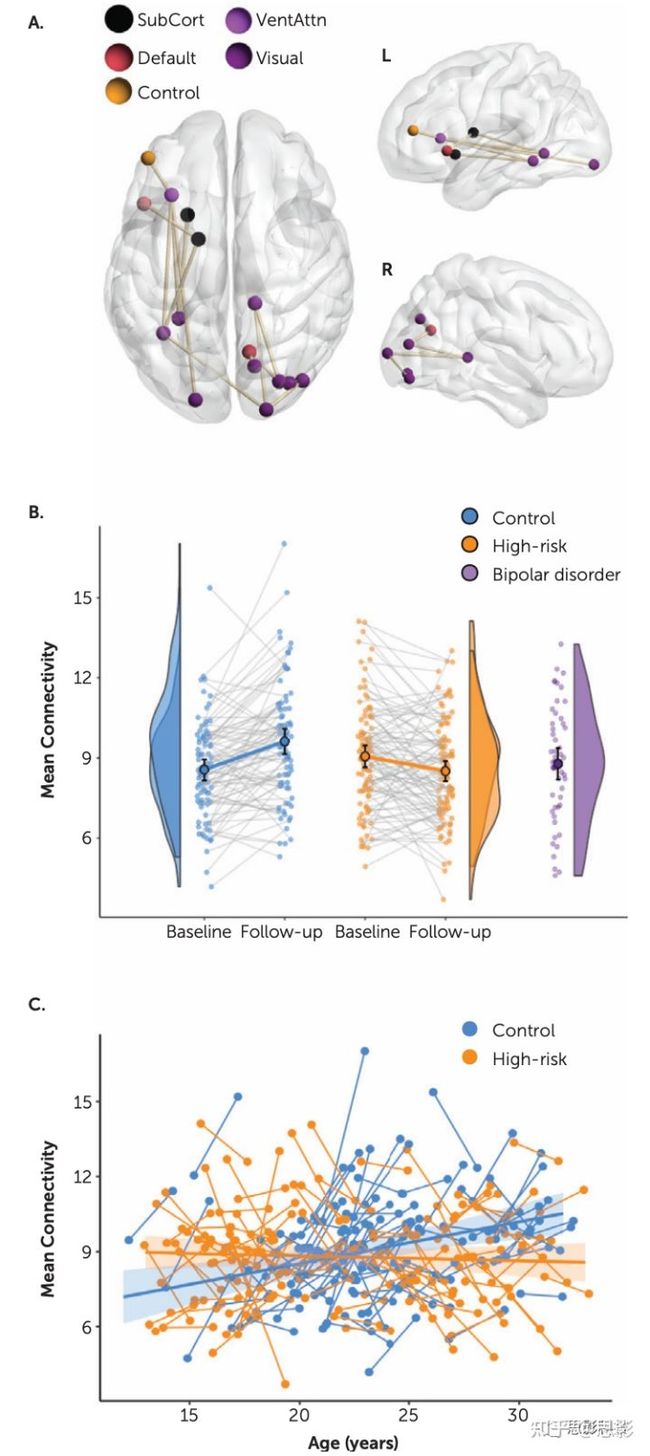
3.3纵向网络变化中的组差异
除了这些共享的纵向变化外,离散的连接边网络还显示出显著的组×时间效应(t = 3.0,FWE校正的p = 0.007)(图2A)。该网络主要通过左梭形皮层将左侧下部和侧部结构(左岛叶、下额叶回、丘脑、尾状核)连接到后部和中线右侧区域(右侧枕上和下枕皮层、楔叶、楔前叶、丘脑)。从包含这种交互效应的网络中提取连接边权重表明,该网络在对照组中的强度增加,但在高风险组中降低(图2B)。这种组×时间效应显示,对照组随年龄增加时网络强度表现出发育相关的增长,但高风险组则不然(t=3.4,p=0.0007)(图2C)。请注意,组回归在年龄的中点交叉。这表明T1-T2梯度在两组中的年轻和老年参与者中的大小是平衡的。
图2.结构连通性纵向变化的组间差异。
在图A中,连接边的解剖分布显示了对照组和高风险个体的显著群体效应。颜色图例根据功能隶属关系显示节点的编码。SubCort=皮质下;Default=默认模式网络;VentAttn=腹侧注意网络。
图B显示了所有个体在两个时间点和相应组分布的相应平均网络连接,以仅在一个时间点扫描的已确诊双相情感障碍组为基准,并在随访时年龄匹配。圆圈和误差线显示均值和95%置信区间。此网络衍生自默认的基于网络统计信息高度阈值t=3.0。
图C显示了所有高风险和控制个体的网络连接强度,作为其基线和随访时年龄的函数,以及相应的组回归斜率和置信区间。
该效应在网络稀疏性的不同阈值下复制,并且当扫描年龄用作协变量时,结果几乎没有变化。
为了理解这些结果的临床意义,我们提取了该网络在已确诊为双相情感障碍的人群中的平均权重,这些确诊患者在随访时与对照组和高风险队列年龄相匹配。有趣的是,基线时对照队列的网络权重与该双相情感障碍队列的网络权重相似(图2B,紫色),但随着时间的推移显著增加(p<0.001),与双相情感障碍组的随访不同(p = 0.03)。相比之下,高危队列中的网络权重从基线到随访从略高于双相情感障碍队列到略低于双相情感障碍队列,中等证据表明高危和双相情感障碍队列之间的连接性没有差异(BF10=0.25)。
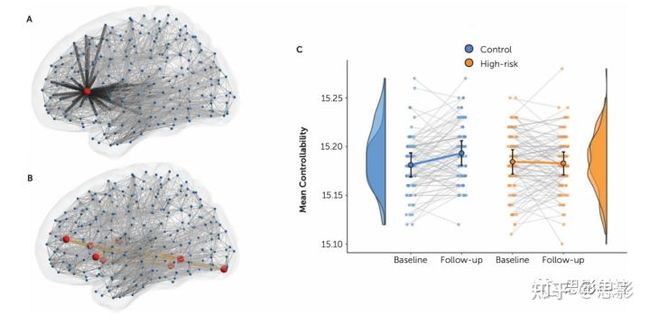
该网络的可控性也显示出显著的组×时间效应(p<0.005,图3C),其效应反映了网络权重效应,即对照组的可控性增加与高风险组的降低形成鲜明对比。当前药物、当前情绪发作和当前情绪状态与网络中显示组×时间效应的平均连接边权重无关(当前药物p=0.665;MADRS评分p=0.252;CDI评分p=0.111;基线时当前抑郁发作p=0.599;随访时当前抑郁发作p=0.780;随访时当前躁狂发作p=0.330),与网络可控性也不相关(当前药物p=0.855;MADRS评分p=0.492;CDI评分p=0.374;基线时当前抑郁发作p=0.267;随访时当前抑郁发作p=0.221;随访时当前躁狂发作p=0.079)。在任一时间点,YMRS评分(年龄超过22岁的人群)与两组交互网络中的平均连接边权重之间均无显著关联,尽管基线高风险组的正相关接近显著性(r=0.293,p=0.056)。
图3.对于连接表现出组×时间效应的区域,网络可控性纵向变化的组间差异。
图A显示了单个区域(红色圆圈)的平均可控性,计算为控制从一种大脑状态到另一种大脑状态的过渡所需的平均外源能量。
在图B中,总网络可控性计算为在基于网络统计的网络(橙色线)中标识的区域(红色圆圈)的所有可控性的总和。
面板C显示了所有个体在两个时间点和相应组分布中的网络可控性。圆圈和误差线显示均值和95%置信区间。
3.4非线性年龄效应
年龄对连接边强度的影响主要是线性的,连接边的平均权值在纯线性效应的95%置信区间内。当单独考虑时,不到1%的边具有年龄的非线性效应:在基线时,186条(0.71%)边显示出显著的非线性年龄-权重效应,其中86条凹面向下,100条凹面向上。在随访时观察到相似的数字,并在每组中分别建模。有趣的是,这些“非线性边”比连接组的其余部分(平均值=44.1 mm;t=18.1,p<0.001)连接更强和更短(平均13.1毫米)。从基线到随访,连接边的非线性一致(r=0.56,p<0.001),但在组间则不然(r=0.025,p>0.05)。值得注意的是,对照组(r=0.60)基线和随访之间连接边的非线性比高风险组(r=0.54,p<0.05)更一致,表明高风险队列中的纵向异质性更大。
3.5临床转化和亚组分析
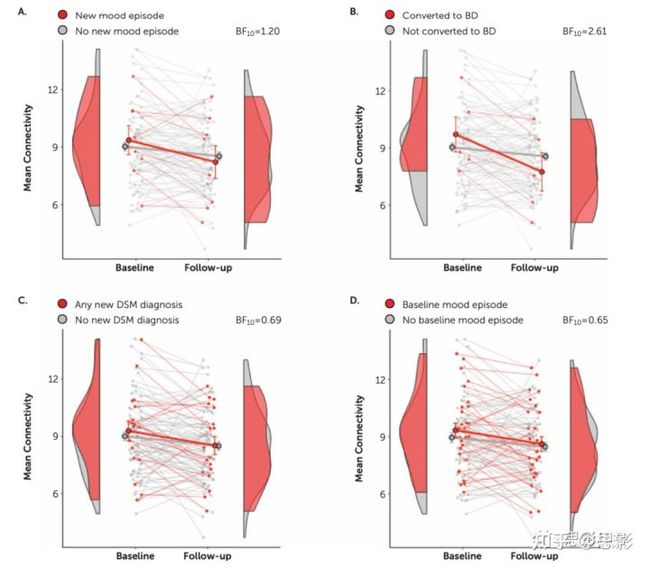
在高危人群中,少数(N=5)在基线和随访之间经历了躁狂或轻躁狂发作,因此正式转变为双相情感障碍。总共有八名参与者经历了任何新的情绪发作,18名高风险参与者患上了任何新的DSM-IV疾病。自基线以来,任何情绪发作的新发的高危参与者(图4A),特别是那些转换为双相情感障碍的参与者(图4B),从上方到下方,组×时间网络的边权重(图2)显示随时间的变化更大。从基线到随访,任何DSM-IV疾病新发的患者显示出较弱的差异(图4C)。在基线时有和没有终生情绪发作的高危队列中,没有显著差异(图4D)。
图4.高风险队列临床细分中纵向子网络的平均边权重。
参与者根据是否存在(红色)或不存在(灰色)任何情绪发作(重度抑郁发作或躁狂或轻躁狂发作)(N = 8)(图A)进行区分;躁狂或轻躁狂发作的新发(转为双相情感障碍)(N = 5)(图B);任何DSM-IV诊断的新发(N = 18)(图C);在基线时终生情绪发作的高危队列(N=28)(图D)。BF=贝叶斯因子。
对于有和没有新躁狂或轻躁狂发作的人,相应的效应量分别为0.97和0.24,对于有任何新的情绪障碍的人,相应的效应量分别为0.52和0.27。这些效应分别产生了2.61和1.20的贝叶斯因子,与支持这些新发作影响的边际证据一致。相比之下,对于患有和没有任何新的DSM-IV障碍(BF = 0.69)或基线时的任何终生情绪发作(BF = 0.65)的患者,贝叶斯因子表明这些因素没有亚组差异。
在排除基线时有任何终生情绪发作的不转化参与者后,非转化高风险组的效应量较小(92名高风险受试者的效应量为0.97,而64名受试者为0.23)。这些结果支持了这样一种假设,即该网络权重的更强变化对于那些在基线和随访之间有新情绪发作(特别是躁狂发作)的高风险参与者是独一无二的。
4.讨论
双相情感障碍的发病高峰期与青少年和年轻人神经发育的最后阶段重叠,这是一个广泛的发育阶段,与结构连接的广泛纵向变化有关。与执行和认知控制功能的成熟一致,相对于后部和中央区域,中央,中线和喙部区域之间的连接性通常趋于加强。只有很少的变化是年龄不变的,与公认的知识一致,认知和神经发展发生在进化的成熟波(evolving waves of maturation)。这些纵向变化与其他脑网络研究一致,这些研究报告了在这个关键的神经发育阶段结构和功能网络的增加和减少。嵌入在这些共享连接动态性中的是一个重要的组×时间的交互作用,包括一个独特的子网,其连接性在我们的控制队列中增加,但在高风险队列中减弱,转向已建立双相情感障碍的比较队列。有趣的是,我们的研究结果提供了一些边缘证据,表明这种效应在那些经历过任何情绪障碍第一次发作的人中增强,特别是双相情感障碍定义的第一次躁狂或轻躁狂发作。没有可比的证据表明其影响与既往心境发作或任何新的DSM-IV诊断相关。这些结果为双相情感障碍高风险个体的结构连接纵向动力学提供了新的见解,并在这种相对常见的临床场景中对个性化结果预测进行了有趣的预览。
对于我们的高风险队列,发育不同的结构网络包括连接到丘脑和双侧后皮层的左下和侧区域。特别令人感兴趣的是,该网络包括左岛叶和左下额叶回——在高风险和双相情感障碍参与者的横断面研究中经常突出的区域,包括对当前人群的基线报告。这些皮质hubs将典型的“边缘(limbic)”区域(如下丘脑)连接到认知控制节点,包括前扣带和楔前叶。这种连接在生理,内省和执行功能,及其在焦虑及其失调中具有突出作用。更广泛的网络涉及该网络中的多个大脑系统,包括视觉,默认,控制和皮质下区域,也与双相情感障碍的结构变化一致。
结构网络变化可识别高遗传风险的候选神经生物学标志物,但本身并不能直接与双相情感和认知控制方面的障碍有关。使用计算方法,我们发现纵向网络变化与较弱的网络可控性相关,反映了双相情感失调和去抑制的出现及其躁狂表型。虽然网络可控性受网络强度的影响,但它也反映了高阶网络属性,包括目标子网内的局部循环和渗透到更广泛的连接体的较长环路。因此,这种可控性的丧失表明,该网络中连接边强度的微妙变化如何产生在整个连接体中传播的动态效应,从而产生全脑范围的后果。我们的发现有几个重要的警告。研究高风险未受影响的先证者可避免已确诊疾病患者中药物治疗的混杂效应。尽管如此,由于我们采用了一种生态学方法(通过不排除那些有任何情绪发作的人),两组中的少数参与者都接受了药物治疗。当前的药物,当前的情绪发作和当前的情绪状态与组×时间网络的加权强度无关。我们研究的其他警告包括高风险队列的异质性,其中一些转化为疾病,而另一些尽管遗传负荷高,但仍保持良好。事实上,神经发育变异性是健康青少年和年轻成人队列的特征。此外,开发用于预测的算法精确地依赖于纵向结果的差异。我们的高风险队列在临床结果和网络效应方面的实质性差异也表明双相情感障碍患者的一级亲属中存在保护因素和遗传风险的变异性。
虽然我们的研究在实现主要目标(组×时间效应)方面进展顺利,但只有少数参与者在基线和随访之间出现了第一次情绪发作。我们发现,在我们的研究中,那些在躁狂症指数病例中,网络差异更强的边际证据。虽然这些分析基于贝叶斯方法(避免了对推理的逐点阈值的需求),但这一观察结果显然需要在有足够统计力的研究中进行复制。然而,推断目前2年从高风险到双相情感障碍的转化率表明,在2至3年的时间范围内获得40名高风险至双相情感障碍临床转化者的样本量,需要高达1000的总队列规模。这种规模的研究总是需要跨多个站点进行池化(pooling),从而引入由站点特定成像平台引起的滋扰方差。
纵向研究具有独特的优势,可以消除机制(使用时间优先权)的关联,并支持数据驱动的富集和预测算法。然而,纵向研究也有其自身的挑战。从研究设计和伦理学批准到基线到完成后续采集的时间滞后通常比目前的资助周期更长,并且也超过了大多数基于成像的创新。虽然我们使用了先进的纤维追踪流程,但自研究开始以来,扩散MRI序列的进步提高了衍生结构连接组的可靠性和准确性。然而,在纵向研究中,不可能在随访时引入这些,因为随后与随访特征的共线性。硬件、采集和分析流程在两个时间点上都是相同的。尽管如此,岛叶和额下回的作用与其他模态(结构MRI上的皮质厚度)的变化以及它们在高危和已确诊双相情感障碍的横断面研究中的作用趋同。
认知能力的获得反映了发育活跃阶段的神经生物学变化,儿童期感觉运动皮层的变化导致青春期异动皮层的结构重组。我们在相对较少的短而强的结构连接中发现了非线性变化(包括减慢和加速),这些连接在各个时间点之间是一致的,但在组之间是独特的。这些“非线性连接边”的时间稳定性在高风险组中较低,表明神经发育异质性更大,与各种表型结局一致。然而,我们数据的纵向变化(主要是)线性的,可能反映了我们扫描协议的性质所强加的方法学选择。纤维追踪的最新发展,如多壳(multishell)采集、结构引导播种(structurally informed seeding)和解剖滤波,可能允许在未来对高危个体进行纵向研究中更多地研究非线性神经发育。
患有双相情感障碍的一级亲属的人经常询问他们自己将来患该疾病的风险。流行病学研究表明,总体比值比在大约7-14的范围内,发病率在生命的第三个十年达到顶峰。迫切需要结合表型,神经生物学和遗传信息的预测算法来更好地分层预测个体风险,确定那些可能从早期干预中受益的人,而不是目前的“观察和等待”方法。例如,根据预测性遗传学和影像学鉴定,对于“超高风险”一级亲属,对于抑郁发作,开始使用心境稳定剂可能比单独使用抗抑郁药更可取。在这里,我们显示了该人群中结构连接中明显的神经发育效应,在基线和随访之间经历过躁狂发作的患者中,表现出更强的影响。需要对更多的参与者和更多的随访进行进一步的工作,以探索这些观察的潜力并确定可能的临床作用。
总结:
本文分析了183名12-30岁双向情感障碍高危被试和健康对照被试在基线和2年随访后的结构网络差异,分析了网络可控性。纵向分析揭示了2年内减弱和增强的连接边,同时分析了男女差异,年龄差异,用药影响等。结果支持了这样一种假设,即结构网络权重的更强变化对于那些在基线和随访之间有新情绪发作(特别是躁狂发作)的高危参与者是独一无二的。这项研究结果可以用于个体发病风险预测,在临床上早期干预,从而提高患者的治疗效果。