《Protein Actions Principles and Modeling》-《蛋白质作用原理和建模》中文分享(2)
这个分栏主要是为了介绍《Protein Actions Principles and Modeling》-《蛋白质作用原理和建模》,有助于开始学习蛋白质的朋友了解一些基本生物知识。本人能力有限,如果错误欢迎批评指正。
接上期内容
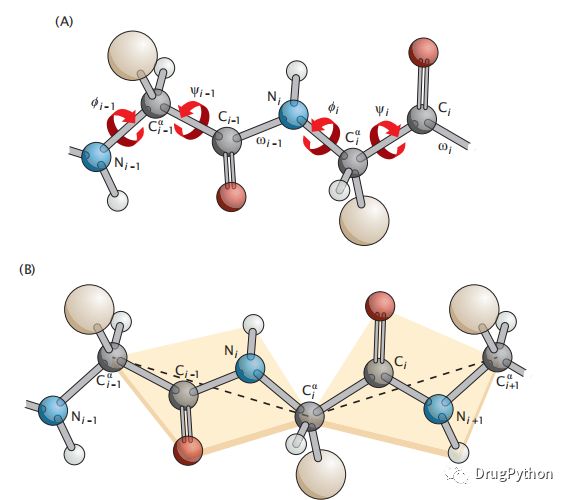
在蛋白质中,每个氨基酸沿着链通过一个肽键与相邻的氨基酸共价相连(图1.6)。肽键是一个氨基酸的碳基端和下一个氨基酸的氨基之间的C−N键。该化学键是通过脱水缩合来获得的。整个蛋白质的氨基端称为N端,羧基端称为C端。标准的惯例从N端开始对一个蛋白质链中的氨基酸进行逐个编号。肽键Ci−1−Ni连接氨基酸i−1和i。这个键,连同每一边的两个主键,Cαi−1−Ci−1和Ni−Cαi,刚性地位于一个平面内,称为肽平面。由于肽键具有双键特性(电子在碳基和酰胺单元上的离域),因此局部几何形状是平面的。这种双键特性导致了刚性使得肽键缺乏自身轴的扭转自由。所以,我们可以把主干看作是一系列的平面,它们围绕着Cα碳相对自由地旋转,将一个平面连接到另一个平面。图1.6A显示了一个多肽主链的一个双氨基酸片段,称为二肽。图1.6B显示了连续的氨基酸如何形成肽平面。一个肽平面可以相对于下一个肽平面旋转,因为N−Cα和Cα-C键可以进行扭转旋转,围绕N−Cα键旋转的扭转角度可定义为扭转(或二面体)角度称为φ。而围绕Cα−C旋转的角度称为ψ。围绕肽键的旋转角称为ω(见图1.6A)。ω角有两个稳定状态,称为反式(ω=180◦)和顺式(ω=0◦)。图1.6显示了反平面形式,它大约是顺式的1000倍(脯氨酸除外,其比例大约只有3倍)。有时虚键可以表示链,如图1.6B所示,虚线是连接连续α-碳的向量。这些虚键的反式肽的固定长度为3.8 Å。
图1.6 两个氨基酸序列由一个肽键连接。(A)主干原子由残基数i−1和i进行索引。主链扭转角与主链键相关:φi与Ni−Cα i键,ψi与Cα i−Ci键,ωi与第Ci−−Ni+1肽键。在(A)中,当从键的左原子观察到右原子时,扭转角的符号对应于顺时针旋转旋转。(B)蛋白质主干的键虚拟建模表达表示。反式肽键的长度固定在3.8 Å。虚线是连续的α-碳的虚拟键。这表示利用肽键的刚性在反式状态和平面连续骨干债券Cαi−1−Ci−1,Ci−1−Ni和Ni−Cαi,以及相应的Ci−1=O和Ni−H键。但是,请注意,虚拟键之间没有固定的键角。
不同的氨基酸具有不同的主链扭转角φ和ψ。键角的偏向性来受相邻的主链和侧链原子之间的空间位阻影响。拉马钱德兰图是指位于给定α-碳侧面的两个键的x轴上的φ角和y轴上的ψ角的图(图1.7)。拉马钱德兰地图上的轮廓(或颜色)表示了不同角度对的分布。因为肽键通常处于平面反式构象,如果已知键的角度和长度,两个二面角φ和ψ就可以完全指定主链原子的位置。 甘氨酸在其(φ,ψ)角度上比其他氨基酸有更多的自由度。它的侧链只是一个氢原子,它不会与主链碰撞(见图1.7)。脯氨酸比其他氨基酸具有更少的自由度(φ,ψ),因为它的侧链原子与主链酰胺基形成一个共价键环,锁定了主链的φ角。
图1.7 (A)拉马钱德兰图显示了不同(φ,ψ)角度对的相对分布。这里绘制的数据来自一组593个蛋白质,它们的结构分辨率为1.5 A或更高:(A)为所有氨基酸残基,(B)仅为甘氨酸。分布的颜色是:红色是占比最多的,其次是橙色、黄色、绿色、蓝色和紫色。由于空间冲突,紫罗兰区域不允许出现。除Gly和Pro外的残基倾向于落在三个标记区域之一:α为右旋α螺旋构象,β为β链,l-α为左旋α螺旋构象。(C)说明了一个角度对和β区域的主干几何形状;(D)说明了α-螺旋区域的局部结构;(E)显示了一个左旋的空间位阻。Cα原子的手性负责二面角的不对称分布,不利于大多数左旋(φ > 0)构象。
侧链也有不同的优先构象。图1.8显示了色氨酸和赖氨酸侧链上的可旋转键。侧链的惯例是,当你离开Cα主链时,用希腊字母来命名重原子,即,Cβ,Cγ,等等。类似地,旋转角被称为χ1、χ2等,下标在远离主链的地方越来越远。
图1.8 色氨酸和赖氨酸的侧链标记和可旋转键。侧链碳(灰色)或氮(蓝色)原子被标记为β、γ、δ、ζ、η等,表示与主链Cα原子的距离(键数)。可旋转的侧链键的扭转角被标记为χ1、χ2等。
为什么侧链会有偏向性的χ角?这是因为侧链中含有较短的烃类链。而它们和碳氢化合物有相同的构象偏好。以气相中的碳氢化合物链为例,[(−CH2−)n]倾向于三种旋转异构态,分别为反式、间扭式+和间扭式。天然氨基酸的χ1角构象基本是这三种。然而,图1.9B和C显示,氨基酸的种类在一定程度上会影响χ1角的相对分布。虽然间扭式+状态是大多数氨基酸最有可能的转子体(见图1.9A),但丝氨酸更倾向于间扭式−状态(见图1.9B)。氨酸和异亮氨酸更倾向于反式,因为它们的β-碳上的分支导致了空间限制。另一方面,亮氨酸在γ-碳上分支,导致空间位阻不有利于间扭−的形成(见图1.9C)。
图1.9 蛋白质中侧链χ1角(Cα−−Cβ键)的分布及其与氨基酸类型的依赖关系。(A)在所有氨基酸残基中出现χ1角的频率。这些峰对应于旋转态,间扭−(g−)、trans (t)和间扭+(g+)。g−态的概率较低是由于Cα−Cβ键的主链和侧链原子之间存在潜在的空间位阻,特别是当主链是α-螺旋的时候。丝氨酸很可能具有g−状态。(B)是由于侧链羟基和主链C=O基之间的氢键所造成的现象,但在亮氨酸中是完全不不可能的。(C)的形成则是因为Cγ原子的分支与主链的空间位阻。
-天然蛋白具有紧凑而明确的三维结构
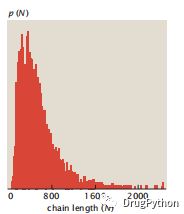
氨基酸的质量以千道尔顿(kDa)为单位。道尔顿(Da)是一个普遍的原子质量单位。其定义为碳原子质量的1/12,几乎近似于氢原子的质量。一个氨基酸的平均质量为136 ± 31 Da。蛋白质的大小范围包含了包含几十个氨基酸的多肽到有数千个残基的大分子。图1.10为酵母中蛋白链长度的分布,其中平均蛋白大小为∼500残基。在大肠杆菌中,平均蛋白质有360个残基,平均重量约136×360 = 50 kDa。
图1.10 在酵母和酿酒酵母蛋白质组中表达的蛋白大小分布(所有蛋白的集合),平均长度为501个残基。
折叠蛋白可分为三类:球状蛋白、纤维状蛋白和膜蛋白。球状蛋白致密,大致呈球形,轴向比通常在1.2到1.4之间(图1.11)。球状蛋白执行细胞功能,包括转录、代谢、运输、免疫反应、细胞信号转导和调节。纤维蛋白是长而线状的,根据其机械特性在构建细胞和组织中发挥作用,例如胶原蛋白、丝绸、毛发和羽毛。球状蛋白通常可溶于水,而纤维蛋白则不能。细胞膜蛋白位于细胞膜中,这是一个类似油的环境。膜蛋白可以运输分子,允许离子跨膜流动,跨膜传递信号,或进行酶活性。首先,先讨论一下球蛋白。
图1.11 11种蛋白质的表面表示说明了它们的大小和形状的范围。这些蛋白质都以相同的放大倍数显示。
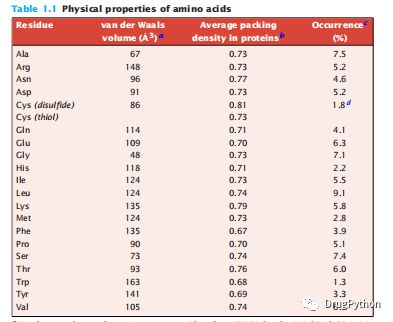
在一个折叠的球状蛋白内部没有太多的自由空间。蛋白质在折叠状态下的原子密度与液体和固体中的原子密度大致相同,或者与罐子中的弹珠的密度大致相同。表征包装紧密性可以展示折叠结构中单个氨基酸所占的体积,并将该体积与蛋白质组成原子的总体积进行比较。无论是液体还是固体,原子都会存在一定的缝隙。在最紧密的完美球体的包装中,只有74%的体积被填充——其余的是空腔。表1.1显示,球状蛋白中埋藏的氨基酸的堆积密度也为0.74。通常,蛋白质内部只有不到3%的体积由水填充。然而,蛋白质核心是紧密的;它不是均匀的,因为侧链是不同的,不同的和不规则的。蛋白质的内部更像一罐螺母和螺栓,而不是一个大理石。
表1.1 氨基酸的物理性质。
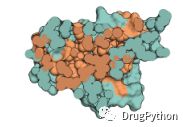
在折叠的蛋白质中,一些氨基酸在表面,一些氨基酸被埋在蛋白质的核心。水溶性蛋白质的表面包含极性、带电和非极性基团的混合物。如图1.12所示,核心主要为非极性氨基酸,这意味着蛋白质折叠的关键力量是类油氨基酸聚在一起以避免与水接触。油水不相容。所以蛋白质像油滴一样折叠起来,它的非极性氨基酸被埋在核心中,其余的氨基酸在表面。
图1.12 蛋白质具有疏水核心。白细胞介素-4的横截面暴露了蛋白质内部。疏水色氨酸、苯丙氨酸等是橙色的,其他所有残基都是蓝绿色的。疏水残基容易被埋没,而极性残基大多分布在其表面。
一个折叠的蛋白质链有广泛的氢键。氢键是两个可以共享一个氢原子的化学基团之间的非共价相互作用。这两个共享的基团分别被称为氢键供体和受体。一个折叠的蛋白质包含不同氨基酸之间广泛的C=O···H−N氢键主链。酰胺基是氢键供体,碳基是受体。从供体到氢,从氢到受体的几何形状几乎趋于共线。此外,蛋白质也可以与水形成氢键。水分子可以提供氢或接受氢。氢键也可以在蛋白质的侧链之间或主链和侧链原子之间形成。氢键是最常见的蛋白质亚结构的突出特征,主要分为两种:α-螺旋和β-折叠。
另外,半胱氨酸是一种氨基酸,它终止于一个巯基(也称为硫醇)基团(−SH)。在氧化条件下,两个不同的半胱氨酸侧链可以相互形成共价键,称为二硫键(−S−S−)。(通过在蛋白质溶液中添加还原剂,可以打破二硫键。)二硫键在蛋白质内部或两个蛋白质之间作为交联,并可以传递热和机械稳定性。双硫键是除了酰胺键之外的一种特殊的键。
-天然蛋白具有紧凑而明确的三维结构
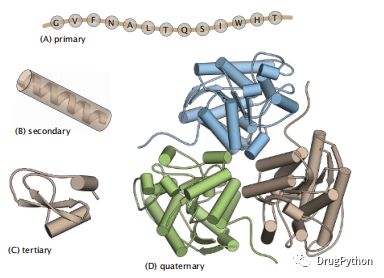
蛋白质有各种形式的内部结构,根据结构水平命名为一级、二级和三级四级(图1.13)。蛋白质的一级结构是指其氨基酸的线性序列。二级结构是指螺旋和β-折叠,这是蛋白质中两种主要的氢键规则(有序)亚结构。在平均蛋白质中,约60%的氨基酸残基参与α-螺旋或β-折叠。下一个更高层次为蛋白质的三级结构,指的是其二级结构元素及其连接圈、环或螺旋片段的三维排列。蛋白质的三级结构用“四螺旋束”或“β-桶”来描述,反映了二级结构元素的几何形状。三级结构是通过氨基酸之间的三级接触(通常是疏水的相互作用)来稳定的,这些氨基酸在序列上很遥远,但在空间上很接近。多链(也称为多聚体)蛋白质的四元结构通常通过单个亚基之间的非共价相互作用结合在一起。例如,血红蛋白具有四级结构;它由四个亚基或单体组成,它们对称组装(但不是共价键)形成四聚体结构。纤维蛋白通常具有由共价桥来稳定的四级结构。接下来具体介绍α-螺旋以及β-折叠等二级结构。
图1.13 蛋白质的结构有四个层次。(A) A蛋白质的一级结构是其氨基酸序列。(B)二级结构是螺旋结构和β结构。在这里,α-螺旋用圆柱体表示。(C)三级结构是单个蛋白质链中所有结构元素的排列(箭头所示),而(D)四级结构是蛋白质中两个或多个链的组装。在这里,我们展示了精氨酸酶(尿素循环中的一种三聚体酶的四元结构)。
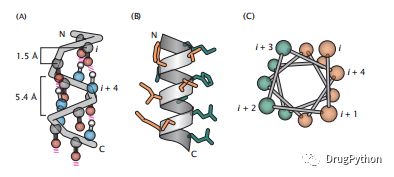
蛋白质结构的一个主要组成部分是α-螺旋结构。在α-螺旋中,蛋白质主链围绕其长轴螺旋(图1.14)。每个螺旋转弯由3.6个氨基酸组成,螺旋在连续转弯之间有5.4 Å的螺距(或每个氨基酸上升1.5 Å[沿螺旋轴的投影距离])。在螺旋的中心只有很少的空白空间。α-螺旋结构的广泛出现有两个来源。首先,它是这些(φ,ψ)角的一个能量可接近的构象(见图1.7)。第二,α-螺旋是由氨基酸i的碳基氧和氨基酸i + 4的酰胺氢之间的氢键来稳定的(见图1.14)。α-螺旋可以由任何一种氨基酸(脯氨酸除外)形成,因为氢键供体和受体都是主原子。
图1.14 蛋白质中α-螺旋结构的不同表示。(A常规的主链路径由残基i的碳基O和残基i + 4的酰胺H之间的氢键维持,这里用红色的弹簧状连接表示。连续的α-碳以围绕螺旋轴的100◦的间隔占据角位置(每整转360◦得到3.6个残基)。注意前三个N−−H基和最后三个C=O基不是氢键。(B)虽然α-螺旋中主链的路径是固定的,但侧链(这里所示为棒状)可以更自由地旋转。通常,螺旋是两亲性的,一边是疏水残基(橙色),另一侧是亲水残基(蓝绿色)。(C)两亲性用螺旋轮图表示,显示侧链为围绕中心螺旋轴观察的球体。
有趣的是,α-螺旋的存在是由莱纳斯·鲍林和他的同事在20世纪50年代早期提出的,在在自然界[6]中被发现之前。当时,聚合物具有螺旋结构也就不足为奇了。许多类型的线性聚合物链往往会形成各种螺旋结构。想想一个固定的扭转角的向量串。如果这个角度是180◦,链条将是一个线性杆。但对于任何其他角度,聚合物都将是一系列重复的扭曲步骤,而这就定义了螺旋。典型的非生物聚合物有一个单一的有利重复角度(在低温下),所以它们结晶成螺旋结构。大约一半已知的聚合物晶体结构采用了22种不同类型的螺旋的其中之一。鲍林的正确预测令人惊讶的是,蛋白质螺旋每回合的单体数是非整数,一般为3.6。鲍林的关键观点是,肽螺旋将通过主链单元之间的氢键来稳定,从一个氨基酸的碳基到另一个氨基酸的酰胺基。
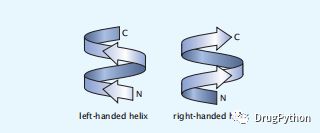
图1.15 右螺旋和左螺旋之间的对比。
螺旋有一种叫做手性的特性。螺旋可以是右旋的,也可以是左旋的,基于它螺旋状的方向(图1.15)。球状蛋白中的许多螺旋也具有“侧边性”的特性。这些螺旋被称为两亲性或两亲性,一边有一条疏水氨基酸的条纹,另一边有一条亲水氨基酸的条纹。疏水条纹通常在蛋白质结构中向内,朝向蛋白质核心。一个简单的可视化螺旋长度的模式的装置是一个螺旋轮图,如图1.14C所示。
β-折叠是一种类似于火车轨道的结构,其中两个或更多的部分,称为β链,并排排列(图1.16)。成对的链由酰胺到碳基的主链氢键从一条链到另一条链连接在一起。如果两条链的N→C方向相同,则该结构为称为平行β-折叠。如果链沿相反方向交替运行,则称为反平行。氨基酸的侧链通常位于折叠平面的上方或下方,在那里它们可以与相邻链的侧链以及相邻板上的侧链相互作用。β-折叠由(i)氢键稳定;(ii)侧链相互作用,通常是非极性基团;(iii)拉马钱德兰图的β区域的有利(φ,ψ)角度(见图1.7);(iv)通过它们实现的良好包装。良好的包装被范德华力所稳定。
图1.16 平行β折叠和三明治的结构。左列显示了(A)平行和(C)反平行β折叠的氢键模式。在右边,成对的薄片被倾斜,所以你可以看到疏水侧链触点夹在(B)平行和(D)反平行薄片之间。
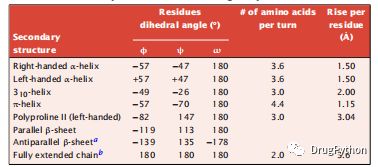
蛋白质中最常见但不是唯一的二级结构类型。另一种类型是π-螺旋,它在残基(i,i + 5)之间形成一个氢键,而不是在α-螺旋中形成的(i,i + 4)。另一个例子是310-螺旋,其中氢键是在残基之间(i,i + 3)。310-螺旋每圈有三个残基,环上有10个原子被氢键关闭。它有时在短肽中发现,偶尔在蛋白质中发现,但它的氢键不太稳定,它的侧链包装不太稳定,它的偶极子比α-螺旋中的氢键排列差。π-螺旋是罕见的,因为它的上升时间很短,使侧链非常接近。另一种类型的螺旋,称为多脯氨酸II螺旋,存在于具有高脯氨酸含量的链中,如胶原蛋白(表1.2)。
表1.2 蛋白质构象的几何参数。
一个蛋白质的二级结构的组成部分还有turn和loop。事实上它们并不是二级结构。turn是3到5个残基的链段,通常以明确的几何形状折叠,并由局部氢键稳定。loop是较长的链段,通常结构较少。Reverse turn是链条反向方向的地方。反转倾向于由极性残基、甘氨酸和脯氨酸组成,而loop则往往没有这种偏好。因为它们是极性的,Reverse turn转弯往往位于蛋白质表面。甘氨酸中很常见,因为它由于缺乏侧链阻碍而容易扭曲。脯氨酸也很常见,因为它有一个不寻常的特征,它的主干被限制在化学环结构。有时,螺旋的N端有一个末端盖层的氢键。在螺旋的末端,主碳基和酰胺基可能有不满意的氢键。在这种情况下,侧链(例如丝氨酸)可以通过折叠到主链上与未实现的主氢键形成氢键。