Molecular Psychiatry:海马及其相关网络在电休克抗抑郁中的机制研究
抑郁症是一类以抑郁心境为主要特点的情感障碍。它主要包括:重度抑郁症、持续性抑郁症、季节性抑郁症。它们的共同表现为:长时间持续的抑郁情绪,并且这种情绪明显超过必要的限度,缺乏自信,避开人群,甚至有罪恶感,感到身体能量的明显降低,时间的感受力减慢,无法在任何有趣的活动中体会到快乐。这类障碍还会造成患者的躯体功能失调,如睡眠紊乱或食欲暴进或减退、痛觉等。生物学、心理学和社会因素对这类疾病的发病都有影响。生物学着眼于体内化学物质不平衡、遗传和生理节律,心理学因素则包括素质应激相互作用、习得性无助和认知模式,社会因素方面研究人际关系和社会支持。对抑郁症的诊断一般由遵照DSM或ICD标准(两者基本一致)而定。
一般症状较重的患者考虑诊断为重性抑郁障碍,症状较轻但是病程较长的患者则有可能是心境恶劣障碍,有明显的季节性特征的患者可以诊断为季节性情绪失调。另外,在按此标准诊断前一般还须排除其他有相似症状的生理疾病。目前在世界范围内抑郁症的发病年龄提早,发病率增加。终身患病率在不同国家中不尽相同,有调查显示中国的患病率约为6%。在积极治疗的情况下抑郁症的愈后良好,但考虑到患者须承受极大痛苦并有自杀的可能,因此尽早尽快进行积极治疗是十分必要的。患者在症状完全缓解后还可能经历复发,世界卫生组织建议对抑郁症的药物治疗至少持续到症状缓解后的六个月。对于发病较早、有精神病症状或对药物反应不良的患者则很有可能反复发作造成不良后果。由于抑郁症的复杂性,临床治疗中,将抑郁评分减轻50%以上的患者的定义为抑郁治疗有效的患者。
电休克疗法(Electroconvulsive therapy,ECT)是一种经由电刺激脑部的方式来诱发痉挛,以治疗精神疾患的治疗手段;是当所有药物和心理疗法都无效/需要短时间出现治疗效果时,用来治疗重度抑郁症方法。它起源于20世纪30年代。在麻醉和肌肉松弛剂的使用下,现代ECT技术已相当安全,并成为患有精神病患的孕期妇女较安全的疗法(因为抗精神病药物可能对胎儿造成伤害和畸胎,而ECT物理治疗只作用在脑部,因而相对较安全)。目前的ECT治疗先须麻醉和肌肉松弛,因此病患在治疗过程不会感觉到痛苦和不适。ECT的大致可分为双侧和单侧ECT。双侧ECT又可再细分为双侧颞叶和双侧额叶电休克疗法。在双颞叶ECT,电流经由通过双侧大脑颞叶达到疗效,电击放置在头部两侧。单侧疗法多将电击放置在右侧颞叶。已有的研究发现,单侧ECT能造成长时记忆的丧失、效果较低、且起效慢。对重性抑郁患者无效。而双侧ECT法副作用较少及所需电流较低。双侧额叶ECT法是双侧颞叶ECT法的改进方式,没有记忆丧失的副作用,而且它可促进大脑额叶的血液循环。很多临床研究肯定了ECT在重度抑郁症等精神疾病的效果,但是ECT能够产生效果的患者(即,抑郁评分减轻50%以上的患者)在人群中只占60%~70%。同时,ECT的治疗效果维持时间较短,长期使用时,需要与药物配合使用。
同时,已有研究表明,ECT与海马的神经可塑性有关。已有的研究表明,海马及其周围皮层灰质体积的变化与抑郁症状的增加无关;而在使用ASL(动脉自旋标记)成像发现,ECT后右侧海马前部静息状态下的大脑活动增加。但是海马的这种变化在治疗有效组(抑郁评分减轻50%以上的患者)和治疗无效组(抑郁评分减轻50%以下的患者)中具有显著差异,这与结构方面的meta分析的结果一致。值得注意的是,ECT后,右侧海马前部的白质连接和微结构都在治疗有效组呈现出显著变化,而在治疗无效组则无明显变化。综上,海马的可塑性可能与ECT技术治疗抑郁症的效果具有潜在的关系。在神经科学研究中,我们知道,海马在大脑中发挥作用的途径包含局部和全局两种方式。局部方式是指,局部海马结构在大脑认知功能中发挥的作用;全局功能是指,通过与其他脑区的协作,海马实现其在大脑认知调节中的作用。
但是,海马与ECT中抗抑郁机制的关系尚不清楚。在已有的研究神经科学的研究中,我们得知,某个固定脑区及其子结构的作用对于大脑相关认知功能的影响在局部和全脑均有体现。而基于T1加权相的灰质结构体积、ASL(动脉自旋标记)成像的脑血流灌注和功能网络能够从局部和全局的角度为大脑相关认知功能的改变提供局部和全局的机制探索视角。本文发表在Molecular Psychiatry杂志。
研究思路:
研究目的:从局部和全局功能角度,探索海马的可塑性可能与ECT治疗抑郁症的效果之间的潜在关系
数据收集:
1. 被试筛选依据:57个ECT有效的抑郁症病人(responders(有反应)和no-responders(无反应))和36个健康对照的被试。两组被试在人口学信息上完全匹配。
2. 行为学数据收集/影像学数据收集期间被试行为控制:在ECT开始前,对所有被试进行宣传教育,并使用标准的ECT流程,在治疗期间对其进行管理。对所有被试进行四次的行为学数据收集,数据收集时间为:
①.第一次ECT开始前24h,将此时的数据设置为基线数据;
②.在第三次ECT开始前(基线数据4天后);
③.在被试的ECT临床疗效确定后,即将抑郁症病人分为responders和no-responders(基线数据4周后);
④.ECT疗效确定后6个月。
其中,对non-responders的数据收集截至到③。
3. 数据收集:在每次数据收集时,对被试进行多模态磁共振数据、视空间的认知测试和抑郁症评分数据的收集。磁共振数据包括:动脉自旋成像、T1加权相和功能数据。认知测试包括简化版的修正的视空间记忆测试(Brief VisuoSpatial Memory Test Revised, BVMT)和修正的霍金斯词汇学习能力测试(Hopkins Verbal Learning Test Revised, HVLT)。被试的抑郁症评分数据包括:汉密尔顿抑郁测试量表(Hamilton Depression Inventory ,17-item,HAM), 蒙哥马利·奥斯伯格抑郁量表(Montgomery Åsberg Depression Rating Scale,MADRS)和抑郁症状快速清单(Quick Inventory of Depressive Symptomatology,QIDS-SR)。最后抑郁评分取三个量表的均值。
数据处理与分析:
1.ASL-CBF分析:采用voxel-wise的分析方法。对其进行头动校正、空间标准化、数据归一化和平滑,并使用ASL工具包对脑灌注(CBF)数据进行量化建模。
2.灰质体积分析:采用voxel-wise的分析方法。使用SPM8对数据进行组织分割和空间标准化,随后得到灰质体积(GMV),并对其进行数据质量检查和平滑。
3.海马功能网络(HCN)分析:对数据进行时间层校正、头动校正、和0.01Hz以上的高通滤波。CBF中具有显著性的cluster,被选作功能连接网络中的一个点。同时根据健康对照的数据,选择其他点;皮尔逊相关系数作为网络中边的度量。共构建三个网络(见下文)。
4.统计分析:所有的数据使用R语言进行统计分析。使用海马、杏仁核和海马旁回的模板将体素水平的统计分析限定在固定区域内。将responders和no-responders的CBF和GMV图像分别进行线性建模。在追踪CBF和GMV在ECT介入前后的治疗中,我们将时间作为自变量,将年龄、ECT电极安放位置、治疗次数和GMV/CBF作为协变量(追踪CBF时,GMV是其中一个协变量;追踪GMV时,CBF是其中一个协变量)。同时,我们使用一样的建模方式,对治疗时间及其和治疗效果(抑郁评分的改变)的交互因素进行线性建模。为了确定responders和no-responders的CBF和GMV改变的峰值位置,我们使用p<0.05,cluster size>25的阈值,并使用留一法的二次抽样实验进行验证(p<0.05,cluster size>25)。寻找出具有稳定性差异的cluster。并将其取值与视空间记忆测试得分进行相关性分析。同时将经过验证的,具有稳定性差异的CBF的cluster被作为HCN分析中的种子点,同时根据已有研究,选定其他种子点(共组成3组种子点)。并使用4mm作为种子点的半径。然后对responders和no-responders中ECT介入前后的HCN(海马功能网络)分别进行比较。然后计算得到每个被试的网络强度和海马的节点中心度。同时,使用考虑交互作用的线性模型,将短期治疗(治疗2次后)和长期治疗(临床指标发生变化)后的抑郁评分和时间的交互效应作为自变量,将年龄、ECT电极安放位置和治疗次数作为协变量。对网络强度和节点中心度分别进行FDR校正。
结果与讨论:
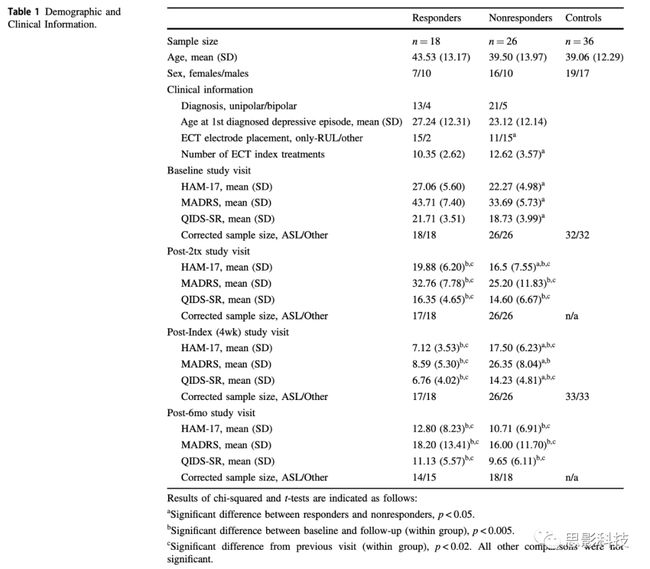
表1. 人口学与临床信息
a. responders和no-responders人群具有显著性差异,p<0.05;
b. ECT治疗前后(基线状态下与治疗后)具有显著性差异(组内比较),p<0.005;
c. 其他不具有显著性的比较
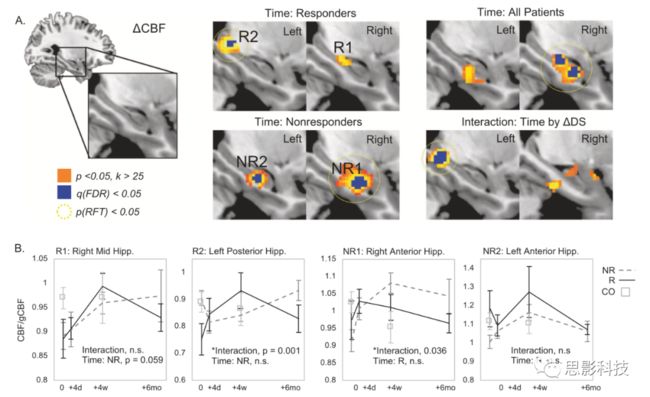
图1.responders和no-responders人群海马及轴为组织的局部CBF的增加
a.右侧海马中部和左侧海马前部CBF的增加
b.局部CBF与全局CBF的比值随着ECT治疗时间的变化
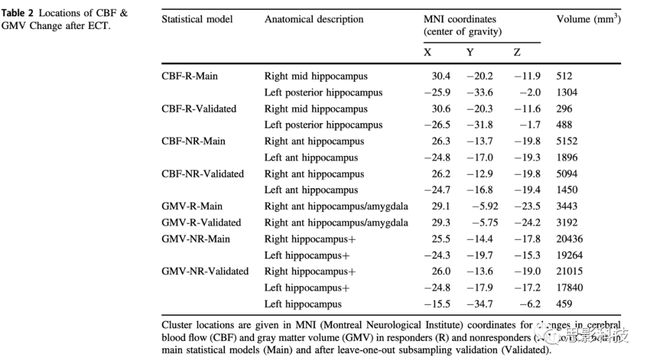
表2.ECT治疗后,局部CBF和GMV的变化
R代表responders;NR代表no-responders;validated代表留一法下二次抽样实验的验证。
图2. ECT治疗后局部GMV的增加
a. 右侧海马前部和杏仁核在ECT治疗后GMV的增加;
b. 局部GMV均值随着治疗时间的变化
R代表responders;NR代表no-responders;Co代表健康对照
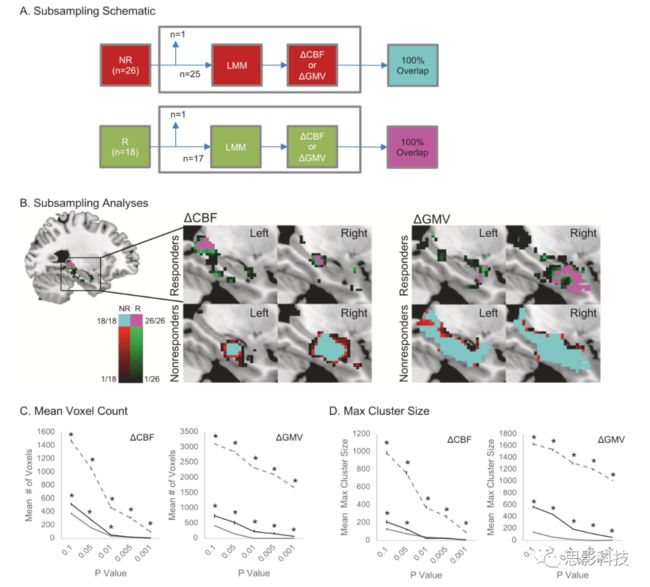
图3.responders和no-responders人群留一法二次抽样实验验证后得到的CBF和GMV增加的区域。
a.留一法二次抽样验证的分析路径;
b.CBF和GMV经过验证后的,具有显著性改变区域;
c.留一法下的平均体素计数下的阈值;
d.留一法下的最大体素计数下的阈值。
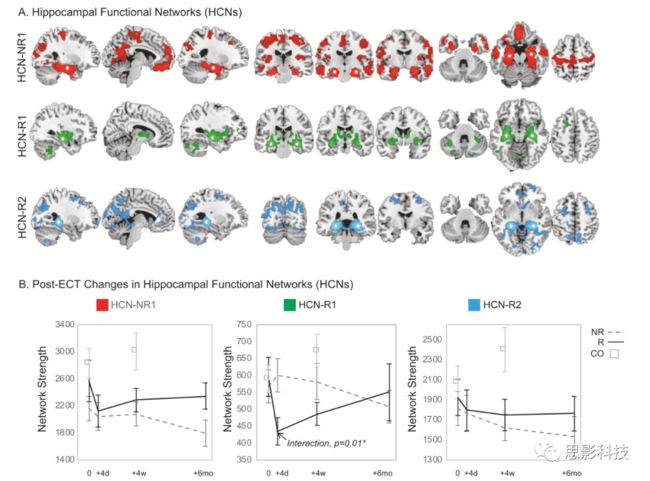
图4.HCN分析
a.基于CBF显著变化的海马功能网络。NR1代表no-responders.R1代表responders右侧海马中部CBF增加相关的网络;R2代表responders左侧海马后部CBF的增加相关的网络
b.海马的网络强度随着ECT治疗时间的变化
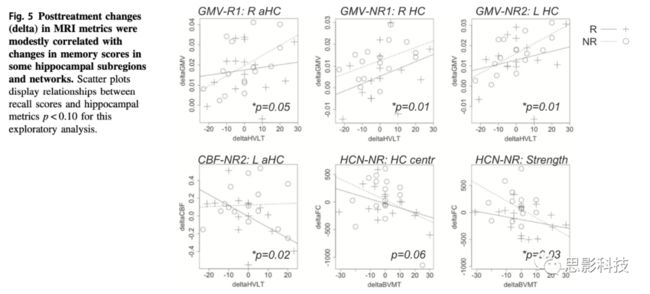
图5.治疗后海马区域及其相关网络的变化与记忆得分的相关性分析
由行为学/人口学数据结果可知,responders、non-responders和健康对照组在年龄性别等方面均无显著差异。而在ECT治疗方式上,non-responders人群更少地采用右侧单边治疗手段。responders和non-responders在ECT治疗后,都呈现出显著的好转;由CBF的分析结果可知(采用第③次收集到的数据),responders组CBF增加的区域主要分布右侧中部海马和左侧后部海马区域。non-responders组,CBF增加的区域则主要出现在双侧海马前部;由GMV的分析结果可知,ECT治疗后双侧均呈现出大区域的GMV的改变。在responders中,右侧海马前部和杏仁核区域呈现出GMV的变化;由HCN数据分析结果显示,responders人群中,基于右侧海马中部构建的功能网络的网络强度与第二次数据收集时CT治疗时间具有显著的交互效应。
结论:
本研究从结构和功能的角度对海马及其周围组织与ECT抗抑郁治疗中的临床效果之间的关系进行了研究。研究结果提示,海马的可塑性可能是ECT治疗抑郁的具体机制。
编者注:
二次抽样实验:基于二次抽样的多重检验实验。
ASL-CBF分析:包括基于体素的全脑分析和基于手绘感兴趣区域(ROI)的分析。基于体素的全脑分析具有客观性、全面性、数据驱动、节省人力、及适用于无可见病灶的脑疾病等特点,但同时,其对于个体差异不敏感、解剖位置对应错误、以及由于平滑引入虚假信息等缺点。基于ROI的分析具有,对个体变异敏感、较准确、适用于局灶性可见病灶的定量分析等优点;但也具有假设驱动、逐层手绘,工作量较大、需要解剖知识储备、以及主观性强等特点。ASL分析中,我们使用基于MATLAB和SPM的ASLtbx对CBF进行计算。在voxel-wise的CBF计算中,需要首先对数据进行原点矫正、头动矫正、ASL图像和每个被试的T1加权相的图像配准、空间标准化、平滑。同时,为了去除颅外体素,需要对平滑后的图形进行一个剥头皮的操作。随后在MATLAB中输入asl_perf_substract对数据进行CBF的计算。并对CBF计算后得到的数值进行归一化。即可得到单个被试的CBF图像,将其放入广义线性模型中进行统计分析即可。
灰质体积分析:隶属于基于体素的形态学测量分析(VBM)中的一个指标。VBM的测量同样包含基于ROI和基于全脑体素的两种分析。在voxel-wise的分析中,需要实现对T1加权像的数据进行预处理。预处理包括组织分割和空间标准化。随后使用SPM进行灰质和白质体积/密度的计算。对计算得到的数据进行平滑后,将其放入广义线性模型中进行统计分析即可。
HCN(海马功能网络)分析:实验中,根据健康对照的数据进行海马网络的定义。首先根据CBF中二次抽样的结果获得三对种子点。然后设置4mm的半径,从健康被试中,将该区域的时间序列信号提取出来,并作为功能网络构建中一阶分析中的协变量,同时使用单个被试这三对种子点的时间序列作为自变量。在二阶分析中,我们使用广义线性模型去探索与每对种子点的功能连接相关的边,并设置P<1*10^(-10)。
多重比较校正:在统计上就需要用 p-value 来衡量一个判断的正确性。p-value 就是在原假设(Null hypothesis)为真时,得到和试验数据一样极端(或更极端)的统计量的概率;它本质上控制 false positive rate (FPR)。我们常说的 p 小于0.05即是说发现的现象为假阳性结果的概率小于5%。如果我们手上有10000枚上文提到的相同的硬币要检验呢?假设针对每枚硬币依然采用以上的方法,则这10000次检验完全不出错的概率只有 (1 - 0.05)^ 10000。这在很多情况下不能接受的。此时我们面对的不再是 single test 问题,而是 multiple test。需要控制的是 family wise error rate (FWER)。一种很经典的控制FWER的方法是 Bonferroni correction。比如我们设定FWER为0.05,则可以将所有10000次检验中,出现错误的概率控制在5%以内。但面对 fMRI 这样的数据,Bonferroni correction 则显得不太合适了。Bonferroni correction 是否适用,取决于数据是否服从一个基本假设:即每次 test 是否独立。像上面举的抛硬币的例子,每抛一次,显然都是独立事件。但像 fMRI 这样邻近 voxel 的信号往往具有高相关的数据,Bonferroni 矫正显然不太适用了。为了针对这种情况,人们选择使用了 Random-field Theory (RFT) 进行 FWE correction。其基本假设就是空间邻近的 voxel 具有相关(也可以说是存在由空间平滑造成的相关),则在检验前,先估算数据的平滑程度,再基于这一指标计算某个 voxel 不是由随机因素引起激活的概率。这种方法相对前一种相对宽松很多,但研究发现,其假设要求平滑程度至少要为数据最小空间分辨率的2-3倍(而且平滑程度越大,检验效果越宽松),使得许多研究无法采用此方法,同时也有研究表明这种矫正方式同样过于严格。鉴于以上问题,以及对 FWE 概念的理解,随之我们采用了一种新的方法,FDR(False Discovery Rate)错误控制方法。FWE correction 保证的是在已通过多重比较校正的显著的检验中,出现假阳性结果的概率不大于某一值(比如0.05),即发现的显著结果中出错(哪怕只有一个错误)的概率小于0.05。但研究者也都有一个信念:我们的数据是存在噪声的,我们希望知道这些显著的结果中,有多少是真的。FDR 方法有效的控制了在这些阳性结果中的错误出现率。比如在上文中提到的10000个检验中,只发现1000个阳性结果,即硬币质量分布不均,则若控制FDR的q-value为0.05时,只对这1000个检验进行操作,并保证最后经过校正的检验结果中出现假阳性的结果的数量不多于50个(1000 * 0.05)。相对 FWER,FDR 在对结果的控制上显然要宽松很多,同时也给研究带来了更多的“有效”结果。需要提一下的是,在 FDR 校正中,对于 p-value 最小的检验,其校正的力度最大,随 p-value 增大,校正力度逐渐减小,这也体现了其减少假阳性结果的目的。(脑影像统计检验可参考思影科技之前的文章,进行了解):
如需原文及补充材料请加思影科技微信:siyingyxf 或者18983979082(杨晓飞)获取,如对思影课程感兴趣也可加此微信号咨询。觉得有帮助,给个转发,以及右下角点击一下在看,是对思影科技莫大的支持。
![]()
微信扫码或者长按选择识别关注思影
非常感谢转发支持与推荐