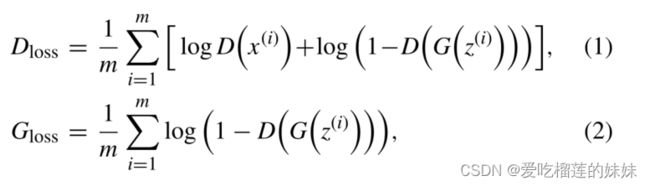基于生成对抗网络的癫痫发作预测2019
Epileptic Seizure Forecasting With Generative Adversarial Networks
摘要:
癫痫发作预测是最具挑战性的预测数据分析问题之一,许多杰出的研究报告了有前景的结果。这主要是因为脑电图(EEG)生物信号强度非常小,在µV范围内,在生理和非生理伪影下存在显著的感知困难。今天,精确的癫痫发作识别和数据标记的过程是由神经学家完成的。目前癫痫发作活动的不可预测性,以及对耐药癫痫患者缺乏可靠的治疗,迫切需要对准确、敏感和针对患者的癫痫发作预测进行研究。大多数癫痫发作预测算法仅使用标记数据进行训练。由于癫痫发作数据是由神经科医生手工标记的,准备标记数据既昂贵又耗时,因此充分利用数据至关重要。在这篇文章中,我们提出了一种方法,既可以利用标记的脑电图信号,也可以利用更容易获得的未标记的脑电图信号。我们使用28秒脑电图窗口的短时傅里叶变换作为预处理步骤。
生成对抗网络(GAN)以无监督的方式进行训练,其中癫痫发作的信息被忽略。训练后的GAN鉴别器被用作特征提取器。特征提取器生成的特征对标记的脑电图信号进行两层全连通(可被任何分类器替代)的分类。对于CHB-MIT头皮脑电图数据集、Freiburg医院颅内脑电图数据集和EPILEPSIAE数据集,这种半监督患者特异性癫痫发作预测方法的工作特征曲线(AUC)下的样本外测试面积分别为77.68%、75.47%和65.05%。不需要标记的无监督训练很重要,因为它不仅可以在EEG信号记录过程中实时进行,而且不需要针对每个患者进行特征工程。据我们所知,这是GAN在癫痫预测中的首次应用。
本文的贡献包括:
•证实使用GAN进行癫痫发作预测的无监督特征学习可跨多个癫痫脑电图数据集推广。
•弥合监督和半监督方法之间的差距。
•将患者特异性特征与癫痫发作预测性能联系起来。
2.该方法
A.数据集
表1总结了在这项工作中使用的三个数据集:CHB-MIT数据集[21],Freiburg医院数据集[22]和EPILEPSIAE数据集[23]。CHB-MIT数据集包含23名儿童患者的头皮脑电图(sEEG)数据,连续844小时的sEEG记录和163次癫痫发作。使用22个电极以256的采样率采集头皮脑电图信号。我们定义的间隔期是发作前和发作结束后至少4小时的间隔时间。在这个数据集中,有多次癫痫发作发生在彼此相邻的情况。对于发作预测任务,我们感兴趣的是预测先兆性癫痫发作。因此,对于距离前一次发作不到30分钟的发作,我们将其视为仅一次发作,并将前导发作的发作作为合并发作的发作。此外,我们只考虑每天发作少于10次的患者进行预测任务,因为对平均每2小时发作一次的患者进行预测任务不是很关键。根据上述定义和考虑,有13例患者有足够的数据(至少3次前驱癫痫发作和3个间期时间)。
弗莱堡医院的数据集包括21例顽固性癫痫患者的颅内脑电图(iEEG)记录。由于数据集缺乏可用性,我们只能使用13名患者的数据。采样率为256hz记录iEEG信号。在这个数据集中,有6个记录通道来自6个选定的接触者,其中3个来自癫痫发生地区,其他3个来自偏远区域。对于每个患者,至少有50分钟的预测数据和24小时的间隔时间。关于Freiburg数据集的更多细节可以在[4]中找到。
EPILEPSIAE是最大的癫痫数据库,包含275名患者[23]的脑电图数据。本文对30例前导性癫痫发作患者的头皮脑电图进行了分析,共261例,发作间隔时间为2881.4小时。时间序列脑电图信号以256 Hz的采样率记录,来自19个电极。给出了基于脑电图和视频分析两种方法获得的癫痫发作信息。在我们的研究中,我们使用基于脑电图技术的癫痫发作信息,其中发作是由经验丰富的临床医生[23]通过对脑电图信号的视觉检查来确定的。
b 预处理
由于我们将使用带有三个去卷积层的生成神经网络(GAN)体系结构,GAN输入的维度必须能被23整除,除了通道的数量。针对CHB-MIT数据集,由于电极的变化,部分患者的脑电图记录通道不足22个。特别是,Pat13和Pat17只有17个可用通道;Pat4、Pat9分别有20、21个通道。由于我们感兴趣的是GAN是否可以用非患者特定的数据进行有效训练,所有患者必须具有相同数量的通道,这样所有患者的数据才能合并。我们遵循[24]中的方法为CHB-MIT数据集中的每个患者选择16个通道。
针对CHB-MIT和Freiburg数据集,我们采用短时傅里叶变换(STFT)将28秒的时间序列脑电图信号转化为由频率轴和时间轴组成的二维矩阵。对于STFT,我们使用1秒长和50%重叠的余弦窗口。对于CHB-MIT数据集和Freiburg数据集,大多数脑电图记录都受到60hz(见图1a)电力线噪声的污染。当电源频率为50hz时,排除47hz ~ 53hz、97 Hz ~ 103hz范围内的部件;当电源频率为60hz时,排除57hz ~ 63hz、117 Hz ~ 123hz范围内的部件。直流组件(0 Hz)也被删除。图1b为去除电力线噪声后28秒窗口的STFT。我们还修剪了最后两个频率127-128 Hz的分量,使每个预处理28 s的最终维度为(通道数× X × Y) = (n × 56 × 112),其中X和Y分别为时间和频率维度。对于CHB-MIT数据集、Freiburg hospital数据集和EPIELEPSIA数据集,n分别为16、6、19。
C.对抗神经网络
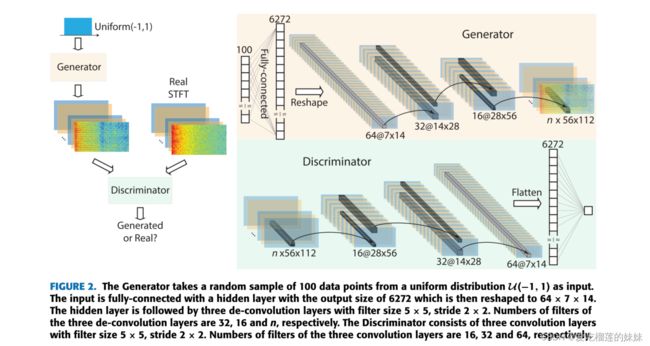
在本文中,我们使用如图2所示的深度卷积生成对抗网络(DCGAN)作为无监督特征提取技术。请注意这里的图1。(a) 28秒窗口的短时傅里叶变换(STFT)示例。(b)去除电力线噪音后同一窗口的STFT。
我们为CHB-MIT数据集解释。同样的解释适用于其他两个输入维度变化的数据集,如第II-B节所述。Generator将均匀分布U(−1,1)中的100维样本作为输入。输入端与隐层完全连接,隐层输出尺寸为6272,再将隐层重塑为64 × 7 × 14。隐层之后是三个去卷积层,滤波器大小为5 × 5,步幅为2 × 2。
三个去卷积层的滤波器个数分别为32、16和n。其输出与28秒脑电图信号的STFT具有相同的维数。另一方面,鉴别器被配置为区分生成的脑电图信号与原始的脑电图信号。该鉴别器由三个卷积层组成,滤波器大小为5 × 5,步幅为2 × 2。三个卷积层的滤波器数量分别为16、32和64。在训练过程中,Generator生成明显类似于原始信号的信号,而Discriminator经过优化以检测那些生成的信号。因此,鉴别器学会了如何通过调整其在三个卷积层中的参数来提取原始EEG信号中的独特特征。这个训练过程是没有监督的,因为我们没有向网络提供标签(前期或间期)。
训练生成对抗网络的思想是让鉴别器(D)和生成器(G)相互竞争,直到它们最终达到平衡。然而,当我们第一次开始训练DCGAN时,我们观察到鉴别器收敛得太快了。这阻止了生成器学习如何生成高质量的STFT样本,这些样本无法与真实的STFT样本区分开来。因此,在生成的STFT样本和原始样本之间进行分类变成了一项琐碎的任务。
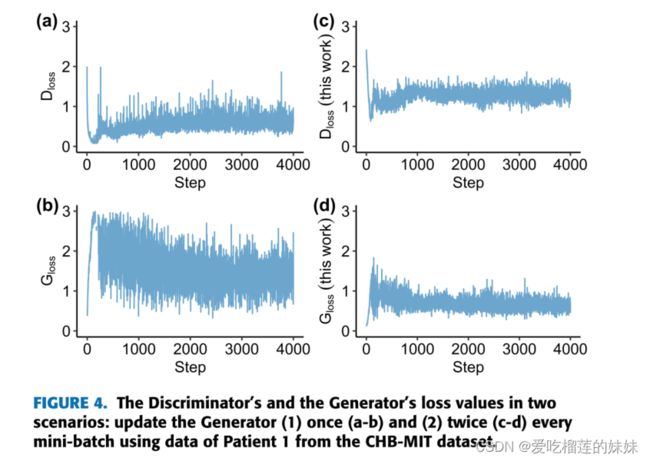
为了克服这个问题,我们更新Generator两次,而不是像[26]中建议的每一个小批次更新一次,并配置一个早期停止监视器来跟踪Discriminator和Generator的损失值。在连续k个训练批次中,如果Dloss始终大于Gloss,则监视器停止DCGAN训练。在这项工作中,我们使用k = 20,批大小为64,Adam进行基于梯度的学习,学习率为1e−4,β1 = 0.5, β2 = 0.999,和∈= 1 e−8。通过可视化损失值,可以验证两次更新Generator的效果。在图4中,我们绘制了在两种情况下Discriminator和Generator的损失值:使用的CHB-MIT数据集的1号患者数据 每小批更新Generator(1)一次,(2)两次。可以观察到Generator的损耗(Gloss)更低,在场景(2)中变化更小,这意味着生成的STFT样本更接近原始样本。一个更好的生成器反过来有助于提高鉴别器的鉴别性能。Generator和Discriminator在大约2000步后达到平衡,此时早期停止监视器停止训练。注意,在收集损失值时关闭早期停止以产生图4。
鉴别器的损失Dloss和生成器的损失Gloss定义为:
其中m为批大小(64),x为EEG信号的原始 STFT, z 从分布U(−1,1)中采样。
我们研究了三种场景下的系统性能:(1)用所有患者的数据(来自同一数据集)进行GAN训练,(2)针对特定患者的方式进行GAN训练(3)以患者特异性的方式训练GAN,并取得改善。在场景(3)中,类似于[12]中提出的数据集平衡技术,我们从现有的样本中生成额外的样本。因此,场景(3)中的训练集比场景(2)中的训练集大10倍。
我们的模型训练是在NVIDIA P100显卡上使用Tensorflow 1.4.0框架进行的。
D.用dcgan提取的特征预测癫痫发作
我们在DCGAN的鉴别器中使用训练好的卷积层作为特征提取器。具体来说,我们将28秒脑电图信号的STFT输入鉴别器,并在其最后的卷积层输出(64 × 7 × 14)采集平坦特征。这些特征现在可以与任何分类器一起使用,以执行发作预测任务。在本文中,我们使用一个简单的神经网络,它由两个完全连接的层组成,sigmoid激活层和输出大小分别为256和2。前者采用sigmoid激活函数,后者采用soft-max激活函数。这两层的dropout率都是0.5。这种双层神经网络的训练是针对患者的。我们还应用了[12]中提出的一种方法来防止神经网络训练过程中的过拟合。特别地,我们执行数据集平衡,然后从训练集中选择25%的后期预测样本和间隔样本来监控是否发生过拟合,并使用剩余的样本来训练网络。
E. 系统评价
在评估系统性能之前,需要定义发作预测水平(SPH)和发作发生周期(SOP)。在本文中,我们遵循[4]中提出的SOP和SPH的定义(见图5)。SOP是预计发作发生的间隔时间。从报警到SOP开始的这段时间称为SPH。
为了正确的预测,癫痫发作必须在SPH之后并在SOP之内。同样,当预测系统返回阳性,但在SOP期间没有发生癫痫时,会出现假警报。当警报响起时,它将一直持续到SOP结束。对于临床使用,SPH必须足够长,以允许充分的干预或预防措施。相反,SOP不宜过长,以减少患者的焦虑。
我们使用了受试者工作特征曲线(AUC)下的面积,SPH为5分钟,SOP为30分钟。为了获得一个稳健的评估,我们对每个受试者采用了一个省略交叉验证方法。如果受试者有N次发作,(N−1)次发作将用于监督训练,保留发作用于验证。这一轮重复N次,所以所有的捕获都只用于一次验证。区间随机分为N个部分。(N−1)部分用于训练,其余用于验证。(N−1)部分被进一步分割为监控集和训练集,以防止[12]过拟合。
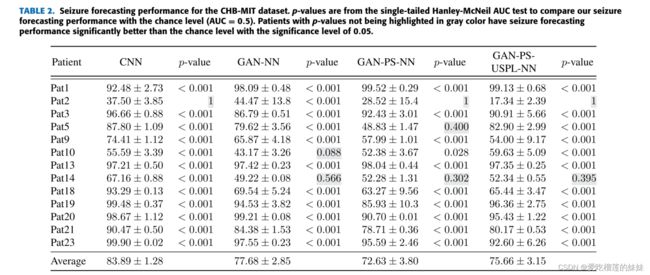
我们将半监督学习模型与使用CNN在之前的工作[12]中报道的全监督学习方法进行了比较。我们还将预测性能与随机预测器进行比较。具体来说,我们使用单尾Hanley-McNeil AUC检验[27]来比较我们的AUC得分与机会水平(AUC= 0.5)。用于Hanley-McNeil AUC测试的AUC值是根据每个患者在遗漏一个交叉验证期间的所有癫痫预测评分计算出来的。
3结果
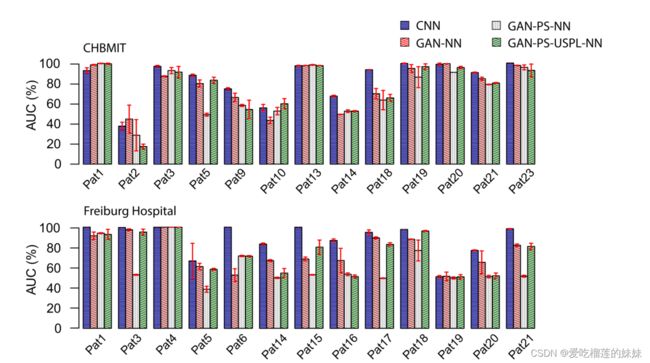
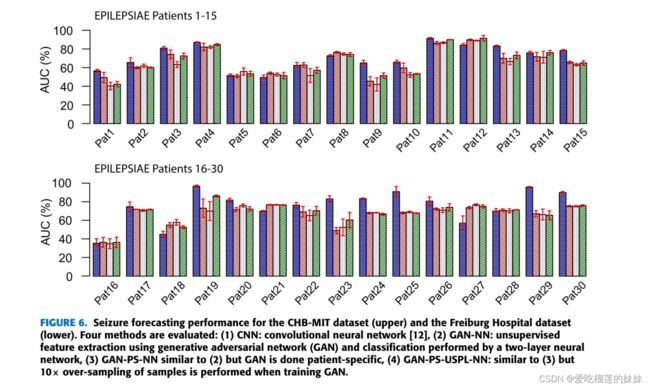
在本节中,我们使用三个数据集测试我们的方法:CHB-MIT sEEG数据集、Freiburg医院iEEG数据集和EPILEPSIAE sEEG数据集。本文采用SOP = 30 min, SPH = 5 min计算所有指标。每一叠留一交叉验证执行两次,报告平均结果和标准偏差。图6总结了SOP为30 min, SPH为5 min时癫痫发作预测结果,具体结果如表2-4所示。
与完全监督的CNN相比,Gan - nn对CHB-MIT sEEG数据集、Freiburg医院iEEG数据集和EPILEPSIAE sEEG数据集分别引入了~ 6%、~ 12%和~ 6.6%的AUC损失。
当每个患者接受GAN训练(GAN- ps - nn)时,三个数据集的平均AUC进一步下降至72.63%、60.91%和63.6%。这可以用每个病人有限的数据量来解释。采用10×上采样(ga - ps - uspl - nn), CHB-MIT数据集和Freiburg Hospital数据集的平均AUC分别提高到75.66%和74.33%,比ga - nn算法低1-2%。对于EPILEPSIAE数据集,与无上采样的患者特异性GAN (GAN- ps - nn)相比,上采样技术提高了总体AUC 2%,与非患者特异性GAN (GAN- cnn)相比提高了0.7%。图7展示了不同模型和数据集的总体捕获性能。表2-4显示,我们的癫痫预测方法在0.05的显著性水平上显著优于大多数患者的机会水平。对于大多数患者,有监督和半监督学习方法(即CNN和GAN-PS-USPL-NN)优于随机预测。对于CHB-MIT数据集、Freiburg医院数据集和EPILEPSIAE数据集,预测性能高于概率水平的患者百分比分别为(92.30%,84.61%)、(100%,84.61%)和(86.67%,86.67%)。
四、讨论
我们已经表明,癫痫发作预测的特征提取可以在无监督的方式下执行。尽管三个数据集的总体AUC下降了约6-12%,但我们的无监督特征提取可以帮助最小化昂贵和耗时的EEG标记任务。具体来说,未标记的脑电图信号被用来训练GAN。经过训练的GAN就像一个特征提取器。从标记的EEG数据中提取的特征(可以比未标记的小得多)可以输入到任何分类器(在我们的工作中有两个完全连接的层),用于癫痫预测任务。
完全监督方法与半监督方法在癫痫发作预测性能上仍有一定差距。我们认为这是因为GAN的训练数据量不够大。这一论点被训练GAN的过采样数据的结果所支持。我们已经证明,在GAN训练过程中对输入进行过度采样有助于填补某些患者的空白,并从总体上提高癫痫预测性能。有理由认为,脑电图数据越多,预测精度就越高。使用无监督特征提取的优点是我们可以在记录脑电图数据的同时训练特征提取器(GAN),即在线训练,而不需要临床医生进行额外的工作。前人使用基于自编码器的无监督特征提取[17]、[18]的灵敏度高于94%,FPR低于0.06/h,但无法与本方法的性能直接比较。
[17]的工作不仅利用堆栈自编码器的无监督特征提取,而且利用先验知识设计特征。因此,还不清楚从堆栈自动编码器中提取的特征对最终性能有多大贡献。此外,该方法仅对两名有颅内脑电图信号的患者进行了测试。
[18]的另一项工作将发作前期定义在发作前期的旁边,这意味着发作预测期(SPH)为零。然而,从临床角度来看,SPH需要足够长的时间来允许充分的干预[12]。
在计算机视觉领域,GAN可以在不影响分类性能的前提下减少标记数据量。不幸的是,以目前可用的数据集的大小,我们无法复制类似的声称使用GAN作为无监督特征提取器预测癫痫发作.
我们认为另一个重要的方面是患者特定的特征,如癫痫发作类型[2],[29],年龄和性别,如何影响癫痫发作预测性能测试与癫痫发作数据集。在这个数据集中,癫痫被分为局灶意识(单纯部分)、局灶意识受损(复杂部分)、局灶至双侧强直阵挛(继发广泛性强直阵挛)和未分类。患者年龄从13岁到67岁不等。就发作类型而言,局灶意识发作在发作预测方面的变异最小。这一观察结果可能有助于临床试验的考虑;例如,首先关注局灶意识癫痫发作的患者。就性别而言,总体而言,女性患者的癫痫预测更好,但有一位女性患者的AUC评分非常低(低于35%)。最有趣的是,与其他组相比,年龄在10至30岁的患者有相当高的AUC评分和较少的变化。事实上,如果我们从10 - 30组中排除AUC评分非常低的患者(这是一个离群值),可以看到,年轻患者(30岁及以下)的癫痫发作可以以最高的准确性预测。这种观察背后的原因不清楚,也不在本文的范围内。
5.结论
在过去的四十年里,人们对癫痫发作的预测能力进行了研究和改进。目前还没有一个完美的预测,但就目前的预测性能而言,向患者提供警告信息是很有用的,这样他们就可以为自己的安全采取一些预防措施。我们已经证明,癫痫发作预测的特征提取可以使用无监督深度学习或GAN完成。使用半监督癫痫发作预测方法,CHB-MIT数据集中的61.53%、Freiburg医院数据集中的53.84%和EPILEPSIAE数据集中的13.33%的患者具有非常好的癫痫发作预测性能(AUC高于80%)。通过我们对患者特异性特征的观察,我们认为30岁以下的局灶意识癫痫类型的女性患者将从这种癫痫预测系统中获益最多。