MCE | 新冠 德尔塔病毒
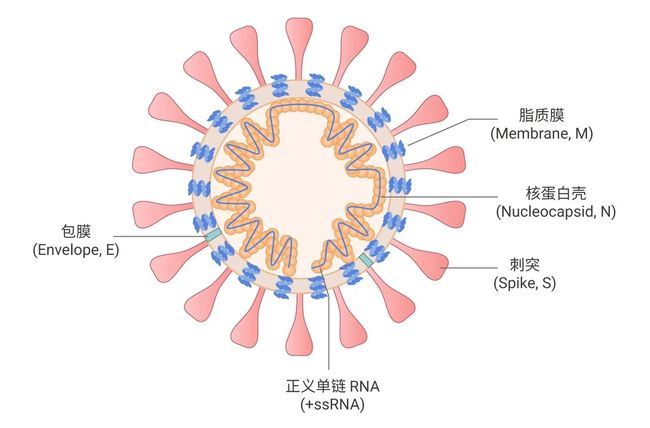
冠状病毒,其表面有突出的棒状尖峰,在电镜下可以观察到像王冠一样的放射状凸起而得名。冠状病毒的基本结构如图 1 所示,包括刺突糖蛋白 (S)、包膜 (E)、膜 (M) 和核衣壳 (N)。
2020 年石正丽教授在 Nature 发表的论文 A pneumonia outbreak associated with a new coronavirus of probable bat origin 就揭示了 2019-nCoV 与 SARS-CoV 两个冠状病毒的相似性。文中表明,2019-nCoV 与 SARS-CoV 基因组同源性高达 79.5%。
国际委员会冠状病毒科研究组 (CSG) 认为2019-nCoV与 SARS-CoV 形成了姐妹分支, 后将其命名为 SARS-CoV-2。
Delta 毒株目前是全球流行的主要新冠病毒变异株。SARS-CoV-2 表面布满凸起的 S 蛋白可分为三部分,顶部的受体结合域 (RBD)、S1 亚基和 S2 亚基。S1 亚基与 RBD 相连,负责与宿主细胞膜上的受体 ACE2 结合,S2 亚基帮助 S 蛋白与受体的结合。Delta 变种仅在 RBD 中就发生 3 处突变:L452R、P681R 和 T478K 突变,这使 S 蛋白与细胞膜上 ACE 受体的结合能力明显提高。
除了德尔塔,拉姆达也开始“发力”了,据全球共享流感数据倡议组织 (GISAID) 的数据显示,美国有 1000+ 例由“拉姆达”毒株引起的新冠肺炎病例。Lambda 变异株是 S 蛋白上发生了 6 个单氨基酸突变 (G75V、T76I、L452Q、F490S、D614G 和 T859N),N 端结构域 (NTD) 存在一段由连续的 7 个氨基酸缺失形成的突变 (RSYLTPGD246-253N)。F490S 突变缺失会帮助病毒获得体液免疫抗性,L452Q 突变会对疫苗诱导血清中和抗体产生抗性。
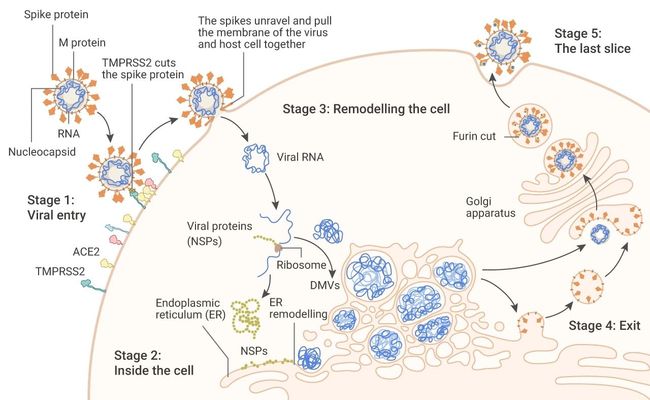
新冠病毒是怎样在宿主中肆意横行的呢?简单点说,就是入侵 (病毒受体结合) → 进攻 (释放自己基因组) → 发扬壮大 (不断合成并排除异己) → 再进攻。
■ 病毒入侵
如果说 S 蛋白是新冠病毒打开宿主细胞“城门”的钥匙,那么 ACE2 受体就是那把锁。S 蛋白一旦与 ACE2 结合,宿主细胞表面的其他蛋白质立刻启动病毒和细胞膜的合并。在这个过程中,TMPRSS2 (一种丝氨酸蛋白酶)可协同内体组织蛋白酶 CatB/L 激活 SARS-CoV-2 入侵细胞。随着“城门”的打开,病毒基因组一拥而入到宿主细胞内 (Stage 1)。
■ 成功进攻
看过历史剧的就知道,野蛮的入侵者打入城门之后,第一件事情就是屠害城中百姓。新冠毒株就有这样的操作:病毒基因组被释放到宿主细胞质后,会被翻译成病毒复制酶蛋白,这些蛋白最后被切割成单独的非结构蛋白质 (NSPs)。NSPs 能迅速抑制宿主细胞信使 RNA 的转译,它们会招募其他蛋白来系统地切割所有没有病毒标签的细胞 mRNA。
■ 排除异己
Nsp1 阻断了核糖体的进入通道,使得宿主的 mRNA 无法进一步合成自身蛋白质,最后导致细胞中的整体蛋白质翻译减少了 70%。此外,一般情况下,被病毒感染的细胞会释放干扰素等提醒免疫系统。但 SARS-Cov-2 为了防止被感染细胞“告密”,还会阻止细胞 mRNA 脱离细胞核。
■ 修建避风港
除了以上机制,在细胞内部 SARS-CoV-2 将细长的内质网 (ER) 转化为双膜囊泡 (DMV),这些双膜囊泡可能为病毒 RNA 的复制和翻译提供了一个安全的场所,使其免受宿主细胞中先天免疫传感器的影响。
■ 离开前的“埋伏”
离开细胞时,SARS-CoV-2 还会留一招让自己变得更容易传播。SARS-CoV-2 的 S1 和 S2 之间有 5 个氨基酸 (其他冠状病毒中只有一个),这对病毒入侵肺部细胞至关重要。Furin 蛋白酶可以识别并剪切这段氨基酸,暴露出 S 蛋白上的开放结构域。经过Furin 切割过的 S 蛋白,二次结合 ACE2 的能力会更强,进而更加容易传播。
这波看下来,这个病毒,从入侵到离开,步步为营,效率之高,速度之快,这起止是毒王,简直是病毒届的卷王。
■ 疫苗是否还有用?“加强针”到底是怎么一回事?
我国目前受新冠影响较大的省份,感染病例多为 Delta 毒株,下面内容以针对 Delta 展开。
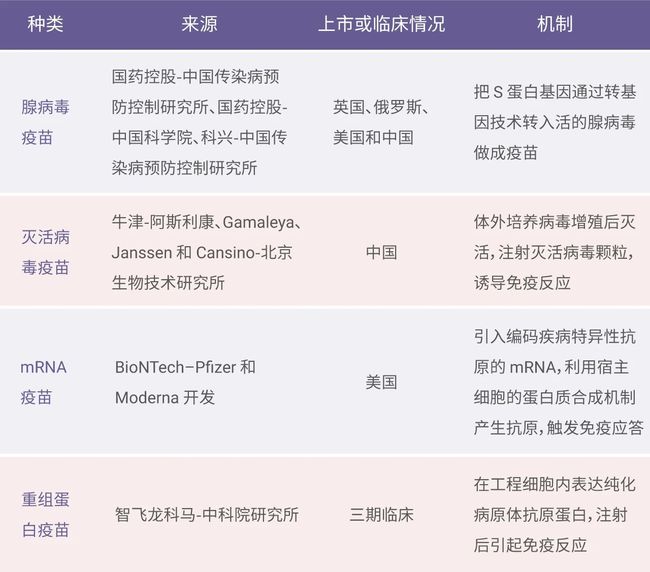
目前报道的确诊病例中,接种过新冠疫苗的不在少数,疫苗的有效性受到高度关注。我国疾控中心研究人员表示:现有的疫苗对新冠德尔塔 (Delta) 变异毒株的效力有所下降,但是仍然有保护作用,下图 3 为现有疫苗。
此外,关于加强针的“说法”愈演愈烈,什么是加强针?第一种:在现有疫苗基础上,再次接种,进而稳固免疫效应。第二种:针对德尔塔毒株的其他疫苗的研发。
■ 再来一针老疫苗!
第三针的临床数据来了 (科兴疫苗之加强针),7 月 25 日,在健康科学预印本论文平台 Medrxiv 上传了多家单位联合开展的关于接种第 3 剂科兴新冠疫苗的免疫原性和安全性临床研究论文,题为 Immunogenicity and safety of a third dose, and immune persistence of CoronaVac vaccine in healthy adults aged 18-59 years: interim results from a double-blind, randomized, placebo-controlled phase 2 clinical trial (未经同行评审)。
研究结果显示,在接种第 2 剂和第 3 剂 CoronaVac (科兴;3 μg) 后的第 28 天,接种者血清中抗体阳性率均高于 90.0%,并且没有严重不良反应。
此外,研究表明,接种 2 针后,虽然中和抗体水平在 6 个月后会显著下降,但由于两剂疫苗接种产生了良好的免疫记忆,在接种第三剂后能够迅速诱导强烈的免疫反应:接种第三剂后 28 天中和抗体滴度比第二剂后 28 天中和抗体滴度增加了 3-5 倍。
■ 针对 COVID-19 的蛋白质亚单位疫苗 (三剂疫苗)
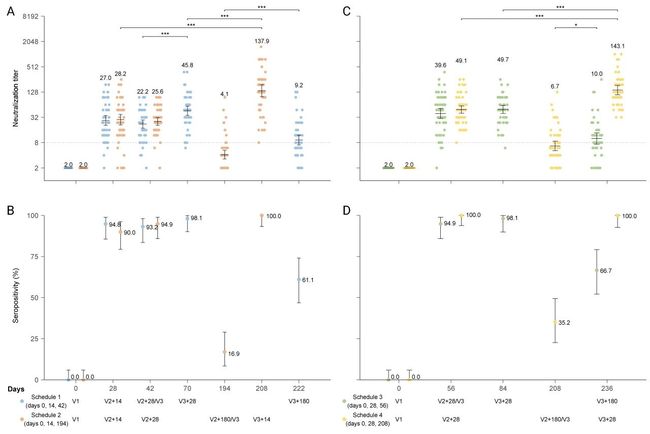
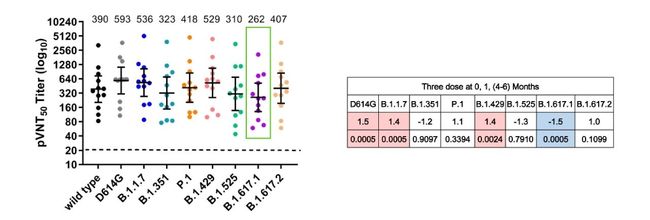
关于蛋白质亚单位疫苗 ZF2001 (COVID-19 的蛋白质亚单位疫苗),一二期实验数据已经表明其良好的耐受性和免疫原性 (PMID: 33773111);三期临床试验对于 ZF2001 进一步的有效性的评估正在进行中 (NCT04646590; 25 μg; 三剂量)。同时,今年 7 月 16 号,中科院微生物研究所戴连攀教授在 bioRxiv 上发表的实验结果:Neutralization of recombinant RBD-subunit vaccine ZF2001-elicited antisera to SARS-CoV-2 variants including Delta。对 28 例接种者血清样本的研究显示,在完整接种三针后,按 0、1、4-6 月接种三剂 ZF2001 疫苗志愿者的血清样本显示针对 Delta 变体的中和抗体不会下降。(如图 5 所示)
■ 新进展——单克隆抗体 2B11
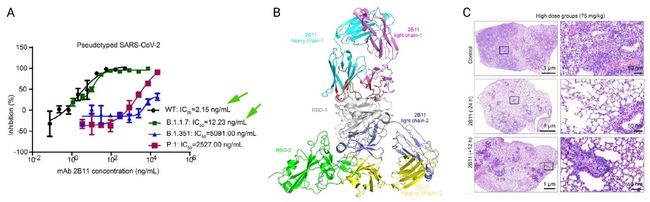
除了“加强针”,国药集团关于德尔塔变异株的研究有了新进展,7 月 27 日,发表在 Cell Discov 的 Screening of potent neutralizing antibodies against SARS-CoV-2 using convalescent patients-derived phage-display libraries 一文表明,从 COVID-19 恢复期患者体内分离出了十种 nAb。如图 6a 所示,其中抗体 2B11 对 WT SARS-CoV-2 和 B.1.1.7 变体有很高的靶向性,IC50 值均在纳摩尔级别。
2B11-RBD 复合物的晶体结构表明 2B11 的表位与 ACE2 结合位点高度重叠(图 6b)。同时,在AdV5-hACE2 转导小鼠模型中,与对照组相比,2B11 使用能显著降低病毒感染引起的肺部损伤。
a. 2B11抑制WT SARS-CoV-2 和 B.1.1.7 变体的 IC 50 值. b. 2B11-RBD晶体结构分析. c. 肺部组织免疫组化
| 抗体抑制剂 |
| Anti-Spike-RBD mAb 能够阻断 Spike 蛋白与 ACE2 的相互作用,具有抗 SARS-CoV-2 活性。 |
| Anti-SARS-CoV-2 Spike mAb (CR3022) 人源的单克隆抗体 IgG1,可以和 SARS-CoV/SARS-CoV-2 Spike 蛋白 (S1) 结合。 |
| 其他抑制剂 |
| Remdesivir 对 SARS-CoV 和 MERS-CoV 的 EC50 值为 74 nM,可用于 2019-nCoV (COVID-19) 研究。 |
| Chloroquine 有效抑制 SARS-CoV-2 (COVID-19) 感染 (EC50=1.13 μM)。也可用于疟疾的研究。 |
| Camostat mesylate TMPRSS2 的抑制剂,具有抗 SARS-CoV-2 活性。也是一种丝氨酸蛋白酶 (serine protease) 抑制剂。 |
| 重组蛋白 |
| S1 Protein (HEK293-expressed) HEK293 细胞表达的重组人源 S1 蛋白。 |
| S Protein RBD Protein, His (HEK293-expressed) 在 HEK293 细胞中产生的带 His 标签的重组 2019-nCov 的 S 蛋白受体结合区域 (RBD)。 |
| 3C-like Proteinase, His 大肠杆菌中表达,N 端带有一个 His 标签的 3C-like Proteinase 蛋白。 |
MCE 的所有产品仅用作科学研究或药证申报,我们不为任何个人用途提供产品和服务
参考文献
1. Peng Zhou, Xing-Lou Yang, Xian-Guang Wang, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature. 2020 Mar;579(7798):270-273.
2. Andrew G Harrison,Tao Lin, Penghua Wang, et al. Mechanisms of SARS-CoV-2 Transmission and Pathogenesis. Trends Immunol. 2020 Dec;41(12):1100-1115.
3. Hongxing Pan, et al. Immunogenicity and safety of a third dose, and immune persistence of CoronaVac vaccine in healthy adults aged 18-59 years: interim results from a double-blind, randomized, placebo-controlled phase 2 clinical trial. medRxiv and bioRxiv
4. Shilong Yang, Yan Li, Lianpan Dai, et al. Safety and immunogenicity of a recombinant tandem-repeat dimeric RBD-based protein subunit vaccine (ZF2001) against COVID-19 in adults: two randomised, double-blind, placebo-controlled, phase 1 and 2 trials. Lancet Infect Dis. 2021 Aug;21(8):1107-1119.
5. Yongbing Pan, Jianhui Du, Jia Liu, Hai Wu, et al, Screening of potent neutralizing antibodies against SARS-CoV-2 using convalescent patients-derived phage-display libraries. Cell Discov. 2021 Jul 27;7(1):57