易基因|ChIP-seq等实验揭示CHD6转录激活前列腺癌通路的关键功能 | 肿瘤耐药研究
易基因|ChIP-seq等实验揭示CHD6转录激活前列腺癌通路的关键功能 | 肿瘤耐药研究
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
2022年11月21日,北京大学基础医学院赵东宇研究员、美国休斯敦卫理公会研究所Min Zhang为并列第一作者,美国西北大学医学院曹圻博士和哈佛大学医学院陈开富博士、张丽丽博士为共同通讯作者在《Nucleic Acids Research》杂志发表了题为“CHD6 promotes broad nucleosome eviction for transcriptional activation in prostate cancer cells”的研究论文,该研究通过对CHD6的ChIP-seq、MNase-seq和RNA-seq等实验揭示了CHD6与染色质结合,从启动子和基因体中清除核小体(nucleosome)以转录激活前列腺癌通路。
标题:CHD6 promotes broad nucleosome eviction for transcriptional activation in prostate cancer cells
时间:2022.11.21
期刊:Nucleic Acids Research
影响因子:IF 19.16
技术平台:ChIP-seq、MNase-seq、RNA-seq
样本实验:人前列腺癌细胞系培养,质粒、转染、慢病毒和逆转录病毒的产生和感染,RT-qPCR和western blot,细胞功能检测,小鼠肿瘤异种移植,鸡绒毛膜尿囊膜(CAM)检测,高斯荧光素酶(GLuc)报告基因检测,ChIP-seq,MNase-seq,RNA-seq,统计分析
研究摘要:
CHD6是染色质域解旋酶DNA结合蛋白家族的一员,但人们对CHD6在染色质重塑和癌症疾病中的确切作用还知之甚少。本研究表明CHD6结合染色质进行核小体广泛“驱逐(eviction)“以促进多种癌症通路的转录激活。作者纳入多个患者队列对1000多个前列腺癌数据集进行生物信息学分析,发现CHD6在前列腺癌中的表达上调,并与不良预后相关。进一步综合实验表明,CHD6在小鼠异种移植模型中调控前列腺癌细胞的致癌性和肿瘤进展。对CHD6进行ChIP-seq、MNase-seq和RNA-seq分析,结果表明CHD6结合染色质,将核小体从启动子和基因体中”驱逐“,以转录激活致癌通路。本研究结果证明了CHD6在转录激活前列腺癌通路中的关键作用。
结果图形
(1)CHD6在前列腺癌中表达上调并与不良预后相关
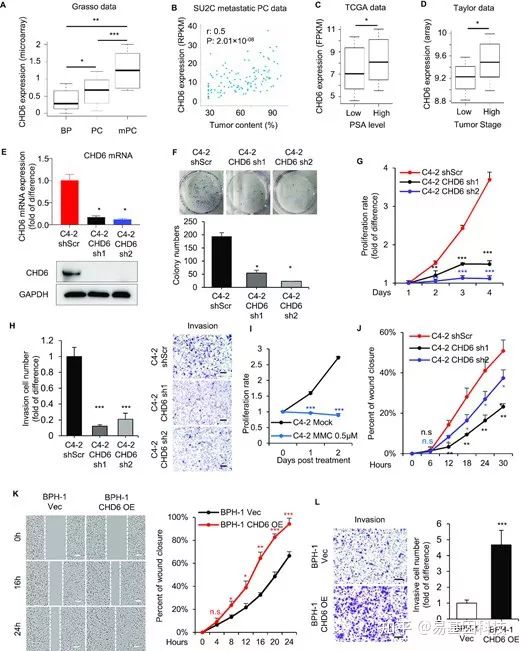
图1:CHD6表达上调导致前列腺癌发生。
- GEO公共数据库中,良性前列腺组织(BP,n=28)、局限性前列腺癌(PC,n=59)和转移性前列腺癌(mPC,n=35)中的CHD6 RNA表达水平。
- SU2C转移性前列腺癌患者中CHD6 RNA表达与肿瘤含量之间的关系散点图,显示了Spearman相关系数(r)和P值。
- TCGA数据中PSA水平高和低的前列腺癌患者的CHD6 RNA表达水平。(n低=181,n高=46)。
- Taylor数据中高和低肿瘤分期的前列腺癌患者的CHD6 RNA表达水平。(n低=86,n高=55)。
- 个体条件下,RT-qPCR检测的C4-2细胞中CHD6 mRNA表达水平(上)和Western blot检测的蛋白质在C4-2细胞中的表达水平(下)。
- 个体条件下,C4-2细胞集落形成。
- 个体条件下,C4-2细胞增殖。
- 个体条件下的C4-2细胞Transwell侵袭实验。
- 经0.5μM丝裂霉素c(MMC)处理的C4-2细胞增殖。
- 经0.5μM丝裂霉素c(MMC)处理的C4-2细胞伤口愈合实验。
- 个体条件下BPH-1细胞的伤口愈合实验。
- 个体条件下BPH-1细胞Transwell侵袭实验。
OE:过表达;Vec:对照组;sh,shRNA;shScr,scramble control for shRNA。
(2)CHD6是体内前列腺癌生长和侵袭所必需的
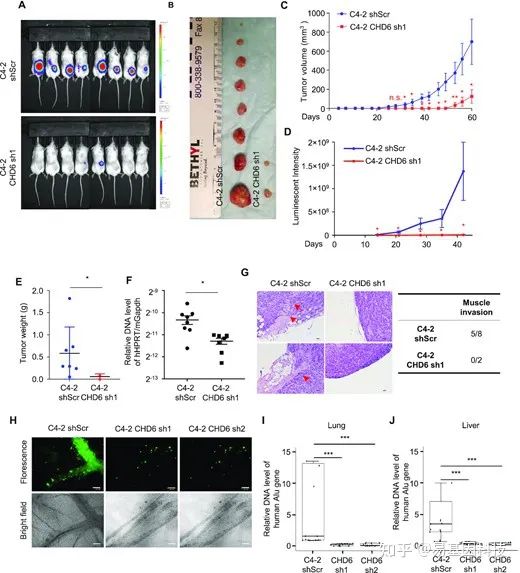
图2:在小鼠异种移植模型中CHD6敲除阻碍前列腺癌细胞的肿瘤生长和转移。
A-B. C4-2对照和CHD6敲除细胞形成的肿瘤。
C-E. C4-2对照和CHD6敲除细胞的肿瘤体积(C)、发光强度(D)和重量(E)。
F. 通过qPCR检测C4-2对照和CHD6敲除细胞的小鼠肺中HPRT基因位点的人基因组DNA含量。
G. C4-2细胞的肿瘤苏木精和伊红染色。红色箭头表示肌肉侵袭区域。
H. Lower鸡胚绒毛尿囊膜(CAM)中C4-2-GFP对照和CHD6敲除细胞的代表性图像。绿色荧光点:GFP标记的C4-2细胞,黑色:血管。
I-J. qPCR定量检测CAM肿瘤模型的鸡肺(I)和肝脏(J)中Alu基因位点的人基因组DNA含量。
Sh表示shRNA;shScr,表示scramble control for shRNA;P值由双尾学生t检验确定。小鼠实验(A-C),N=8。对照胚胎N=5、sh2胚胎N=5、sh1胚胎N=6(H-J),每个胚胎三个技术重复。*:P<0.05;**:P<0.01;***:P<0.001,n.s., 无显著意义。比例尺:100μm。
(3)CHD6激活的基因表达与前列腺癌患者预后不良相关
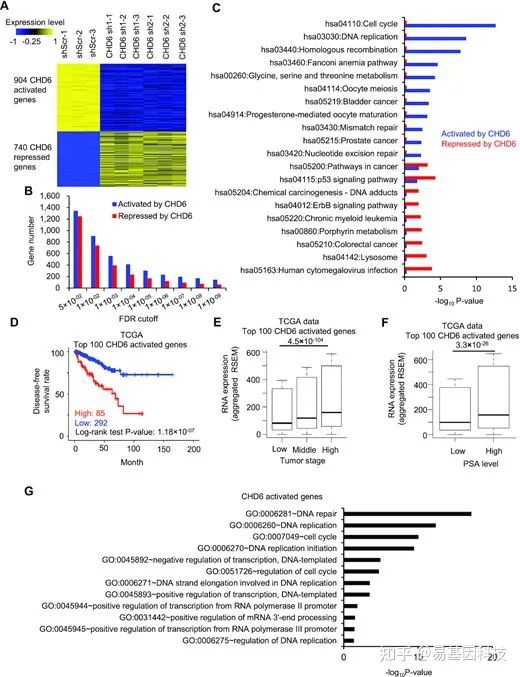
图3:CHD6激活的基因表达与前列腺癌患者预后不良相关
- C4-2细胞CHD6敲除后下调或上调的基因表达水平热图。
- C4-2细胞中FDR决定cutoffs时,CHD6激活或抑制的基因数量。
- C4-2细胞中CHD6激活或抑制基因的KEGG通路分析。
- TCGA数据中CHD6激活标记基因高或低RNA表达的前列腺癌患者无病生存率的Kaplan-Meier图。
- TCGA数据中不同肿瘤阶段CHD6激活标记基因的RNA表达水平。(n低=186,n中=293,n高=10)。
- TCGA数据中PSA水平低和高的患者CHD6激活标记基因的RNA表达水平。(n低=181,n高=46)。
- CHD6激活基因的GO分析。
单尾Wilcoxon检验(E,F)确定P值。结果基于三个独立的生物学重复整合得出。
(4)癌基因E2F1在前列腺癌中受CHD6转录调控
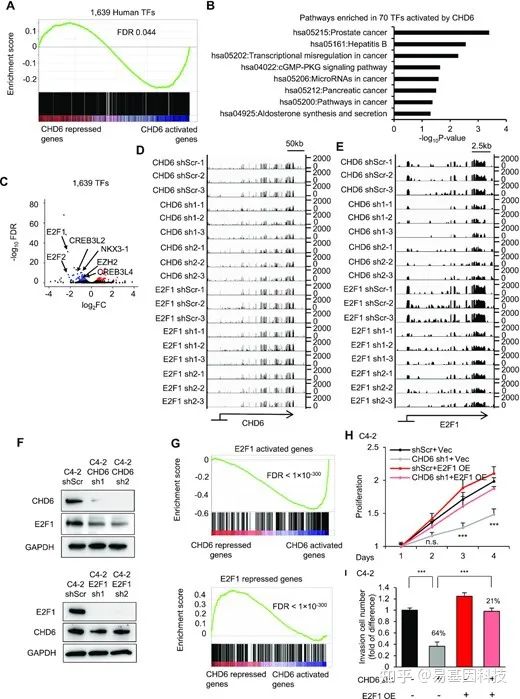
图4:许多致癌转录因子是CHD6的下游标靶。
- GSEA分析显示C4-2细胞中CHD6调控基因的1639个转录因子富集。
- C4-2细胞中CHD6激活的70个转录因子KEGG通路分析。
- C4-2细胞中CHD6敲除后转录因子的表达变化火山图。
- 基因组浏览器轨迹分析显示单个样本中CHD6位点的RNA-seq数据
- 基因组浏览器轨迹分析显示单个样本中E2F1位点的RNA-seq数据。
- 个体条件下C4-2细胞中CHD6和E2F1的蛋白水平。
- GSEA分析显示C4-2细胞中CHD6调控基因中E2F1激活和抑制基因富集。
- 个体条件下的C4-2细胞增殖。
- 个体条件下C4-2细胞的Transwell侵袭实验。
(5)CHD6在染色质上的结合与癌症通路的转录激活有关
图5:CHD6蛋白在染色质上的结合与C4-2细胞中靶基因的转录激活有关。
- C4-2细胞中CHD6的 ChIP-seq 显示基因组的基因体和附近区域的read分布。
- 基因组浏览器轨迹显示C4-2细胞中示例基因的CHD6 ChIP-seq read分布。
- ChIP-qPCR验证C4-2对照和CHD6敲除细胞中的CHD6 ChIP-Seq富集位点。
- GSEA分析显示CHD6激活或抑制基因的富集与基因体上CHD6 ChIP-seq read分布的关系。
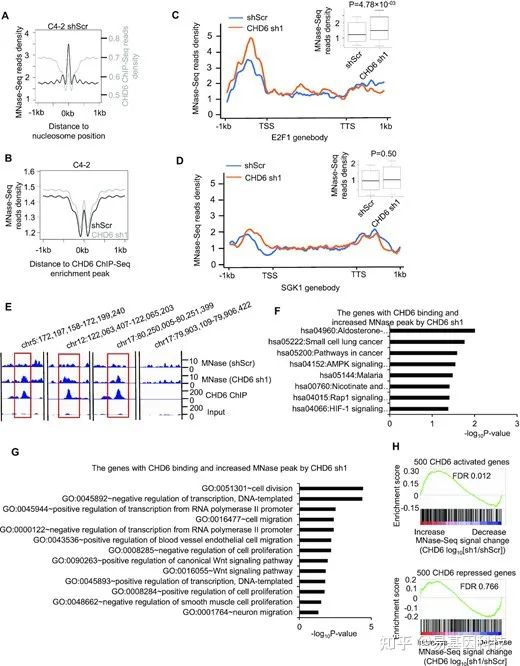
(6)CHD6在染色质上的结合是清除核小体激活转录所必需的
图6:CHD6蛋白在染色质上的结合与C4-2细胞中活性基因的核小体驱逐有关。
- C4-2对照细胞中MNase-seq富集peaks周围绘制的MNase-seq和CHD6 ChIP-seq平均 read分布。
- C4-2对照细胞和CHD6敲除细胞在对照细胞中定义的CHD6 ChIP-seq富集peaks周围的平均MNase-seq read分布。
- C4-2对照细胞和CHD6敲除细胞中E2F1基因体周围绘制的MNase-seq read分布。
- C4-2对照细胞和CHD6敲除细胞中SGK1基因体周围绘制的MNase-seq read分布,右上角的方框图进一步显示MNase -seq Read分布差异
- 基因组浏览器轨迹显示基因组区域中的MNase-seq、CHD6 ChIP-seq和input read分布。
- CHD6敲除后CHD6结合和MNase peak增加的KEGG通路分析
- CHD6敲除后CHD6结合和MNase peak增加的GO通路分析
- GSEA分析显示在MNase-seq信号增加或减少中CHD6激活基因(上)或CHD6抑制基因(下)的富集情况。MNase -seq设置3个生物学重复。
结论:
本研究利用染色质免疫共沉淀测序 (ChIP-seq) 和转录组测序(RNA-seq)、MNase-seq等技术,证明了CHD6基因表达在前列腺癌样品中上调,且是前列腺癌细胞快速生长和进展所必需的。前列腺癌细胞中CHD6表达升高的机制尚待确定。雄激素受体(androgen receptor,AR)在前列腺癌中起关键作用,CHD6的表达水平与前列腺癌样品中的AR表达呈正相关,且CHD6敲除不能影响AR的表达水平(数据未显示),这表明AR可能上调前列腺癌中的CHD6。这些结果可能是前列腺癌中CHD6活性增加的原因。此外研究还发现,与对照组织相比,原发性前列腺癌中CHD3、CHD4和CHD9的基因表达水平显著降低。尽管这三个CHD家族成员在其他癌症类型中具有多种作用,但未来进一步研究它们在前列腺癌中的下调及潜在机制是很有意义的。新出现的证据表明,染色质重塑因子的功能失调导致了耐药性。去势抵抗性前列腺癌(CRPC)中CHD1缺失导致染色质结构失调,导致转录因子表达上调,从而导致抗雄激素耐药性。与CHD1相反,本研究初步数据显示CHD6在CRPC中进一步上调,表明CHD6在CRPC的发展和对抗雄激素治疗的耐药性出现中具有明显作用。
关于易基因染色质免疫共沉淀测序 (ChIP-seq) 技术
染色质免疫共沉淀(Chromatin Immunoprecipitation,ChIP),是研究体内蛋白质与DNA相互作用的经典方法。将ChIP与高通量测序技术相结合的ChIP-Seq技术,可在全基因组范围对特定蛋白的DNA结合位点进行高效而准确的筛选与鉴定,为研究的深入开展打下基础。
DNA与蛋白质的相互作用与基因的转录、染色质的空间构型和构象密切相关。运用组蛋白特定修饰的特异性抗体或DNA结合蛋白或转录因子特异性抗体富集与其结合的DNA片段,并进行纯化和文库构建,然后进行高通量测序,通过将获得的数据与参考基因组精确比对,研究人员可获得全基因组范围内某种修饰类型的特定组蛋白或转录因子与基因组DNA序列之间的关系,也可对多个样品进行差异比较。
应用方向:
ChIP 用来在空间上和时间上不同蛋白沿基因或基因组定位
- 转录因子和辅因子结合作用
- 复制因子和 DNA 修复蛋白
- 组蛋白修饰和变异组蛋白
技术优势:
- 物种范围广:细胞、动物组织、植物组织、细菌微生物多物种富集经验;
- 微量建库:只需5ng以上免疫沉淀后的DNA,即可展开测序分析;
- 方案灵活:根据不同的项目需求,选择不同的组蛋白修饰特异性抗体。
易基因科技提供全面的表观遗传学研究整体解决方案,技术详情了解请致电易基因0755-28317900。
参考文献:
Zhao D, Zhang M, Huang S, Liu Q, Zhu S, Li Y, Jiang W, Kiss DL, Cao Q, Zhang L, Chen K. CHD6 promotes broad nucleosome eviction for transcriptional activation in prostate cancer cells. Nucleic Acids Res. 2022 Nov 21. pii: 6835365.
相关阅读:
表观发育:ChIP-seq揭示精子H3K4me3可传递到胚胎并与代谢功能障碍遗传有关
植物育种:ChIP-seq(组蛋白)揭示H3K36me修饰影响温度诱导的植物可变剪接和开花
ChIP-seq分析方法:实用的工作流程和高级应用
项目文章 | ChIP-seq揭示HIV-1感染细胞转录抑制因子Schlafen 5的表观遗传调控机制
专注表观组学十余年-深圳市易基因科技有限公司