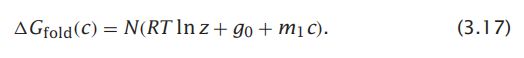《Protein Actions Principles and Modeling》-《蛋白质作用原理和建模》中文分享(11)
《Protein Actions Principles and Modeling》-《蛋白质作用原理和建模》
本人能力有限,如果错误欢迎批评指正。
第三章:Proteins Have Stable Equilibrium Conformations
(蛋白质具有稳定的平衡构想)
在蛋白质进行双态转变中,,我们会发现在变性中点,一半的蛋白质处于完全展开的状态,另一半的蛋白质则处于完全折叠的状态。小蛋白质们通常具有两种稳定的构象并且没有部分折叠这个动态中间体。如果蛋白进行双态转变,那么这个过程也可以被称为协同。
我们可以从量热学(图3.3)来了解协同翻译。这里有两个方法,第一个是量热实验能给出了一个量热焓ΔHcal。这种直接的测量方法不需要模型性的解释。第二种,从量热实验中获得两个值:熔化中点温度Tm以及热容顶点ΔCp,max。将Tm和ΔCp,max与双态转变模型假设结合,就可以获得范霍夫焓( van't Hoff enthalpy):ΔHvH = 2TmΔCp,max。如果这两个焓值相等,那么可以说明蛋白质转变过程为双态转变,不涉及中间体。这些数据提供了一种典型的小单域球状蛋白经历双态折叠跃迁的证据。另一个双态转变的证据是,两个不同的实验测试指标如:蛋白质的圆二相色测试值和色氨酸集团的掩埋的紫外光谱,的变性曲线相互叠加。如果这些区间没有叠加,说明存在中间态的部分折叠蛋白。
关于小蛋白质可逆折叠和展开的热稳定性有广泛的实验指标:自由能ΔGfold = GD=GN,焓ΔH,熵ΔS,以及热容ΔCp。这些热力学性质只依赖于蛋白质链上的氨基酸数量。直到目前为止,广泛的研究发现没有什么能够很大地影响这些折叠稳定性的热力学性质。事实上,蛋白的稳定性不依赖于二级结构的数量或三级结构的类型,疏水性氨基酸或氢键的数量,或盐桥离子对的数量。提到这个的原因是因为蛋白质的其他重要性质--如它们的天然结构和生化机制--可能在很大程度上依赖于这些细节。这种简单性使我们能够很好地捕捉观察到的折叠稳定性对温度,变性剂,pH值,盐的依赖关系,以及在狭小空间内蛋白质封闭的影响。在下一节中,我们假设蛋白质具有双态协同(two-state cooperativity)。在第四章中,我们探讨了双态协同的物理基础。
我们从链熵开始。如图3.13所示,如果一个链上有N个氨基酸,那么其非天然构象的数量大概有Q=ZN,其中Z指的是每个氨基酸不同构象的数量。因此,我们可以用以下公式来计算非天然状态的链熵:
在二级晶格图中,z=3(图3.7)。在3D晶格图中,z=5。这些是当一个键可以从给定的晶格位置开始出发的晶格方向数量且不会朝向上个键的位置。接下来,我们是用转移模型(transfer model):在折叠过程中,一个氨基酸从溶于水到迁移至蛋白质核心被掩埋。那么,这样的折叠自由能可以计算为:
其中,g<0为从水中转移一个氨基酸到疏水核心环境的自由能。方程式3.15中体现的要点是(i)整个蛋白质的全部接触自由能和折叠熵应该与氨基酸残基的数量呈线性关系。(ii)在g的残基-残基吸引有助于稳定天然结构(iii)链熵会阻止蛋白质的结构的崩溃。
化学试剂,如胍,氢胆碱和尿素,倾向于使天然蛋白质变性。其他化学试剂,如甘油,糖,一些盐,TMAO和肌氨酸,往往具有相反的作用。变性剂通过创造氨基酸喜欢的环境来促进蛋白质的展开。而稳定剂则是创造一个对氨基酸不那么友好的环境来保证蛋白质的折叠结构。我们可以使用公式3.15来解释化学试剂是如何来影响蛋白质的结构稳定性的。
在转移模型中。加入变性剂或者稳定剂偶会影响影响到链上的每个氨基酸残基的相互作用:
当变性剂不存在的时候(c=0),蛋白质的一个氨基酸从其邻居解离自由能为g0。为什么自由能与变性剂浓度(m1c)会存在线性相关呢?是因为增加变性剂的数量会相应地增加每个非极性分子的第一层溶液层上的变性剂数量,并且相应地降低溶质和溶质之间的作用。因此,我们可以认为变性剂分子随机分布在每一个可用的溶液空间中,包括在非极性溶液周围的第一壳层中的站点(称为平均场近似)。将方程3.16代入方程3.15就可以计算折叠自由能对变性剂浓度的线性依赖关系。
公式3.17显示斜率为m=Nm1,又称为m-values。Gfold(c)与c是单体因为变性剂而增加的表面积乘以单位表面积的自由能的乘积。图3.14表明,实验观察到了m值与链长N线性增加。
图3.14 变性剂的m-values与链长线性相关。GuHCl(a)或urea(B)的变性表明,m-values在链长N上的线性依赖关系,如方程3.17所示。
当具有变性剂存在的情况下,m1>0,也就是说随着溶液的化学浓度增加,蛋白质的稳定性会下降。另一方面,那些可以稳定蛋白质结构的溶剂中,m1<0,随着浓度的增加,蛋白质的稳定性会上升。蛋白质的稳定性也会随着不同的物理原因变化。有些蛋白质的稳定性会随着亲水溶剂的极性而上升。有些蛋白质的稳定性会通过排除体积增加:这样的试剂可以以惰性的方式占据空间,限制变性蛋白可以采用的构象,从而稳定天然构象。例如,多糖链有时与生物技术上重要的蛋白质,如促红细胞生成素(EPO)共价连接,以提供稳定的溶液配方。
-------------------------------------------
来自公众号DrugPython分享
欢迎关注点赞收藏转发!
下次见!