TMB计算是否要去除驱动突变
TMB计算为什么要去除驱动突变
- 1、什么是TMB
- 2、TMB测序方法
-
- 2.1 panel大小、测序深度
- 2.2 影响TMB结果因素
- 2.3 TMB阈值分析
- 3、TMB计算规则
-
- 3.1 WES
- 3.2 Panel
- 4、为什么要去除驱动突变
-
- 4.1 “驱动突变”的定义
- 4.2 驱动突变来源
- 4.3 去除驱动突变原因
- 5、为什么要纳入同义突变
1、什么是TMB
在WES和Panel中的定义不同。
WES:
TMB是指肿瘤基因组内存在的体细胞突变位点数量,可以间接反映肿瘤产生新生抗原的能力。由于早期研究多基于WES检测,因此TMB通常是指单位基因组 外显子编码区域(外显子组,exome)的 突变 数量(mutations, muts),单位muts/exome。
Panel:
虽然WES是检测TMB的金标准,但WES时间成本和分析成本较高。经过多项大样本研究验证后,TMB检测从WES扩展到了更切合临床实际的靶向二代测序(next-generation sequencingpanel, NGS panel)。靶向测序的基因检测位点比外显子组少,由于不同平台检测方法和测序覆盖的外显子区域长度不同,TMB也被定义为肿瘤基因组区域中每兆碱基(megabase, Mb)发生的 碱基替换突变和插入缺失突变的数量 总和,单位为muts/Mb。
2、TMB测序方法
可精读《肿瘤突变负荷检测及临床应用中国专家共识(2020 年版)》一文,里面介绍的非常详细。
2.1 panel大小、测序深度
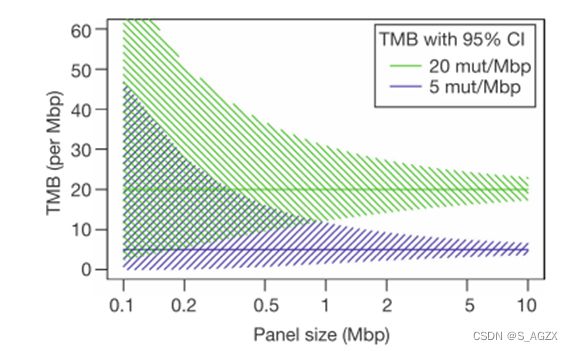
全外显子测序(WES)是 TMB 检测的「金标准」。但是 WES 价格昂贵,检测时间长,需要新鲜标本,因而应用受限。靶向测序 panel 已经成为 WES 的有效替代,为准确性考虑,其 覆盖范围应 ≥ 1.0 Mb,测序深度 ≥ 500X,来源于 肿瘤突变负荷检测及临床应用中国专家共识(2020 年版)。
检测的基因数越多,TMB的检测结果与WES的一致性越高,NGS大panel可能更适合评估TMB。对于TMB较高的样本,不同大小的NGS panel检测结果差异可能不显著;而对于TMB较低的样本,检测结果的不一致性显著增加。目前一般认为NGS panel ≥0.8 Mb可以较好地评估肿瘤组织TMB水平。
2.2 影响TMB结果因素
样本收集阶段、DNA处理阶段、测序阶段、生物信息分析阶段和报告生成阶段均会影响TMB检测的可靠性。
(1)样本收集阶段主要包括样本类型、肿瘤类型、肿瘤异质性和克隆进化等影响因素;
(2)DNA处理阶段包括DNA质量和数量、文库构建等影响因素;
(3)测序阶段包括DNA捕获区域、测序深度、覆盖读长、测序平台等影响因素;
(4)生物信息分析阶段包括突变类型、胚系突变过滤、等位基因突变频率等影响因素;
(5)报告生成阶段包括瘤种分类、患者人群、患者数量、TMB排序标准等影响因素。
(6)除了考虑技术因素,流程监管、样本收集和处理质控以及样本运送时长等因素可能也会影响样本质量,从而影响检测结果。
&emsp
对于组织样本,肿瘤纯度要求 ≥ 20%,需要有正常对照为检测提供胚系变异信息。
2.3 TMB阈值分析
TMB的 中位值和分布范围 在 不同癌种中有所 不同。因此,在各个癌种中分别确定界值十分重要。应使用相同的筛选策略,选择排序在 20% 以上的病例定义为 TMB-H,而 前瞻性的临床疗效才是确定 TMB 界值的最佳标准。
目前看,不同靶向测序 panel 的 TMB 不能通用,所以在使用 TMB 时,应结合瘤种、人口特征、基因特征和检测方法综合解读。
参考资料:
(1) 肿瘤突变负荷检测及临床应用中国专家共识(2020 年版)
(2)产品设计时TMB计算饱和度验证
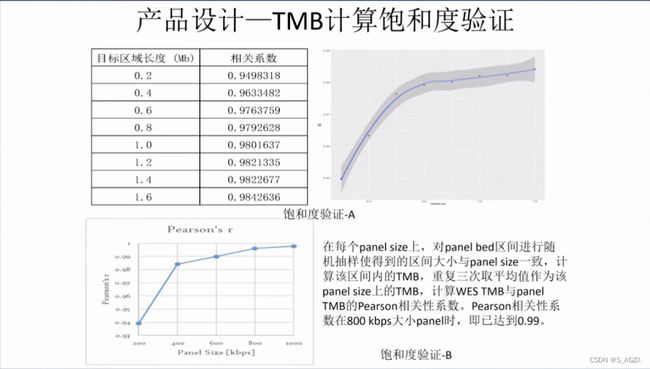
(3) 中检院历史宣讲PPT材料
3、TMB计算规则
3.1 WES
TMB被定义为通过WES测序肿瘤组织样本中体细胞 非同义突变数量 的总和。
3.2 Panel
在NGS panel检测TMB的研究中,纳入TMB计算的是体细胞 编码区 中单碱基突变 和 短插入和缺失突变,部分NGS panel计算TMB也同时纳入了 同义突变,而胚系变异、核苷酸多态性位点、明确的抑癌基因及驱动基因热点突变则 不计算 在内.
计算方式为,TMB值 = 符合自己产品TMB定义的体细胞突变位点总数 / panel芯片大小。换句话说,只有知道其他公司芯片的大小,才能倒推出使用了多少突变位点计算TMB,对方纳入TMB计算的突变位点频率阈值,是否纳入同义突变,是否过滤了驱动突变等均可获悉。
4、为什么要去除驱动突变
4.1 “驱动突变”的定义
与肿瘤治疗、诊断、预后密切相关的突变,包括热点突变、药物靶点突变、癌基因功能激活突变和抑癌基因功能失活突变
4.2 驱动突变来源
(1)热点突变(功能性突变):常见的有三个人群数据库:EXAC、千人基因组、COSMIC、dnSNP
(2)药物靶点突变:各公司遗传咨询同事搜集的,各种指南推荐靶向药物针对的突变位点、或者定义的一二类突变。
(3)原癌基因功能激活突变:如ras基因家族的部分突变;
(4)抑癌基因功能失活突变:如TP53基因的部分突变,部分截断(truncation)突变;
4.3 去除驱动突变原因
这里解释的不是太好,网上的资料也不齐全,有了解的欢迎留言交流。
(1)驱动基因提供的是靶向药物预测
驱动基因和TMB可以同时检测,但驱动基因的突变、重排等结果提供的是TMB以外的临床应用(靶向药物预测),不参与到TMB的计算之中。
对于驱动基因突变型患者,驱动基因用来预测靶向药物是有效的。此时再讨论TMB,原因在于其对野生型驱动基因的患者免疫治疗具有指导意义。
例如NSCLC可以分为驱动基因阳性和野生型两类。驱动基因阳性的患者,携带如EGFR突变、ALK融合,这类患者的TMB通常较低,因为这类癌症中已存在一个优势基因,所以整体的TMB较低。而TMB高的患者,其驱动基因多为阴性。
(2)panel芯片富集
panel设计的本意就是富集芯片范围内的功能性突变,无法精确反应WES层面的TMB结果,所以需要去掉驱动基因进行稀释。
(3)FDA批准的TMB检测panel都去了驱动突变
Foundation One CDx、Omics Core、FoundationOne Liquid CDx(F1LCDx)、PGDx Elio Tissue Complete这几个获批的大panel产品在计算TMB的时候均去除了驱动突变。
补充:
21年NCCL组织了TMB的室间质评考核,从22年初下发的结果看,大家的水平差异很大,可以说参差不齐。尤其是各家的驱动突变去除方法千差万别,这块也是需要后续关注的。
全国肿瘤突变负荷检测生物信息学分析室间质量评价预研通知
从NCCL室间质评看国内免疫治疗TMB检测难点及现状
5、为什么要纳入同义突变
参考资料中2020年的共识认为TMB不能加入同义突变,但2021年的肺癌共识认为可以纳入同义突变。
共识,意思就是现在谁也不知道,大家一起先这么干而已。其结论是会变的,也不保证正确,会随新证据不断变化。
部分主张要纳入同义突变的参考文献,给出了如下的理由:
(1)可以减少样本本身的噪音;
(2)虽然同义突变不太会直接参与产生免疫抗原,但它们的存在依然是突变存在的信号,可能会导致其他地方发生非同义突变,或新抗原;
(3)已经批准的F1组织的判断诊断试剂盒,纳入了5%以上同义+非同义突变;
(4)加上同义突变后,panel与WES结果的相关性会更高;
参考资料:
(1) 肿瘤突变负荷检测及临床应用中国专家共识(2020 年版)
(2)肿瘤突变负荷应用于肺癌免疫治疗的专家共识
(3)肿瘤突变负荷TMB检测常见问题答疑
(4)肿瘤NGS大panel|肿瘤大panel检测的标准化及研究进展