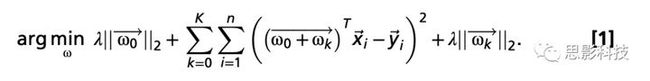PNAS:网络连接的中断预示着中风后多种行为障碍
中风后的行为障碍通常归因于局灶性损伤,但最近的证据表明,分布式脑网络破坏起着关键作用。来自华盛顿医学院研究人员在PNAS发文,他们招募了132名中风患者,测量静息态功能连接、病灶分布和多类行为表现(注意、视觉记忆、形象记忆、语言、运动和视觉),并使用机器学习模型来预测单个受试者的神经损伤。结果发现,FC能更好地预测视觉记忆和形象记忆,而病灶图能更好地预测视觉和运动损伤。两者都能很好地预测注意力和语言缺陷。接下来,研究者确定了生理网络功能障碍的一般模式,包括半球间整合和半球内连接的减少,这与多个领域的行为损伤密切相关。网络特异性的功能障碍模式预测了特定的行为障碍,而跨网络模块的大脑半球间沟通的丧失与跨多个行为领域的损伤相关。这些结果将大脑网络的关键组织特征与中风的大脑行为关系联系起来,阐明了脑结构与脑功能的补充价值,并为中风后多个行为领域障碍提供了生理机制。本文发表在PNAS杂志
关键词:stroke | functional connectivity | interhemispheric | memory | language
虽然中风造成的结构损伤是局灶性的,但功能障碍可发生在远离损伤区域的大脑区域。直接损伤或间接影响的区域嵌入在一个更大的功能网络中,该网络与大脑中的其他网络处于动态平衡状态。该框架假设,在大脑中单个位置的病灶有能力破坏远远超出病灶边界的大脑功能。许多远程生理功能障碍(remote physiological dysfunction)的相关因素已经被提出,包括对侧脑区域的异常任务征用,代谢或区域脑血流的中断等。然而,对于远程生理功能障碍与病灶区域关系的了解还有限。此外,所报道的生理变化的行为相关性尚不清楚。虽然一些研究报告了与行为损伤显著相关,但解释的行为方差总量尚不清楚。最后,由于远程功能障碍的机制通常在相对较小的个体群体中被研究,它们在人群水平上的泛化是未知的。因此,大脑功能的生理测量方法并没有被用于中风患者的评估和治疗。更传统的病灶-症状定位研究也使用统计学方法将病灶区域与不同行为缺陷的严重程度联系起来。这些研究的一个隐含假设是,不管测量的行为是什么,结构损伤和行为之间的关联强度是相同的。然而,也有可能更多的整合功能(注意、记忆和执行)比感觉和运动功能更依赖于分布式处理。令人惊讶的是,损伤在多大程度上解释了不同缺陷是未知的。因此,损伤行为预测也没有进入临床神经科学的主流。在本研究中,作者假设中风引起的结构损伤产生了强大的、网络一致性的生理变化,从而解释了组水平上的行为差异。根据已知的大脑功能组织来解释这些生理变化的影响。具有类似功能的区域被划分为网络,即一组高度连接的区域(例如,运动皮层和运动行为的补充运动区域)。这些网络的功能障碍是相应行为领域缺陷的基础。使用一个类似的框架来理解功能连接在行为中的权重。研究者招募了大量的亚急性中风患者(n=132)以证明上述假设。神经系统障碍的描述使用行为测量。分别采用结构磁共振成像(MRI)和静息功能磁共振成像(R-FMRI)测量脑网络的病灶分布和功能连通性。然后将结构和功能数据输入一个岭回归机器学习算法,以预测单个受试者水平在六个行为领域的表现障碍:注意、视觉记忆、形象记忆、语言、运动和视觉。分别使用病灶损伤模型(lesion-deficit model)或FC损伤模型(FC-deficit model)来预测损伤(简单来说就是分别用病灶的nii图像和功能连接矩阵来进行预测),这使我们能够比较病灶分布和网络功能障碍在解释不同行为缺陷方面的相对重要性。最后,FC-deficit model不仅被用于识别最能预测每个行为领域缺陷的特定大脑连接,而且还被用于识别预测跨行为领域障碍的连接。
【方法】
被试信息
首先,研究协调员通过巴恩斯犹太医院(Barnes-Jewish Hospital)和圣路易斯康复研究所(Rehabilitation Institute of St. Louis)的患者服务招募了定时中风患者。入选标准为:(1)年龄18岁或以上,(2)首次出现中风症状、缺血性或实质内出血性病因,(3)存在运动、语言、注意力、视觉或记忆缺陷、(4)入组时间小于卒中发病后2周。排除标准:(i)在测试期间无法保持清醒,(ii)存在其他神经、精神或医疗状况,妨碍积极参与研究和/或可能改变行为/成像研究的解释(例如,痴呆、精神分裂症),或将预期寿命限制在1年以下(例如,肿瘤或充血性心力衰竭IV级),(iii)有临床显著的脑室周围白质疾病的证据,以及(IV) MRI禁忌症,包括幽闭恐怖症或与扫描仪不兼容的植入物。总共筛查了6260张图表,132例患者符合所有纳入标准并完成整个亚急性治疗方案(平均年龄52.8岁,范围22-77岁;119名右撇子,63名女性,64名右脑)。招募人口统计学上匹配的对照组(n = 31),并进行同样的行为和影像学检查。对照组的纳入标准为:按年龄、性别、利手和教育水平与卒中研究人群匹配的健康成人。排除标准为:(i)在参与研究活动前有神经、精神或医学异常阳性史,(ii)动脉硬化(冠状动脉、大脑、外周)动脉疾病史,或(iii)神经异常逻辑检查伴中枢神经系统功能障碍迹象。共有31名对照组完成了整个亚急性治疗方案[平均年龄55.7岁(SD = 11.5),范围21-83岁]。
神经心理评估
在每次扫描之后,所有参与者都接受行为测试,包括对运动、语言、注意力、记忆和视觉功能的评估(表S1)。成像和行为测试通常在同一天进行。分数只记录了被试能够完成的任务。因此,不同的领域有不同数量的题目。首先,任务被分为注意力、记忆、语言、运动和视觉。对每个类别都进行了主成分分析(PCA)。值得注意的是,第一个成分描述了26.1%的方差,并与视野偏差的测量(Posner任务:左右准确性差异(r=0.83);Mesulam:center of cancellation:(r=0.75))和一般性能(准确性,r=−0.41)密切相关。在记忆中,前两个成分占所有与记忆相关的测量方法的方差的66.2%。第一个部分与视觉信息延迟回忆的测量高度相关[短暂视觉空间记忆测试(BVMT)延迟回忆:r=0.81],第二部分与语言信息回忆相关[霍普金斯语言学习测试(HVLT)延迟回忆:r=0.93]。在语言中,第一个成分占方差的77.3%,与理解和生产高度相关。在运动中,前两个成分描述了左右身体缺陷,并分别解释了43.0%和34.6%的方差。计算机化的视野测量检查(汉弗莱视野分析模型750i)测量了视野缺陷。每只眼睛都使用中心24-2阈值SITA-FAST方案进行测试。没有进行PCA,因为视力是通过单一的功能测试来评估的。相反,使用的两个视觉域得分是左右半球的平均模式偏差得分。所有包含的测试以及与领域得分的相关性如表S1所示。总共有8个领域被用于FC-deficit和lesion-defecit建模。每个领域的得分都是连续的,并归一化为患者的均值为0,标准差为1。当数值相比于健康对照小两个标准差时,认为功能存在缺陷,缺陷患者分布数如下:(i)注意力(31/88)、(ii)视觉记忆(27/88)、言语记忆(30/88)、(iv)语言(33/112)、(v)左运动(37/106),(vi)右运动(39/106)、(vii)左视觉(13/58)和(viii)右视觉(10/58)。表1行为量表得分
MRI和病灶分析
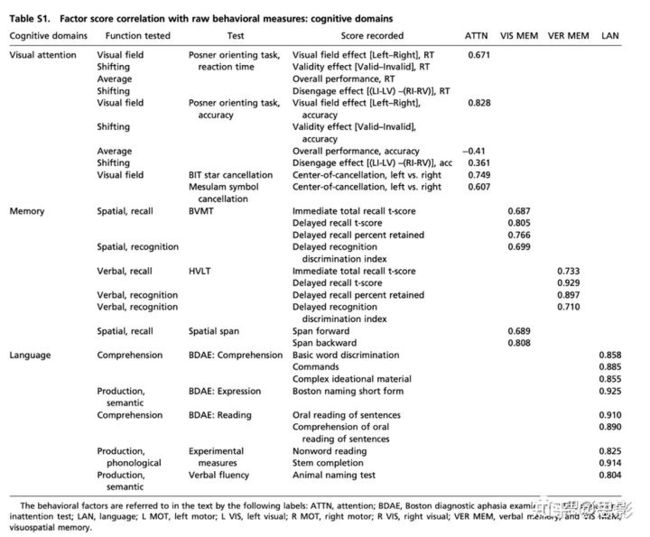
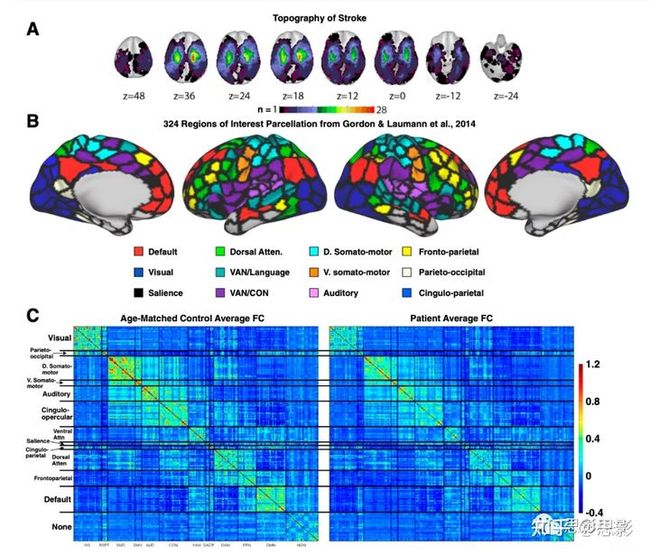
利用FSL里面的非线性配准工具将个体T1像配准到MNI空间。另外,借助Analyze biomedical imaging software system对病灶进行手动分割,用到的图像有T1加权、T2加权和FLAIR图像。特别注意区分病灶与脑脊液、出血与周围血管源性水肿,并确定脑室周围白质损伤的程度。病灶范围为0.02至82.97cm3,平均为10.15cm3(SD=13.94cm3)。将病灶相加,显示每个体素结构损伤患者数量。见图S1).
图S1病灶分布和FC连接矩阵可视化。(A)132名中风患者的病灶分布图,colorbar的含义为人数。(B)感兴趣网络划分,共324个脑区分为12个网络。(C)病人组和对照组的连接矩阵分布。静息态fRMI采集对患者卒中发病后2周(平均=13.4d,SD=4.8d)、3个月(平均=112.5d,SD=18.4d)和1年(平均=393.5d,SD=55.1d)三个时间段进行研究。对照组进行了两次研究,每次间隔3个月。所有成像均使用西门子3TTim-Trio扫描仪和标准12通道头线圈进行。MRI成像包括结构、功能、脉冲动脉自旋标记(PASL)和弥散张量扫描。结构扫描包括:(i)sagittal T1-weighted MP-RAGE(TR=1950m秒,TE=2.26毫秒,翻转角=90°,体素大小=1.0×=1.0×1.0×1.0mm);(ii)transverse T2-weighted turbo spin echo(TR=2500m秒,TE=435毫秒,体素大小=1.0×1.0×1.0×1.0mm);和(iii)矢状面FLAIR成像(TR=7500毫秒,TE=326m秒,体素大小=1.5×1.5×1.5mm)。PASL采集参数为:TR=2600msec,TE=13msec,翻转角=90°,带宽2.232kHz/Px和FoV220mm;采集120个volume(共322s),共15片,切片厚度分别为6-和23.7mm。静息状态功能扫描采用梯度回波EPI序列(TR=2000msec,TE=27msec,32个连续的4mm切片,4×4mm平面内分辨率),在此期间,参与者被要求在低亮度环境中注视一个小十字。获得了6到8次静息状态的功能磁共振成像运行,每次包括128个volume(共30个min)。
fMRI预处理
fMRI数据的预处理包括:(i)使用插值法对不同时间采集的层面进行校正;(ii)消除隔层扫描造成的奇数/偶数层强度差异;(iii)全脑强度归一化,实现模式值1000;(iv)使用场图评估来消除失真,并且对数据进行头动校正;(v)将功能像配准到标准空间并且重采样为3mm大小。不同模态的数据间进行配准如将T2配准到T1上。
功能连接计算
FC处理与之前研究类似,不过增加了由HCP开发的表面投射。首先,数据通过几个额外的预处理步骤:(i)基于Freesurfer分割计算回归变量;(ii)回归如下噪声协变量:(a)6列头动参数,(b)全脑平均信号,(c)脑室和脑脊液的信号,(d)来自白质的信号;(ii)在0.009–0.08-Hz范围内进行滤波;(iii)frame censoring。删除前4个时间点。删除少于120个时间点的数据(13例病人,3例对照组)。
表面处理
功能数据的表面生成和处理顺序类似于Glasser等人方法,并额外考虑了中风患者的皮质分割。首先,利用freesurfer自动分割每个被试的T1结构像,分割出灰质、白质等。其次,将每个个体的表面膨胀为球体,借助球形配准将表面由个体空间配准到fs_average空间。最后手动检查分割的准确性。对于中风患者组,分割前先将病灶区域用正常值填充,后面再把病灶区域做成Mask去掉。接着,分别将左右半球降采样到164000个顶点,再相互对齐。最终降采样到10242个顶点用以投射功能数据。借助Connectome Workbench的带约束采样,将功能数据投射到个体表面(wtite surface和pial surface之间),超过0.5个标准差的被当作异常值排除掉。接着对10242个顶点上的时间序列进行平滑,平滑核大小为6mm。最终对所有时间点求平均,用以计算不同分区的功能连接,计算完成后进行fisher-z变换。病灶区域不纳入功能连接计算范围。通过测量相反半球对应的顶点来计算每个区域的同位FC。从R-fMRI中测量到的具有严重血流动力学滞后(大于0.5s的半球间差异)的受试者被排除在所有进一步的FC分析之外。该标准排除了21名受试者,剩余100名中风患者和=27名对照。
感兴趣区域和网络模块设定
ROI基于Gordon等人制作的皮层分区(见图S1)。该分割是基于R-fMRI边界映射,实现了完整的皮层覆盖和最佳的区域均匀性。分割包括324个感兴趣的区域(159个左半球,165个右半球)。原始的分割包括333个区域,所有小于20个顶点(约50mm2)的区域都被排除在外。为了验证结构模块分化,从上述的12个网络模块中选择了9个进行后续分析。网络模块包括:visual、D.SM、V.SM、auditory、VAN/CON、VAN/CON、DAN、FPN、DMN(详见图S1)。
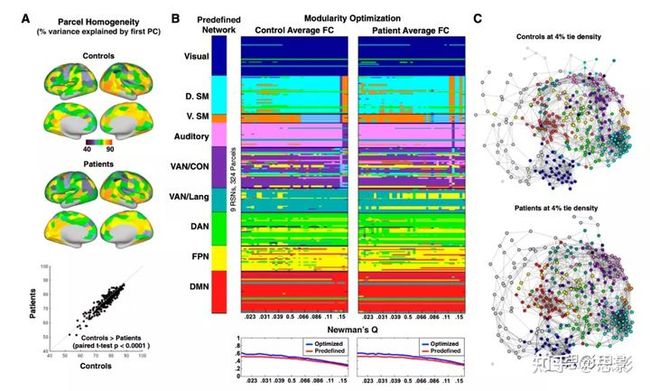
使用Gordon等人(25)的方法在对照组和中风患者中的计算个体分割不同parcel的同质性和社区(RSN)模块化。(A)每个parcel的组同质性,计算为parcel的第一个主成分分析特征变量所解释的功能连通性模式的方差百分比。患者和对照组之间的区域变异性高度一致。比较了对照组和患者之间在每一个parcel上的同质性。结果发现患者显示在parcel的同质性有小但一致的降低(配对t检验:t-stat = 8.0,P < 0.0001)。(B)最左边的一栏提供了基于Gordon等人的预定义网络分区。与后来基于RSN的分析一样,少于七个parcel的网络被排除在外。模块化的计算是用预定义的网络标签初始化的,并在对照组和患者中以一定范围的连接密度(0.02:0.15)运行。在模块化优化的每个可视化下面,是预定义的网络分配(红色)和优化的网络分配(蓝色)的Newman Q分数在每个平局密度下的图。最佳分配显示九个主要网络的模块化程度稍高。(C)4%连接密度下的模块化嵌入图形。区域根据预定义的网络分配进行颜色编码。
网络FC分析
使用双样本T检验比较上述静息态网络的组间差异(病人组100人,对照组27人),包括同位、同侧/对侧(对照组随机分配L/R)和网络间/网络内的FC差异。在全脑水平上比较了三种类型的网络内连接;同位、同侧和对侧,并进行FDR校正。对于9类静息态网络,评估了网络内部和网络之间的差异。在这里,计算了99次中风对照t检验(45次同侧,45次对侧,9次同位),通过10000次置换(中风与对照组)确定显著性临界值。最后,对8个RSN(之前使用的9个,减去DMN),评估同位连接和同位DMN连接之间的关系,并对8个统计检验进行FDR校正。
多变量岭回归
使用留一岭回归模型分析lesion-deficit和FC-deficit的关系(见图2)。选择使用线性多元岭回归函数来最小化偏差,但保留了将预测权重绘制回大脑解剖学的功能。在对病灶脑图和FC矩阵建模之前,进行PCA降维。这一步对每个模型独立进行,解释95%方差的成分被保留。对于病灶位置,对65,5493mm3脑体素的体素级病灶图进行PCA,对于功能连接,对52,326条连边进行PCA。每个模型保留的成分数量如下:(i)注意(50个损伤成分,74个FC成分),(ii)视觉记忆:(43,72),(iii)言语记忆(43,72),(iv)语言(56,90),(v)左运动(50,84),(vi)右运动(50,84),(vii)左视觉(28,49),(viii)右视觉(28,49)。所有岭回归模型都使用留一交叉验证(LOOCV)循环进行训练和测试。在每个循环中,正则化系数通过在λ=1和105之间识别一个参数进行优化,最小化训练集上的留一预测误差。接下来,使用梯度下降法求解整个训练集的最优权值,以最小化如图所示的岭回归方程的误差。对留一受试者的病灶/FC应用最佳模型权重,以预测受试者的行为评分。用这种方式对所有受试者进行了预测。使用实际测量得分和预测行为得分之间的皮尔逊相关系数的平方来评估模型的准确性。为了可视化特征权值,权重矩阵是所有n个单出循环的平均值,以生成一组共同权重值。因此,解决每个领域的所有行为得分会产生两个输出:(i)准确性—%方差解释(r2),(ii)共同权重图—一个向量(ω),其中包含每个体素/连接的相对预测权重。该模型中的权重(ω)被重新投射到大脑中,以显示最具预测性的功能连接,并使用Caret进行显示。将左右运动域和左右视觉域的两个模型相结合,以确定运动和视觉模型解释的方差百分比。这些组合模型后来被用于确定RSN对FC-defecit模型内和模型间的总贡献。Lesion-defecit和FC-defecit模型间的预测精度差异由双尾Wilcoxon符号秩检验基于平均预测误差进行评估。FC-defecit网络的贡献也基于先验分配的RSN网络进行量化。因此,对每个RSN内部和之间的所有连接的权重取平均值,为每个FC-defecit模型生成一个7×7的RSN权重矩阵。前1%的权重也按四种权重类型进行分类:半球间阳性、半球间阴性、半球内阳性和半球内阴性。在每个模型中计算属于四种类型的前1%的权重数。对所有7个模型进行了方差分析,以测试四种权重类型的贡献差异。此外进行事后检验,基于病灶位置来预测全局同位连接性。该病灶同位FC模型的建立方式与lesion-defecit预测模型相同。
多任务学习
为了区分预测多个领域均存在障碍的功能连接变化的特征,应用多任务学习。多任务学习(MTL)是一种通过联合学习来将FC-defecit预测模型结合起来的方法。在脑网络解码的设置中,可以合理地假设某些共同的特征决定域一般功能(简单来说就是某些连边会在不同行为领域共同发挥作用)。MTL方程通过将一组特定于领域的权重值与另一组跨所有领域保持不变的权重值相结合,同时优化每个领域的预测。L1正则化用于对每一个应用相等的代价函数,这样模型就不会偏向于使用共享或特定领域的权值。多任务优化方程如下:
在式中。1、x向量表示FC(在PCA空间中)。y向量包含了这些相同患者的行为得分。λ,一个正则化系数,是在λ值范围内使用留一方法确定的。向量ω是描述x中每个特征对y预测的相对重要性的权值向量。这里,n是被试的数量,K是在MTL问题中被组合的行为领域的数量。对域k中的主题i的预测是通过将一组具有特定域的权重ωk和表达式中的域一般权重ω0相结合而生成的。节点对324个roi的跨域权值ω0的贡献是通过取每个节点的所有连接的均方根权值来确定的。
【结果】
脑卒中患者FC模式异常
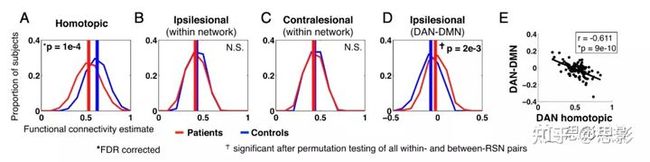
本研究招募了132名中风后1-2周的首次症状性卒中患者,以及31名人口统计学上匹配的对照组。研究人员通过广泛的神经心理,测量患者在6个行为领域(视觉、运动、语言、视觉记忆、言语记忆和注意力)的表现,通过多模态分割手动识别病灶,并获得30min的R-fMRI数据。21例患者因血流动力学滞后被排除,11例患者和4例对照组因过度头部运动(24)被排除。后续主要考察100名中风患者和27名年龄匹配的对照组。为了调查中风的一般影响,将病人组的FC特征与年龄匹配的对照组的FC特征进行了比较。网络内连接进一步分为半球间同位连接、同侧半球内连接和对侧半球内连接。图1显示了三种网络内连接(同位、同侧和对侧)FC值的分布,红色代表病人组、蓝色代表对照组。两组人同位FC的差异最显著(t=4.26,P=10−4,FDR校正)。网络内连接除了CON、VAN和DMN,同样存在显著的差异。对同位FC进行三因素(group vs. RSN vs. Head motion)的方差分析,发现组别(P=3×10−22)存在显著差异,静息状态网(RSN)(P=4×10−7)存在显著差异,被试头动(P=0.26)不存在显著差异,交互作用不显著。相比之下,同侧半球和对侧半球的网络半内连接无显著差异(图1B和C)。
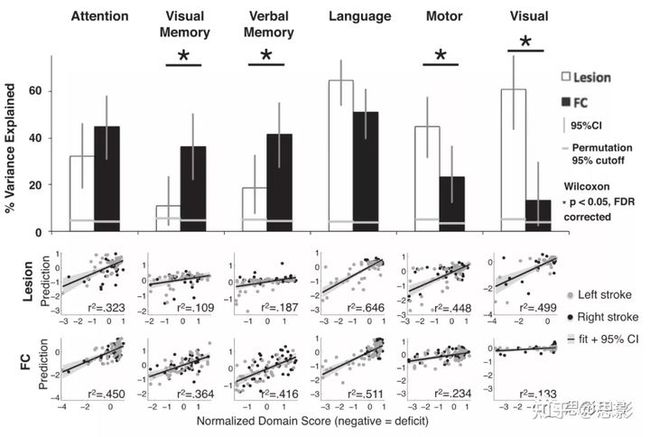
图1 FC的组间差异接下来,比较了网络间的连接值。在脑卒中组中,只有一对RSN显示出显著的FC变化。DAN-DMN在对照组表现为负连接,但在患者中负的更少一点(图1D)。(t=−3.15,P=0.0021)。此外,发现DAN同位FC的降低与同位DAN-DMN FC的增加之间有很强的关系(r=−0.61,P=9e-10;图1E),并且两组间差异显著(Fisher-z变换;z=−4.24,P<0.001)。其他网络表现出同侧网络分离和同位网络整合,但程度较小。接着测量病灶的分布和大小与同位FC的相关,发现病灶大小可以预测平均同位连通性(r=−0.46,P=6×10−7),但增加病灶地形分布信息没有改善预测(多变量预测:r=0.46,P=7×10−7)。这一结果表明,无论病灶的地形分布如何,只要病灶大小类似,那平均同位FC减少的数量也类似。因此,同位FC的减少是中风的一般结果。基于病灶和FC的行为障碍预测接下来探讨了结构数据和功能数据对脑卒中患者行为障碍的解释程度。经过人工病灶分割和R-fMRI处理后(图S1),研究者使用病灶map和矢量化的FC矩阵,结合留一岭回归生成lesion-defecit模型和FC-defecit模型(图2)。图3显示了每种行为领域的lesion-defecit和FC-defecit模型预测的准确性。柱状图表示的百分比代表每个模型中的病灶(白条)或FC(黑条)可解释方差(r2)。这两排散点图显示了用于确定每个受试者的模型准确性的预测分数和测量分数。为了简单起见,左右运动和视觉预测被结合起来,只显示对侧预测。每个模型的重要性通过排列测试确定:注意力(n=80,lesion P=4×10−4,FC P<1×10−4),视觉记忆(n=79,lesion P=9×10−4,FC P<1×10−4),形象记忆(n=79,病灶P=1.5×10−3,FCP<1×10−4),语言(n=98,lesion P<1×10−4,FC P<1×10−4),左运动(n=91,lesion P<1×10−4,FC P=1×10−3),右运动(n=91,lesion P<1×10−4,FC P<1×10−4),左视觉(n=53,lesion P=4×10−4,FC P=0.0104),右视觉(n=53,lesion P=1×10−4,FC P=0.0902)。
图2 基于结构和功能成像的行为障碍预测。(A)手绘病灶(上)和基于感兴趣区域的功能连接计算(下)。(B)使用病灶map和矢量化的FC矩阵,结合留一岭回归生成lesion-defecit模型和FC-defecit模型。(C)将每个患者的预测障碍分数与每个患者的测量分数进行比较,以确定模型的准确性。(D)用于预测Lesion(上)或FC矩阵(下)的Beta权重被投射回大脑上。
图3 lesion-defecit模型和FC-defecit模型的预测准确性因领域而异。柱状图显示了在六个行为领域中解释的方差百分比。白色条为lesion-defecit模型,黑条为FC-defecit模型。
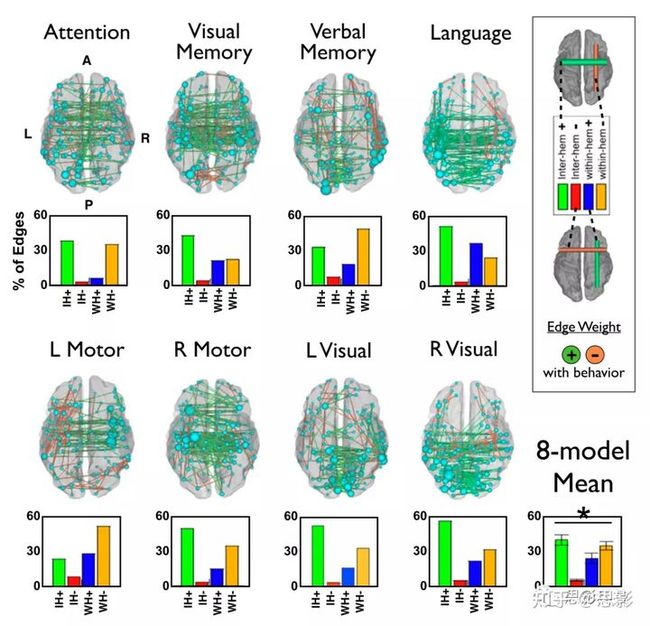
病变位置可以显著更好地预测运动和视觉区域的缺陷。FC可以显著更好地预测视觉记忆和言语记忆领域的缺陷。使用预测误差的Wilcoxon符号秩检验对lesion-defecit模型和FC-defecit模型(用星号表示)进行统计学比较,并进行FDR校正。水平灰色线表示置换10000次生成的空模型的P=0.05截断值。所有模型的表现都明显优于偶然性。散点图显示了来自lesion-defecit(上)和FC-defecit模型(下)的预测分数和实际测量分数之间的比较。行为得分是每个领域的多个测试的组合,并在z标准化(平均=0,SD=1)尺度上。采用双尾Wilcoxon配对符号秩检验,直接比较FC模型和病灶模型的预测精度。经过FDR校正后,四个行为领域显示两个模型的准确率之间存在显著差异。视觉记忆(病灶=10.9%,FC=36.4%,P=0.015)和非言语记忆(病灶=18.7%,FC对FC=41.6%,P=0.007),FC的预测优于病灶位置;而运动(病灶=44.8%,FC=23.4%,P=0.009)和视力障碍(病灶=49.9%,FC=13.3%,P=0.013),病灶的预测优于FC。注意领域表现出FC预测精度更高的趋势,语言的话基本差不多(注意:病灶=32.3%,FC=45.0%,P=0.074;语言:病灶=64.6%,FC=51.1%,P=0.21)。行为预测性FC的地形图来自FC和病灶预测模型的权重在所有留一模型中取平均值,并投射回大脑上(图4)。在图4中,绿线表示FC增加,行为预测更加准确;橙线表示FC减少,行为预测更加准确。需要注意的是,正的和负的权重并不意味着正或负的FC值,只是与感兴趣的行为有正或负的相关。图中给出了前200个最强的权重。每个节点的大小相对于其对模型的所有连接的总贡献。由图可知,FC-defecit图的共同特征是明显的。具体来说,最强的权重往往是正的半球间,即较强的FC与更好的表现相关;而半球内负,即更强的FC与较差的性能相关。为了比较在每个领域中权重最大的连接类型,每个FC-defecit模型的前1%的权重被分为四组:半球间阳性、半球间阴性、半球内阳性和半球内阴性。图中的柱状图显示了所有预测模型中四种连接类型的平均贡献。方差分析证实了连接类型(P=1.6×10−6)对缺陷预测的贡献度存在显著差异,半球间权重的正贡献最大,其次是半球内的负权重。语言是一个例外,因为一个重要的预测来自于左半球的正的大脑半球内权重,即准确的语言表现依赖于左半球区域之间的交流。
图4 每个FC-defecit模型的大多数预测连边和节点。
(左)驱动每个fc行为模型的前200个连接被投射到一个半透明的大脑(PALS图谱)上。绿色连接表示正权重(FC越大代表预测越准确),橙色连接表示负权重(FC越大代表预测越差)。包含在前200个权重中的324个子集显示为小球,大小由它们对模型的贡献决定。
(下)每个fc行为模型的权重被分为四组:半球间阳性、半球间阴性、半球内阳性和半球内阴性。条形图表示四组中各组的平均贡献。跨模型的平均值显示在右下角。方差分析表明四种连接类型的贡献有显著差异(P=1.6×10−6)。
图5说明了在每个fc行为预测中,RSN和RSN对之间的所有正连接的平均贡献。在注意和记忆领域,RSN之间的联系尤其突出。相比之下,语言权重更局限于听觉网络内的连接.为了量化这一观察结果,我们测量了RSN内的正权重与RSN之间的正权重的比值:注意:1.431,视觉记忆:1.526,言语记忆:1.499,语言=1.768,运动=1.605,视觉=1.624。
图5 FC-defecit模型的网络视图。一共有9个RSN。节点大小与网络内连接的贡献成正比。连边粗细与网络间连接的权重成正比。灰色边缘[例如,注意模型中的DMN-VIS]表示没有网络之间的权重。网络图使用Gephi生成的。
常见行为障碍的预测
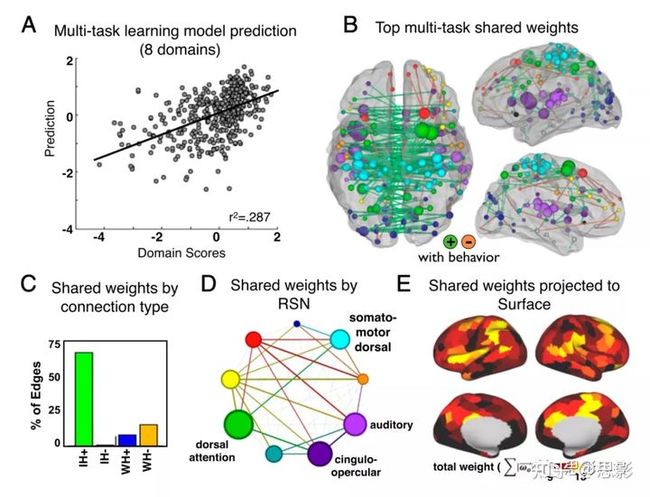
为了进一步研究模型之间的共同特征,使用了多任务学习。所有的行为领域都同时由两组权重进行预测。一组(ωk)按域进行优化,另一组(ωo)进行优化。这一过程使我们能够区分这8个领域特定的神经缺陷的和共享的神经缺陷的相关性。优化后的多任务学习模型解释了所有患者和所有5个领域28.7%的方差。另外探索了共享权重,以理解预测跨领域共同障碍的连接特征(图6)。共享权重主要涉及大脑半球间的连接。6B)。正权重分布在RSN中,但在DAN、CON、听觉网络和躯体运动背侧网络中的权重最大。
图6.多任务学习共享权重。(A)MTL模型解释了所有领域的28.7%的方差。(B)MTL共享特征的前200个权重将在大脑中可视化。(C)权重分为四组:半球间阳性、半球间阴性、半球内阳性和半球内阴性。(D)由RSN可视化的权重。节点大小与所有网络内连接的平均贡献成正比。边缘厚度与所有网络间连接的平均权重成正比。(E)将共享权重投影到324个表面地块上。
【讨论与结论】
本研究发现了脑卒中后局灶性损伤导致的网络同步性的巨大变化(用R-fMRI测量),并确定了它们在六个领域(注意、视觉记忆、言语记忆、语言、运动和视觉)的行为意义。此外,还比较了网络同步和病灶位置的行为意义。结果发现,中风后大脑半球间和大脑半球内FC的变化在不同的网络中显示出一致的模式。患者和对照组之间FC的最大变化涉及到大脑半球间FC的减少。大脑半球间FC的减少伴随着大脑半球内FC的增加,尤其是各个RSN网络内。此外,半球间FC减少最能预测患者样本中行为缺陷的。特定RSN的减少预测了相应行为领域的缺陷,这与大脑的大规模网络组织相一致。多任务学习模型表示,一组节点的半球间FC减少预测了跨领域的共同行为障碍。FC的半球间和半球内的变化共同构成了脑卒中损伤的一般生理网络表型。此外还发现了行为领域之间的根本区别。功能连接比损伤位置更好地预测记忆缺陷,损伤位置比功能更能地预测运动和视觉缺陷连接。两者都能很好地预测语言缺陷,注意力缺陷显示出向FC>损伤的趋势。作者认为这种划分自然来自于联想功能对大脑系统之间大规模分布交互作用的更大依赖,以及感觉-运动功能对输入-输出通路的更大依赖。总的来说,本研究指出了脑半球间整合和脑半球内分离及其脑卒中后破坏的基本重要性。更普遍地说,本研究将中风的病理生理学的主要特征与大脑网络的正常组织联系起来。行为领域的缺陷障碍涉及相应网络中的异常FC,而跨领域的行为障碍强调了少数关键大脑区域的同位FC。同样,异常连接最好地解释涉及联想功能的行为缺陷,如涉及大脑系统之间相互作用的记忆。相反,FC在感觉运动领域的预测性较差,而观察到的预测连接往往是局部的和网络内的。