生物化学-第两章半-肽和蛋白质
目录
一、肽和肽键
命名及书写方式
肽键的双键性质
二、蛋白质分类
(一)按照蛋白质的组成,分为:
(二)、蛋白质分子的形状和大小
三、蛋白质构象和蛋白质结构的组织层次
蛋白质结构的组织层次
四、蛋白质功能的多样性
五、蛋白质一级结构的测定
蛋白质一级结构的测定
(1)测定蛋白质的一级结构的要求
(2)测定步骤
六、蛋白质的氨基酸序列与生物进化
一、肽和肽键
肽是氨基酸的线性聚合物,因此也称为肽链(peptide chain)。
一个氨基酸的α-氨基与另一个氨基酸的α-羧基之间失水形成的酰胺键称为肽键,所形成的化合物为肽。
蛋白质是由一条或多条具有确定的氨基酸序列的多肽链构成的大分子。
由两个氨基酸组成的肽叫做二肽,由多个氨基酸组成的肽叫多肽。组成多肽的氨基酸单元叫做氨基酸残基。
- 二肽 tripeptide ,由两个AA组成的肽称为二肽。
- 三肽 tetrapeptides,
- 四肽 pentapeptides,
- 寡肽 Oligopeptide (12-20AA)
- 多肽Polypeptide,由多个AA组成的肽则称为多肽。
- molecular weight is less than 10 000(˂50AA)
- 蛋白质 protein(˃51AA)
组成多肽或蛋白质的AA单元称为氨基酸残基。
命名及书写方式
一条肽链通常含有一个游离的α-氨基酸(N-末端)和一个游离的α-羧基端(C-末端)。
规定肽链的氨基酸排列顺序从其N-末端开始,到C-末端终止。常把N-末端氨基酸残基放在左边,C-末端氨基酸残基放在右边。
小分子肽一般按照氨基酸残基的顺序进行命名,如:
Tyr-Gly-Gly-Phe-Met称为:酪氨酰甘氨酰甘氨酰苯丙氨酰蛋氨酸(脑啡肽)
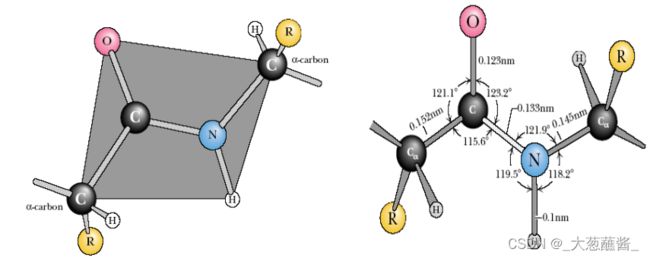
氨基酸的α-羧基和另一个氨基酸的α-氨基缩水形成肽键。肽键是氨基酸分子中氨基酸连接的基本方式。肽键相连构成蛋白质的主链。
肽链的骨干是由-N-Cα-C-序列重复排列而成,称为共价主链(main chain or backbone)。
肽键的双键性质
肽键共振产生的几个重要结果:
- 限制了肽键的自由旋转,只有N-Cα和C α-C这两个键
- 的旋转,构成了肽平面(peptide plane)或酰胺平面(amide plane)。
- 键长具有部分双键的功能。肽键的反式构型
核糖体合成的多肽:
1、有其编码基因;
2、先以前体形式合成;
3、不含D-AA;
4、肽键由α-NH2和α -COOH形成
e.g. 恶毒霉素(oxutocin)
非核糖体合成的多肽:
1、在系列酶作用下在核糖体以外形成;
2、可能含有D-AA;
3、肽键不一定由α -NH2和α -COOH形成
e.g. 谷胱甘肽(glutathine)
二、蛋白质分类
蛋白质的化学组成和分类
• 碳:50%;氢:7%;氧:23%;氮:16%;硫:
0.3%;其他:微量。
• 凯氏(Kjedahl)定氮法:
蛋白质含量=蛋白氮×6.25
(一)按照蛋白质的组成,分为:
1.简单蛋白(simple protein):又称为单纯蛋白质;这类蛋白质只含有α-氨基酸组成的肽链,不含其他成分。
(1)清蛋白(albumin)和球蛋白 ( globulin) :广泛存在于动物组织中。清蛋白易溶于水,球蛋白微溶于水,易溶于稀酸中。
(2)谷蛋白(glutelin)和醇溶谷蛋白(prolamin):植物蛋白,不溶于水,易溶于稀酸、稀碱中,后者可溶于70-80%乙醇中。
(3)精蛋白和组蛋白:碱性蛋白质,存在与细胞核中。
(4)硬蛋白:存在于各种软骨、腱、毛、发、丝等组织中,分为角蛋白、胶原蛋白、弹性蛋白和丝蛋白。
2、结合蛋白(conjugated protein):
由简单蛋白与其它非蛋白成分结合而成。(色、糖、脂、核、磷)
(1)色蛋白:由简单蛋白与色素物质结合而成。如血红蛋白、叶绿蛋白和细胞色素等。
(2)糖蛋白:由简单蛋白与糖类物质组成。如细胞膜中的糖蛋白等。
(3)脂蛋白:由简单蛋白与脂类结合而成。 如血清α-,β-脂蛋白等。
(4)核蛋白:由简单蛋白与核酸结合而成。如细胞核中的核糖核蛋白等。
(5)磷蛋白:由简单蛋白质和磷酸组成。如胃蛋白酶、酪蛋白、角蛋白、弹性蛋白、丝心蛋白等。
(二)、蛋白质分子的形状和大小
• 纤维状蛋白质(fibrous protein):具有比较简单、有规则的线性结构,形状呈细棒或纤维状。这类蛋白在生物体内主要起结构作用。
• 球状蛋白质(globular protein):形状接近球形或椭球形。疏水氨基酸侧链伸向蛋白内部,细胞中大多数的可溶性蛋白质,如胞质中酶类。
• 膜蛋白质(membrane protein):与细胞的各种膜系统结合而存在,为能与膜内的非极性烃链相互作用,膜蛋白的疏水氨基酸侧链伸向外部。
对于不含辅基的单纯蛋白质:
分子量=氨基酸数目×110;
构成蛋白质的20种氨基酸的平均相对分子量为138;但多数蛋白质中较小分子量的氨基酸占优势,因此平均相对分子质量接近128;又因为每形成一个肽键将除去一分子水,所以氨基酸残基的平均相对分子质量为:128-18=110。
三、蛋白质构象和蛋白质结构的组织层次
每一种蛋白质都有自己特有的空间结构或称三维结构,这种三维结构通常被称为蛋白质的构象。
• 构象是指具有相同结构式和相同构型的分子在空间里可能的多种形态,构象形态间的改变不涉及共价键的断裂。
一个特定的蛋白质理论上可采取多种构象,但在生理条件下,只有一种或很少几种在能量尚是有利的。
• 构型是指具有相同结构式的立体异构体中取代基团在空间上的相对取向,不同的构型如果没有共价键的断裂是不能互变的。
蛋白质结构的组织层次
• 一级结构(primary structure):指多肽链的氨基酸序列及二硫键的位置。
• 二级结构(secondary structure):指多肽链借助氢键排列成自己特有的α 螺旋和β 折叠片段等。
• 三级结构(tertiary structure):是指多肽链借助各种非共价键(或非共价力)弯曲、折叠成具有特定走向的紧密球状构象。
• 四级结构(quaternary structure):是指寡聚蛋白质中各亚基之间在空间上的相互关系和结合方式。
1969年国际纯化学与应用化学委员会(IUPAC)正式规定蛋白质的一级结构定义为氨基酸序列和二硫键的位置。
介于二级结构和三级结构之间还存在超二级结构(二级结构的组合,motif)和结构域(在空间上相对独立,domain)这两个层次。
四、蛋白质功能的多样性
1.催化功能:生物体内的酶都是由蛋白质构成的,它们有机体新陈代谢的催化剂。没有酶,生物体内的各种化学反应就无法正常进行。例如,没有淀粉酶,淀粉就不能被分解利用。
2.结构功能:蛋白质可以作为生物体的结构成分。在高等动物里,胶原是主要的细胞外结构蛋白,参与结缔组织和骨骼作为身体的支架,占蛋f总量的1/4。细胞里的片层结构,如细胞膜、线粒体、叶绿体和内质网等都是由不溶性蛋白与脂类组成的。动物的毛发和指甲都是由角蛋白构成的。
3.运输功能:脊椎动物红细胞中的血红蛋白和无脊椎动物体内的血蓝蛋白在呼吸过程中起着运输氧气的作用。血液中的载脂蛋白可运输脂肪,转铁蛋白可转运铁。一些脂溶性激素的运输也需要蛋白,如甲状腺素要!甲状腺素结合球蛋白结合才能在血液中运输。
4.贮存功能:某些蛋白质的作用是贮存氨基酸作为生物体的养料和胚胎或幼儿生长发育的原料。此类蛋白质包括蛋类中的卵清蛋白、奶类中的酪蛋白和小麦种子中的麦醇溶蛋白等。肝脏中的铁蛋白可将血液中多余日的铁储存起来,供缺铁时使用。
5.运动功能:肌肉中的肌球蛋白和肌动蛋白是运动系统的必要成分,它们构象的改变引起肌肉的收缩,带动机体运动。细菌中的鞭毛蛋白有类似的作用,它的收缩引起鞭毛的摆动,从而使细菌在水中游动。
6.防御功能:高等动物的免疫反应是机体的一种防御机能,它主要也是通过蛋白质(抗体)来实现的。凝血与纤溶系统的蛋白因子、溶菌酶、干扰素等,也担负着防御和保护功能。
7.调节功能:某些激素、一切激素受体和许多其他调节因子都是蛋白质。
8.信息传递功能:生物体内的信息传递过程也离不开蛋白质。例如,视觉信息的传递要有视紫红质参与,感受味道需要味觉蛋白。视杆细胞中的视紫红质,只需1个光子即可被激发,产生视觉。
9.遗传调控功能:遗传信息的储存和表达都与蛋白质有关。DNA在储存时是缠绕在蛋白质(组蛋白)上的。有些蛋白质,如阻遏蛋白,与特定基因的表达有关。β-半乳糖苷酶基因的表达受到一种阻遏蛋白的抑制,当需要合成β–半乳糖苷酶时经过去阻遏作用才能表达。
10.其他功能:某些生物能合成有毒的蛋白质,用以攻击或自卫。如某些植物在被昆虫咬过以后会产生一种毒蛋白。白喉毒素可抑制生物蛋白质合成。
五、蛋白质一级结构的测定
蛋白质的一级结构(Primary structure)
- 组成蛋白质的多肽链数目;
- 多肽链的氨基酸顺序;
- 多肽链内或链间二硫键的数目和位置;
其中最重要的是多肽链的氨基酸顺序,是蛋白质功能的基础。
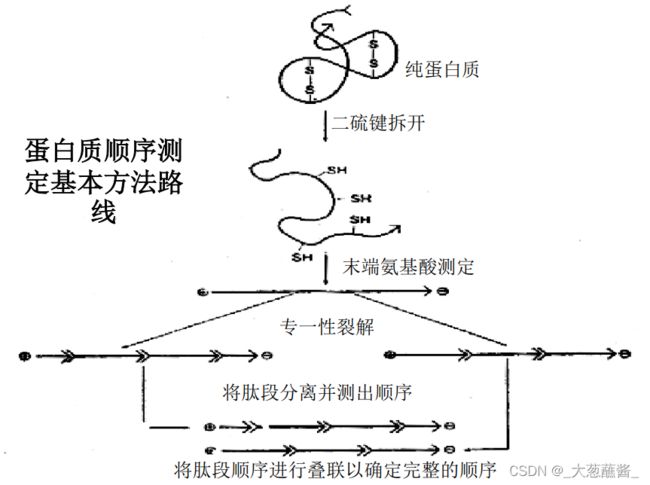
蛋白质测序的策略
1.纯化蛋白质,纯度在97%以上。确定蛋白质种多肽链的数目;
- 拆分蛋白质分子的多肽链;
- 断开多肽链种的二硫桥;
- 分析每一个多肽链的氨基酸组成;
- 鉴定多肽链的N-末端和C-末端残基;
- 裂解多肽链成较小的片段;
- 测定各肽段的氨基酸序列;
- 重建完整多肽链的一级结构;
- 确定二硫键的位置;
蛋白质一级结构的测定
蛋白质氨基酸顺序的测定是蛋白质化学研究的基础。
(1)测定蛋白质的一级结构的要求
样品必须纯(97%以上);
指导蛋白质的分子量;
知道蛋白质由几个亚基组成;
测定蛋白质的氨基酸组成;并根据分子量计算每种氨基酸的个数。
测定水解液中的氨量,计算酰胺的含量。
(2)测定步骤
①多肽链的拆分:由多条多肽链组成的蛋白质分子,必须进行拆分。几条多肽链借助非共价键连接在一起,称为寡聚蛋白质,如,血红蛋白为四聚体,烯醇化酶为二聚体;可用8mol/L尿素或6mol/L盐酸胍处理,即可分开多肽链。
②测定蛋白质分子中多肽链的数目:通过测定末端氨基酸残基的摩尔数与蛋白质分子量之间的关系,确定多肽链的数目。
③二硫键的断裂:几条多肽链通过二硫键交联在一起。可在8mol/L尿素或6mol/L盐酸胍存在下,用过量的β-巯基乙醇处理,使二硫键还原为巯基,然后用烷基化试剂保护生成的巯基,以防止它重新被氧化。可以通过加入盐酸胍方法解离多肽链之间的非共价力;应用过甲酸氧化法或巯基还原法拆分多肽链之间的二硫键。
④测定每条多肽链的氨基酸组成,并计算出氨基酸成分的分子比:
酸水解:6mol/LHCl,110℃,10-24h
色氨酸被破坏
色氨酸、苏氨酸、酪氨酸有少量破坏
天冬酰胺和谷酰胺转变为天冬氨酸和谷氨酸
天冬氨酸Asp和谷氨酸Glu的浓度分别用Asxand
Glx表示。
⑤分析多肽链的N-末端和C-末端
第一可以确定多肽链N-末端和C-端的氨基酸;
在肽链氨基酸顺序分析中,最重要的就是N-端氨基酸分析法。末端氨基酸测定的主要方法:
N 端测定
- 1、Sanger method:1-fluoro-2,4-dinitrobenzene (FDNB)
- 2、dansyl chloride method:dansyl chloride 二甲基氨基萘磺酰氯
- 3、Edman degradation method: phenylisothiocyanate苯异硫氰酸酯
C-末端测定
- 肼解法:此法是多肽链C-端氨基酸分析法。多肽与肼在无水条件下加热,C-端氨基酸即从肽链上解离出来,其余的氨基酸则变成肼化物。肼化物能够与苯甲醛缩合成不溶于水的物质而与C-端氨基酸分离。
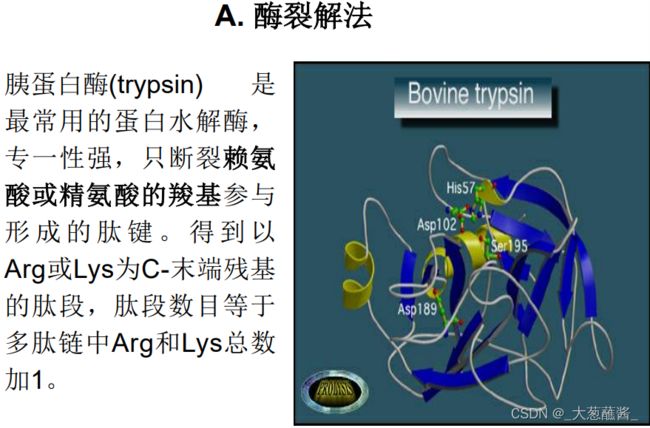
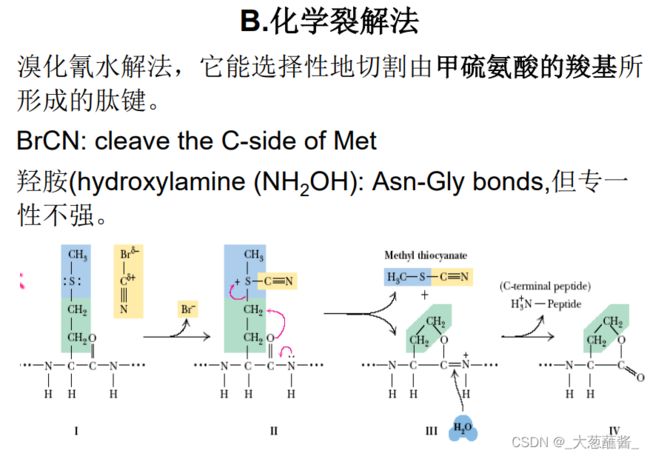
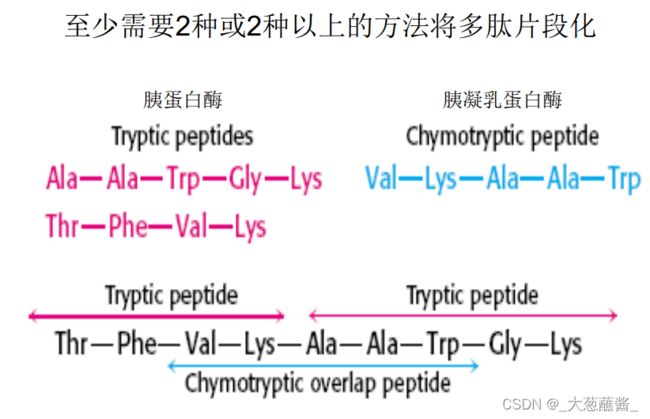
⑥ 多肽链断裂成多个肽段,可采用两种或多种不同的断裂方法将多肽样品断裂成两套或多套肽段或肽碎片,并将其分离开来。多肽的选择性降解的方法有
Edman化学降解法,一次能够降解几十个氨基酸,因此设法将多肽链裂解成较小的肽段,然后把它们分析下来,测定每一段氨基酸序列。
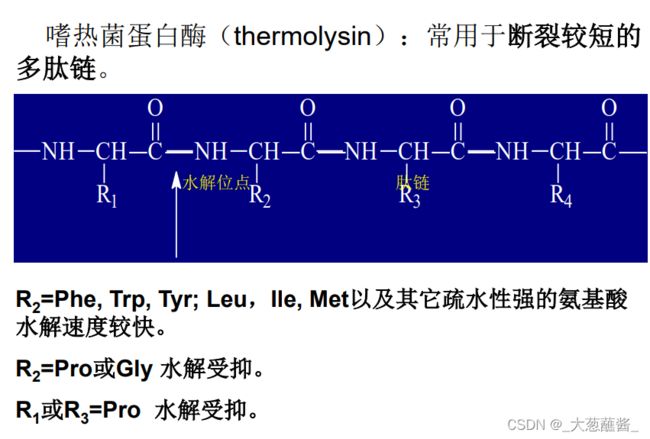
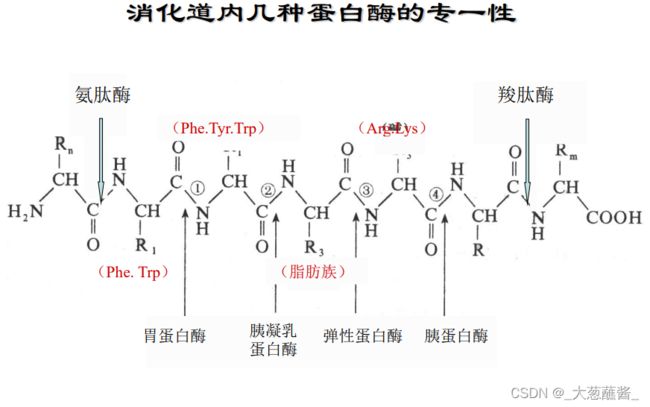
经分离纯化并打开二硫键的多肽链选用专一 性强的蛋白水解酶或化学试剂进行有控制的裂解。 裂解时要求断裂点少,专一性强,反应产率高。
⑦ 多肽的氨基酸顺序序列测定
Edman降解法(Edman degradation)
酶降解法:使用肽链外切酶或外肽酶(exopeptidase)
质谱法(Mass Spectrometry)
⑧ 确定肽段在多肽链中的次序:
利用两套或多套肽段的氨基酸顺序彼此间的交错
重叠,拼凑出整条多肽链的氨基酸顺序。
⑨ 确定原多肽链重二硫键的位置:
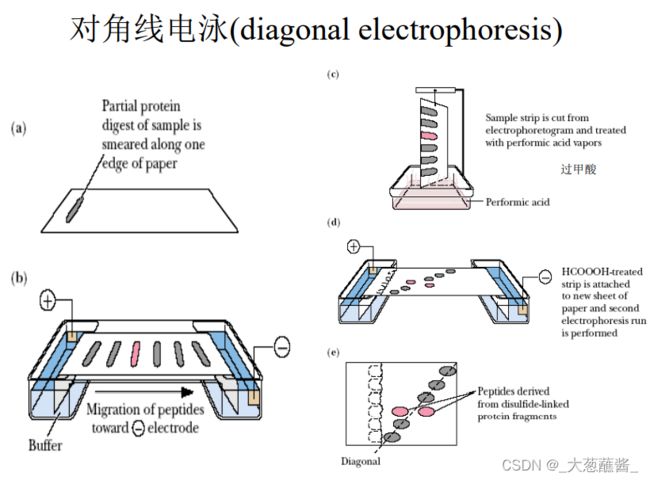
如果蛋白质分子中存在链间或链内二硫键,则在完成多肽链的氨基酸序列分析后,需要对二硫键的位置加以确定,这是因为在测定多肽链的氨基酸序列时,首先需要把蛋白质分子中的全部二硫键拆开。
确定二硫键的位置一般采用胃蛋白酶水解原来的含二硫键的蛋白质。
选用胃蛋白酶水解是因为它的专一性比较低,切点多,这样生成的肽段包括含有二硫桥的肽段都比较小,对后面的分离、鉴定比较容易;其次是胃蛋白酶的作用pH在酸性范围(~2),这有利于防止二硫键发生交换反应而造成的麻烦。
六、蛋白质的氨基酸序列与生物进化
同源蛋白质的物种差异与生物进化
同源蛋白质:在不同生物体内行使相同或相似功能的蛋白质。
同源蛋白质的氨基酸顺序中有许多位置的氨基酸对所有的种属是相同的,称不变残基(invariant residue);
而其它位置的氨基酸对不同的种属有相当大的变化,称可变残基(variable residue)。
同源蛋白质的氨基酸顺序中这样的相似性称为顺序同源(sequence homology)。
Homologous protein 功能相似,进化上有关系。
- Paralog protein 种内同源
- Ortholog protein 种间同源
Analogous protein 功能相似,进化上没有关系,
是趋同进化(covergent evlution)的结果。