易基因: MeRIP-seq等揭示组蛋白乙酰化和m6A修饰在眼部黑色素瘤发生中的互作调控|肿瘤研究
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
组蛋白去乙酰化抑制剂(HDACis)在多种恶性肿瘤中显示出令人鼓舞的结果。N6-甲基腺嘌呤(m6A)是最普遍的mRNA修饰,在肿瘤发生调控中起重要作用。然而,对组蛋白乙酰化和m6A RNA修饰之间的互作研究仍然未知。
2023年7月19日,上海交通大学医学院附属第九人民医院眼科庄艾、Xiang Gu、Tongxin Ge为第一作者, 上海交通大学医学院附属第九人民医院范先群院士、贾仁兵教授、柴佩韦博士为文章通讯作者,以“Targeting histone deacetylase suppresses tumor growth through eliciting METTL14-modified m6A RNA methylation in ocular melanoma”为题在《Cancer Commun (Lond)》杂志发表研究论文,该研究以黑色素瘤细胞和正常黑色素细胞系为对象,通过RNA-seq、CUT&Tag、单细胞测序、meRIP-seq和miCLIP-seq等多组学分析结果表明HDACis通过协调m6A修饰来发挥抗癌作用,从而揭示眼部黑色素瘤中HDAC/METTL14/FAT4表观遗传级联的“组蛋白-RNA互作”。
标题:Targeting histone deacetylase suppresses tumor growth through eliciting METTL14-modified m6A RNA methylation in ocular melanoma(靶向组蛋白去乙酰化酶通过诱导METTL14修饰的m6A RNA甲基化抑制眼部黑色素瘤的肿瘤生长)
时间:2023-07-19
期刊:Cancer Communications(London,England)
影响因子:IF 16.2 / 1区
技术平台:MeRIP-seq、miCLIP-seq、RNA-seq、CUT&Tag、单细胞测序等
研究摘要:
本研究旨在探讨组蛋白乙酰化和m6A修饰在眼部黑色素瘤发生中的调控作用。
- 研究通过组蛋白修饰抑制剂筛选研究了HDACis对眼部黑色素瘤细胞的作用。使用Dot blot法检测整体m6A RNA修饰水平。
- 利用RNA-seq、CUT&Tag、单细胞测序、甲基化RNA免疫沉淀测序(meRIP-seq)和m6A单核苷酸分辨交联和免疫沉淀测序(miCLIP-seq),以揭示HDACis对眼部黑色素瘤中甲基转移酶样14(METTL14)和FAT肿瘤抑制同源物4(FAT4)的作用机制。
- 采用实时荧光定量聚合酶链反应(qPCR)、western blotting和免疫荧光染色法检测METTL14和FAT4在眼黑色素瘤细胞和组织中的表达。
- 建立细胞模型和异种原位移植 (Orthotopic Xenograft) 肿瘤模型以鉴定METTL14和FAT4在眼部黑色素瘤生长中的作用。
- 采用RIP-qPCR、MeRIP-seq、miCLIP-seq和RNA稳定性实验来研究FAT4对m6A水平的作用机制。
研究结果首先表明了眼部黑色素瘤细胞对HDACis的易感性。HDACis触发眼黑色素瘤中m6A RNA修饰的升高。进一步的研究表明,METTL14是HDACis的下游候选基因。METTL14在组蛋白低乙酰化状态下沉默,而HDACi恢复了METTL14的正常组蛋白乙酰化水平,从而诱导其表达。随后,METTL14通过m6A-YTH N6-甲基腺苷RNA结合蛋白1依赖性方式促进肿瘤抑制因子FAT4表达,从而发挥肿瘤抑制作用。总之,本揭示了HDACi恢复METTL14的组蛋白乙酰化水平,并随后在肿瘤发生过程中调控METTL14介导的m6A修饰。
这些结果表明,HDACis通过协调m6A修饰发挥抗癌作用,揭示了眼黑色素瘤中HDAC/METTL14/FAT4表观遗传级联的“组蛋白-RNA互作”。
HDAC抑制剂通过HDAC/METTL14/FAT4轴在眼部黑色素瘤中的抗癌示意图
在正常黑素细胞中,转录起始位点的组蛋白乙酰化(H3K9Ac和H3K27Ac)维持METTL14转录。异常低乙酰化“锁定”METTL14表达,从而促进葡萄膜黑色素瘤发生。泛HDAC抑制剂LBH589作为恢复METTL14转录起始位点组蛋白H3乙酰化水平的“解锁钥匙”进行靶向校正,可发挥强大的抗肿瘤功能。
缩写:H3:组蛋白3;H3K9Ac:组蛋白3在赖氨酸9乙酰化;H3K27Ac:组蛋白3在赖氨酸27乙酰化;HDAC:组蛋白去乙酰化酶;HDACi:组蛋白去乙酰化酶抑制剂;METTL14:甲基转移酶样14;FAT4:FAT肿瘤抑制同源物4。
材料方法
- 人葡萄膜黑色素瘤细胞(MEL290,OMM2.3和OMM1)
- 人结膜黑色素瘤细胞(CRMM1,CRMM2和CM2005.1)
- 葡萄膜黑色素瘤细胞系MUM2B
- 葡萄膜黑色素瘤细胞系92.1
- 人视网膜色素上皮细胞系ARPE-19
- 皮肤黑色素瘤细胞系(A375和SK28)
- 正常人黑色素细胞系PIG1
研究结果
(1)HDACis对眼部黑色素瘤具有肿瘤选择性攻击作用
为了分析表观遗传药物的临床潜力,本研究对245种表观药物进行了高通量抑制剂库筛选。经过第一轮筛选和第二轮验证,筛选验证结果揭示三种组蛋白去乙酰化抑制剂(HDACis) 表现出肿瘤选择性抑制,选择性指数>5,分别是LBH589、RG2833和LMK-235。在3个HDACis中,LBH589在眼部黑色素瘤细胞中表现出最高的选择性指数(>10)和最低的IC50值。表明LBH589在治疗眼部黑色素瘤方面表现出高效和低毒性。
为了验证LBH589在体内诱导的抑制作用,通过带有荧光素酶标签的92.1细胞建立了眼部黑色素瘤异种原位移植肿瘤模型。动物成像显示,与对照组相比,LBH589处理组表现出生物发光信号和肿瘤体积均降低。表明LBH589在体外和体外选择性地抑制眼部黑色素瘤。
图1:LBH589选择性降低眼部黑色素瘤发生。
(A) 高通量组蛋白修饰药物筛选程序示意图。选择性指数=IC50(肿瘤细胞中的平均值)/IC50(正常黑素细胞)。
(B) 眼部黑色素瘤细胞系(92.1和CRMM1)经DMSO或抑制剂(100nmol/L)处理24h后组蛋白修饰药物筛选结果热图。数据代表三个生物重复。
(C) 六种组蛋白修饰抑制剂候选物(LBH589、I-BET726、RG2833、LMK-235、EED226和Chidamide)对眼部黑色素瘤细胞的选择性指数。这六种抑制剂在眼部黑色素瘤细胞中均表现出大于60%的抑制率,在PIG1细胞中表现出小于30%的抑制率。抑制率(%)=1-细胞活力(%)。
(D) 不同浓度LBH589处理眼部黑色素瘤细胞(92.1、OMM2.3和CRMM1)24h后,组蛋白H3K9Ac和H3K27Ac相对于组蛋白H3的western blotting,实验设置3个生物重复。
(E) 在用不同浓度的LBH589处理后,眼部黑色素瘤细胞(92.1、OMM2.3和CRMM1)中H3K9Ac和H3K27Ac相对于组蛋白H3的表达水平密度分析。实验设置3个生物重复,数据以平均值±SD表示。显著性采用非配对双尾Student‘ t检验确定。
(F-G)细胞聚落形成分析(colony-formation assay)以评估用LBH589(100nmol/L)处理后正常黑色素细胞(PIG1)和眼部黑色素瘤细胞(92.1、OMM2.3和CRMM1)的生长。显示三个实验重复的代表性图像(F)。数据(G)表示为3个生物学重复的平均值±SD。显著性采用非配对双尾Student t检验确定。
(H) 用体内小动物成像系统获得的图像显示,眼内注射前用DMSO或LBH589(100nmol/L,24小时)预处理的细胞异种原位移植模型中的生物发光信号受到抑制。显示5个生物学重复的代表性图像。数据表示为平均值±SD。整体和眼球外观显示LBH589对异种原位移植肿瘤体积具有抑制作用。显示5个生物学重复的代表性图像*P<0.05,**P<0.01,***P<0.001。
缩写:
HDAC:组蛋白去乙酰化酶;IC50:半数抑制浓度;BET家族:bromodomain and extra-terminal family;BETi:BET抑制剂;PRC2i:多梳抑制复合物2抑制剂;rep:重复;H3:组蛋白3;K9:赖氨酸9;K27:赖氨酸27;Ac:乙酰化;DMSO:dimethylsulfoxide;ns,无显著性。
(2)HDAC通过诱导METTL14表达激活m6A修饰
为分析LBH589的下游靶标,研究对LBH589处理的92.1细胞进行高通量转录组分析(RNA-seq),RNA-seq数据显示,2841个基因表达上调,2086个基因表达下调。下调基因主要富集在细胞周期、细胞分裂和DNA复制过程中,支持在眼部黑色素瘤中观察到的LBH589诱导的抑制表型。大多数上调基因(1776/2841,62.5%)表现出差异m6A甲基化水平(meRIP-seq和miCLIP-seq数据),表明HDAC抑制可能调控整体m6A甲基化模式。随后利用dot blot法检测整体m6A甲基化水平,结果揭示黑色素瘤细胞中的m6A甲基化水平低于正常黑色素细胞,这与黑色素瘤中的其他m6A发现一致。研究发现经LBH589处理后,眼部黑色素瘤细胞中的整体m6A甲基化增加,表明HDAC抑制可恢复眼部黑色素瘤中m6A甲基化水平。
随后,作者探索了LBH589诱导m6A甲基化激活的分子机制。对m6A相关修饰酶包括writer蛋白(METTL3、METTL14和WTAP)、eraser蛋白(ALKBH5和FTO)和reader蛋白(YTHDF1-3)的RNA-seq数据进行分析。分析结果表明,METTL14在LBH589处理的黑色素瘤细胞中显著增加,其他与m6A相关的修饰酶保持不变。且METTL14在mRNA和蛋白水平上均被激活。这些数据表明HDAC抑制诱导了METTL14的显著上调,导致眼部黑色素瘤中整体m6A甲基化水平的激活。
图2:LBH589通过激活METTL14促进整体m6A修饰。
(A) 火山图显示,与对照组相比,LBH589处理的眼部黑色素瘤细胞中有2086个基因表达下调,2841个基因表达上调(92.1)(|log2倍数变化|>1,P<0.05)。
(B) GO分析显示下调基因在眼部黑色素瘤细胞(92.1)中的功能。分析了3个生物重复。
(C) Venn图显示眼部黑色素瘤细胞(92.1)LBH589处理后上调的2841个基因与2357个差异m6A甲基化基因重叠。
(D) 正常对照细胞(ARPE-19和PIG1)、眼部黑色素癌细胞(OMM1、OMM2.3、MUM2B、OCM1、92.1、MEL290、CM2005.1、CRMM2和CRMM1)和皮肤黑色素瘤细胞(A375和SK28)中整体m6A水平的m6A点印迹。(E) 用不同浓度的LBH589处理24小时后,眼部黑色素瘤细胞(92.1、OMM2.3和CRMM1)中m6A水平的m6A dot blot。图像代表实验三组。数据以三个生物重复实验的平均值±SD。显著性采用非配对双尾Student t检验确定。
(F) DMSO和LBH589处理组中m6A相关基因相对表达水平的热图。
(G) RNA-seq结果显示LBH589处理后眼部黑色素瘤细胞(92.1)中m6A相关基因表达水平的倍数变化。
(H) 从DMSO和LBH589处理的眼黑色素瘤细胞(92.1)的RNA-seq数据中追踪METTL14的IGV图。分析了三个生物重复。
(I) 用不同浓度的LBH589处理后,眼部黑色素瘤细胞(92.1和CRMM1)中m6A相关蛋白相对于GAPDH的Western blot。*P<0.05,**P<0.01,***P<0.001。
缩写:
RNA-seq:RNA测序;GO:Gene Ontology;m6A:N6-甲基腺嘌呤;IGV:综合基因组学查看器;No.:编号;TSS:转录起始位点。METTL14:甲基转移酶样14;METTL3:甲基转移酶样3;WTAP:Wilms tumor 1-associating protein;ALKBH5:AlkB同源物5 RNA去甲基化酶;FTO:脂肪量和肥胖相关蛋白;YTHDF1:YTH N6甲基腺苷RNA结合蛋白1;YTHDF2:YTH N6甲基腺苷RNA结合蛋白2;YTHDF3:YTH N6甲基腺苷RNA结合蛋白3;GAPDH:甘油醛-3-磷酸脱氢酶;DMSO:dimethylsulfoxide;ns:无显著性。
(3)METTL14在眼部黑色素瘤中低乙酰化
由于METTL14参与LBH589介导的m6A激活,作者分析了眼部黑色素瘤中的METTL14乙酰化状态和表达水平。结果揭示了与正常色素细胞相比,眼部黑色素瘤细胞在METTL14启动子中表现出降低的H3K27Ac和H3K9Ac丰度。且HDAC抑制进一步增加了眼黑色素瘤细胞中METTL14的H3K27Ac和H3K9Ac水平。研究结果表明METTL14在眼部黑色素瘤中低乙酰化,但这种低乙酰化可以通过HDAC抑制来回复。
图3:METTL14在眼部黑色素瘤中被下调并作为抑癌因子。
(A) CUT&Tag分析的IGV图显示H3K27Ac在眼部黑色素瘤细胞和正常黑色素细胞的METTL14启动子区富集。分析了三个生物重复。
(B) 与IgG相比,眼部黑色素瘤细胞(92.1、OMM2.3和CRMM1)和正常对照细胞(PIG1和ARPE-19)METTL14 TSS区域H3K27Ac状态的ChIP-qPCR测定。数据以三个重复的平均值±SD表示。显著性采用非配对双尾Student t检验确定。
(C) 与DMSO处理组相比,LBH589暴露后眼部黑色素瘤细胞(92.1和CRMM1)METTL14的 TSS区域H3K27Ac状态的ChIP-qPCR分析。数据以三个重复的平均值±SD表示。显著性采用非配对双尾Student t检验确定。
(D) IHC检测显示眼部黑色素瘤和正常黑色素细胞样本中的METTL14代表性图像。眼部黑色素瘤组织(n=56)和正常黑色素细胞组织(n=27)中METTL14的IHC评分以四分位间距的中位数表示。显著性采用非配对Mann-Whitney非参数检验确定。
(E) CancerSEA(GSE139829)单细胞数据集中METTL14表达和功能状态的相关性分析。Pearson相关分析(通过相关强度<-0.1过滤,P<0.001)确定显著性。
(F) 内部队列(n=56)中METTL14的IHC评分与无复发率相关性的Kaplan–Meier分析。显著性通过双侧对数秩检验确定。
(G) qPCR数据显示分别在METTL14敲低组或对照组中在DMSO或LBH589暴露后METTL14在眼部黑色素瘤细胞(92.1和CRMM1)中的表达。
(H) METTL14敲低组和对照组中眼黑色素瘤细胞(92.1和CRMM1)在DMSO或LBH589暴露后,METTL14相对于GAPDH的Western blot。
(I) METTL14敲低组或对照组中进行细胞聚落形成分析(colony-formation assay)以评估DMSO或LBH589处理后眼部黑色素瘤细胞(92.1和CRMM1)的生长。
(J) 在METTL14敲低组或对照组中,分别进行transwell检测以评估DMSO或LBH589处理后眼部黑色素瘤细胞(92.1和CRMM1)的细胞迁移能力。
(K) 用体外小动物成像系统获得的图像显示,分别在METTL14敲低组或对照组中,在DMSO或LBH589(100nmol/L,24小时)处理后,源自92.1细胞的异种原位移植模型中的生物发光信号。显示了5个生物重复的代表性图像。数据以平均值±SEM表示。异种原位移植模型的整体和眼球外观显示肿瘤体积*P<0.05,**P<0.01,***P<0.001。
缩写:
UM:葡萄膜黑色素瘤,uveal melanoma;CUT&Tag:目标下切割和标记,Cleavage Under Targets and Tagmentation;No.:编号,number;rep,重复replicate;METTL14:甲基转移酶样14;IGV:综合基因组学查看器;NC:对照组normal control;H3K27Ac:组蛋白3在赖氨酸27处乙酰化;ChIP:染色质免疫沉淀Chromatin immunoprecipitation;qPCR:定量实时聚合酶链式反应;TSS:转录起始位点;EMT:上皮-间充质转化;SD:标准偏差;SEM:平均值的标准误差;DMSO:dimethylsulfoxide;IHC:免疫组化;GAPDH:甘油醛-3-磷酸脱氢酶。
(4)FAT4是METTL14的下游标靶基因
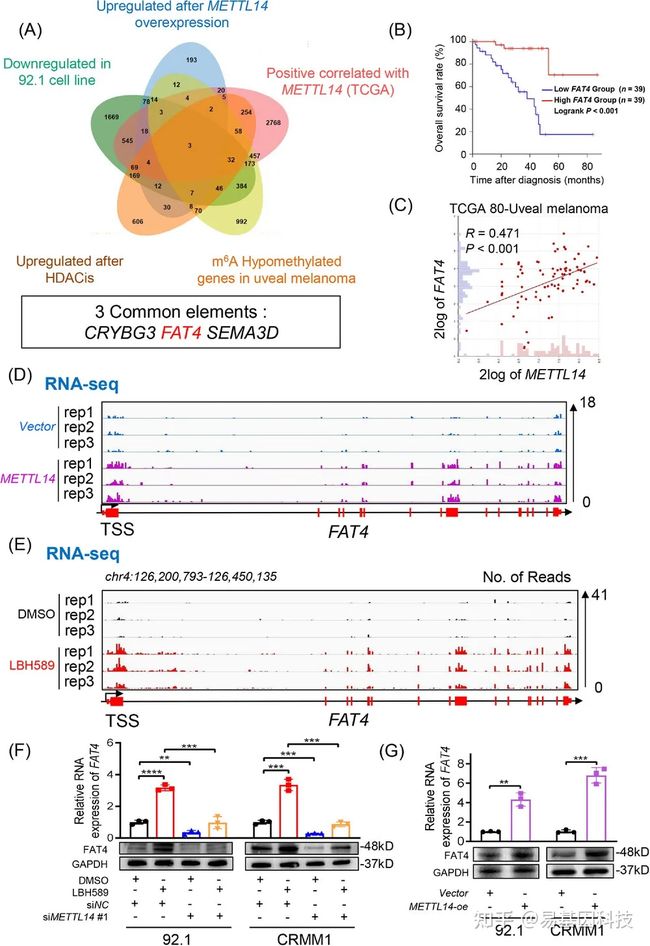
作者研究了METTL14在眼部黑色素瘤中的抑癌作用机制。使用多组分析鉴定了三个符合以下标准的基因(CRYBG3、FAT4、SEMA3D):在METTL14过表达后上调(蓝色圆圈,GSE215095)、在LBH589处理后上调(棕色圆圈,GSE214457),与TCGA队列中的METTL14呈正相关(红色圆圈,R>0.3,P<0.05),且在m6A修饰水平低的肿瘤中下调(绿色圆圈,GSE176345)(黄色圆圈,GSE137675)。在这三个基因中,只有FAT4表现出预后价值,且在TCGA队列中与METTL14平行表达(R=0.471,P<0.001)。如RNA-seq色谱图所示,METTL14过表达和LBH589处理后,FAT4表达显著增加。且FAT4表达由LBH589处理诱导,在RNA和蛋白水平上与METTL14表达正相关。总之,研究结果表明FAT4可能参与METTL14介导的眼部黑色素瘤的肿瘤抑制。
图4:FAT4是METTL14的下游标靶基因。
(A) 将CRYBG3、FAT4和SEMA3D鉴定为METTL14的下游候选标靶维恩图。
(B) Kaplan-Meier分析显示,在按METTL14表达水平分层的TCGA葡萄膜黑色素瘤患者中,METTL14表达与总生存率之间的相关性。使用双侧对数秩检验确定统计学显著性。
(C) TCGA葡萄膜黑色素瘤队列中METTL14和FAT4表达的相关性分析。使用Pearson相关分析确定显著性(R=0.471,P<0.001)。
(D) 对照组和METTL14过表达的眼部黑色素瘤细胞系RNA-seq数据中FAT4的IGV分析。
(E) 对照组和LBH589处理组的眼部黑色素瘤细胞系中RNA-seq数据中FAT4的IGV分析。
(F) RT-PCR(上图)数据显示,METTL14敲低组和对照组分别在DMSO或LBH589处理后,眼部黑色素瘤细胞(92.1和CRMM1)中FAT4表达。数据表示为3个生物重复的平均值±SD,。显著性采用非配对双尾Student t检验确定。分别在METTL14敲低组和对照组中DMSO或LBH589处理后,眼部黑色素瘤细胞(92.1和CRMM1)中FAT4相对于GAPDH的western blot分析(下图)。显示3个生物重复的代表性图像。
(G) RT-PCR(上图)数据显示FAT4在对照和METTL14过表达的眼部黑色素瘤细胞(92.1和CRMM1)中的表达。对照和METTL14过表达的眼部黑色素瘤细胞(92.1和CRMM1)中FAT4相对于GAPDH的western blot分析(下图)。数据表示为三个生物重复的平均值±SD。显著性采用非配对双尾Student t检验确定*P<0.05,**P<0.01,***P<0.001。
缩写:HDACis:组蛋白去乙酰化抑制剂;m6A:N6-甲基腺嘌呤;CRYBG3:结晶蛋白β-γ结构域蛋白3;SEMA3D:Semaphorin 3D;FAT4:FAT肿瘤抑制同源物4;METTL14:甲基转移酶样14;TCGA:癌症基因组图谱;IGV:综合基因组学查看器。
(5)FAT4在眼部黑色素瘤中的抑癌作用
尽管FAT4在许多癌症中是一种传统的抑癌因子,但其在眼部黑色素瘤中的功能仍然是个谜。本研究检测了眼部黑色素瘤样品和细胞系中的FAT4表达。与METTL14类似,眼部黑色素瘤临床样本中的FAT4水平显著降低,与复发率降低相关。FAT4的RNA和蛋白水平在眼部黑色素瘤细胞系中也降低。为了评估FAT4在METTL14介导的肿瘤抑制中的作用,作者在METTL14过表达的眼部黑色素瘤细胞系中沉默FAT4表达,结果表明FAT4敲除减弱了METTL14介导的肿瘤抑制,包括细胞聚落形成能力和转移能力。在异种原位移植肿瘤模型中,FAT4沉默消除了METTL14过表达诱导的肿瘤抑制。总之,这些结果表明FAT4参与了由METTL14介导的眼部黑色素瘤抑制网络。
图5:FAT4是一种抑癌因子。
(A) IHC检测显示眼部黑色素瘤和正常黑色素细胞样本中FAT4的代表性图像。眼部黑色素瘤组织(n=56)和正常黑色素细胞组织(n=27)中FAT4的IHC评分以四分位数间距的中位数表示。显著性采用非配对Mann-Whitney非参数检验确定。
(B) 内部队列中FAT4 IHC评分与无复发率之间相关性的Kaplan–Meier分析(n=56)。显著性通过双侧对数秩检验确定。
(C) FAT4在眼部黑色素瘤细胞系和视网膜色素上皮细胞中相对于正常黑色素细胞表达水平的RT-PCR分析。
(D) 眼部黑色素瘤细胞、视网膜色素上皮细胞和正常黑色素细胞中FAT4相对于GAPDH的western blot分析。
(E) IGV分析显示眼部黑色素瘤细胞和正常黑色素细胞中RNA-seq数据中的FAT4表达水平。
(F) FAT4相对于对照组或METTL14过表达的眼部黑色素瘤细胞(92.1和CRMM1)中GAPDH的western blot分析。
(G) 进行细胞聚落形成分析(colony-formation assay)以评估对照或METTL14过表达的眼部黑色素瘤细胞(92.1和CRMM1)在FAT4敲低时的生长。
(H) transwell测定以评估对照或METTL14过表达的眼部黑色素瘤细胞(92.1和CRMM1)在FAT4敲低时的细胞迁移能力。(I) 对照组或METTL14过表达的眼部黑色素瘤细胞(92.1和CRMM1)异种原位移植模型在FAT4敲低时的生物发光信号(上图)和眼球外观(下图),显示5个生物学重复的代表性图像。数据以平均值±SEM表示。*P<0.05,**P<0.01,***P<0.001。
(6)YTHDF1识别m6A修饰增强了FAT4的RNA稳定性
由于METTL14是m6A修饰的识别蛋白(writer),作者研究了METTL14是否以m6A修饰依赖性方式调控FAT4表达。利用miCLIP-seq(图6A)和meRIP-seq(图6B)分析结果发现,眼黑色素瘤细胞系中的FAT4发生了低甲基化,与这些细胞中METTL14低水平表达一致。此外RIP分析发现FAT4在眼部黑色素瘤细胞中m6A显著低甲基化。外源性METTL14表达进一步增加了FAT4的m6A甲基化水平。总的来说,这些数据表明,METTL14负责催化FAT4 mRNA的m6A甲基化。
图6:YTHDF1对FAT4 m6A修饰的识别增强了RNA的稳定性。
(A-B) IGV图显示眼部黑色素瘤细胞和正常黑色素细胞中的miCLIP-seq(A)和meRIP-seq(B)数据中FAT4的m6A水平。
(C) 眼部黑色素瘤细胞(92.1)和正常黑色素细胞(PIG1)中METTL14转录本中YTHDF1、YTHDF2和YTHDF3状态的RIP-qPCR分析。数据以3个生物重复的平均值±SD表示。
(D) FAT4、YTHDF1、YTHDF2和YTHDF3相对于对照或YTHDF1/2/3敲低的眼部黑色素瘤细胞(92.1)和正常黑色素细胞(PIG1)中GAPDH的western blot分析。
(E) YTHDF1沉默后,对照组或METTL14过表达的眼黑色素瘤细胞中FAT4的整体mRNA水平。
(F) 葡萄膜黑色素瘤TCGA队列中FAT4表达和YTHDF1表达的相关性分析。使用Pearson相关分析确定统计学显著性(R=0.359,P<0.01)。
(G)METTL14在眼部黑色素瘤中作为肿抑癌因子的调控机制示意图。METTL14在FAT4转录本中沉积m6A修饰,YTHDF1识别FAT4 mRNA中的m6A修饰位点并增强其稳定性,从而促进FAT4蛋白表达*P<0.05、**P<0.01。
缩写:
FAT4:FAT肿瘤抑制同源物4;rep:重复;m6A:N6-甲基腺嘌呤;MeRIP-seq:甲基化RNA免疫沉淀测序;miCLIP-seq,m6A单核苷酸分辨交联和免疫沉淀; RIP:RNA结合蛋白免疫沉淀;qPCR,定量实时聚合酶链式反应。
研究结论
本研究表明,组蛋白乙酰化是眼部黑色素瘤中m6A甲基化的重要调控因子。LBH589抑制HDAC并激活METTL14的组蛋白乙酰化,从而介导肿瘤发生中的m6A修饰。此外,METTL14通过以m6A-YTHDF1依赖性方式促进肿瘤抑制因子FAT4表达而发挥抑癌因子功能。这些结果揭示了HDACi LBH589通过重编程m6A甲基化抑制癌症进展机制,揭示了眼部黑色素瘤发生中的一种新组蛋白-RNA互作表观遗传学机制。
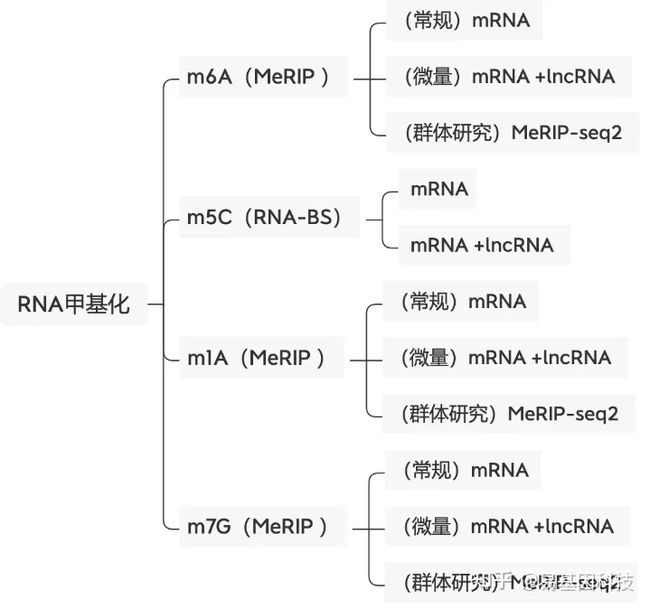
关于易基因RNA m6A甲基化测序(MeRIP-seq)技术
易基因MeRIP-seq技术利用m6A特异性抗体富集发生m6A修饰的RNA片段(包括mRNA、lncRNA等rRNA去除所有RNA),结合高通量测序,可以对RNA上的m6A修饰进行定位与定量,总RNA起始量可降低至10μg,最低仅需1μg总RNA。广泛应用于组织发育、干细胞自我更新和分化、热休克或DNA损伤应答、癌症发生与发展、药物应答等研究领域;可应用于动物、植物、细胞及组织的m6A检测。
大样本量m6A-QTL性状关联分析,传统MeRIP单个样品价格高,通常难以承担。易基因开发建立MeRIP-seq2技术,显著提成IP平行性,实现不同样本间相对定量,降低检测成本。
易基因提供适用于不同科研需求的MeRIP技术:
- m6A甲基化-常量mRNA 甲基化测序(MeRIP-seq)
- m6A甲基化-常量mRNA +lncRNA甲基化测序(lnc-MeRIP-seq)
- m6A甲基化-微量mRNA +lncRNA甲基化测序(Micro-lnc-MeRIP-seq)
- 高通量m6A甲基化-常量mRNA甲基化测序(MeRIP-seq2)
技术优势:
- 起始量低:样本起始量可降低至10-20μg,最低仅需1μg总RNA;
- 转录组范围内:可以同时检测mRNA和lncRNA;
- 样本要求:可用于动物、植物、细胞及组织的m6A检测;
- 重复性高:IP富集重复性高,最大化降低抗体富集偏差;
- 应用范围广:广泛应用于组织发育、干细胞自我更新和分化、热休克或DNA损伤应答、癌症的发生与发展、药物应答等研究领域。
研究方向:
m6A甲基化目前主要运用在分子机制的理论性研究
- 疾病发生发展:肿瘤、代谢疾病(如肥胖/糖尿病)、神经和精神疾病(如阿尔兹海默症/抑郁症)、炎症…
- 发育和分化:早期胚胎发育、个体/组织/器官生长发育、干细胞分化与命运决定、衰老
- 环境暴露与响应:污染、抗逆、生活方式
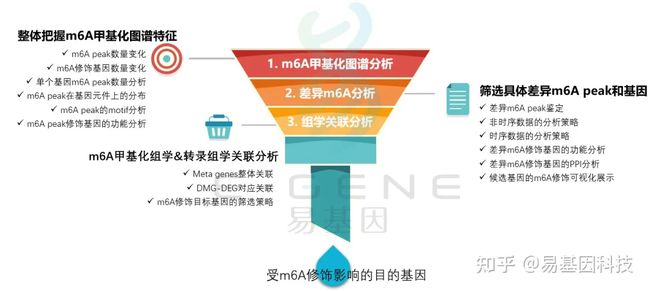
关于m6A甲基化研究思路
(1)整体把握m6A甲基化图谱特征:m6A peak数量变化、m6A修饰基因数量变化、单个基因m6A peak数量分析、m6A peak在基因元件上的分布、m6A peak的motif分析、m6A peak修饰基因的功能分析
(2)筛选具体差异m6A peak和基因:差异m6A peak鉴定、非时序数据的分析策略、时序数据的分析策略、差异m6A修饰基因的功能分析、差异m6A修饰基因的PPI分析、候选基因的m6A修饰可视化展示
(3)m6A甲基化组学&转录组学关联分析:Meta genes整体关联、DMG-DEG对应关联、m6A修饰目标基因的筛选策略
(4)进一步验证或后期试验
易基因科技提供全面的RNA甲基化研究整体解决方案,详询易基因0755-28317900。
参考文献:
Zhuang A, Gu X, Ge T, Wang S, Ge S, Chai P, Jia R, Fan X. Targeting histone deacetylase suppresses tumor growth through eliciting METTL14-modified m6 A RNA methylation in ocular melanoma. Cancer Commun (Lond). 2023 Jul 19.
相关阅读:
干货系列:m6A RNA甲基化研究的前期探索性实验思路
干货系列:高通量测序后的下游实验验证方法——m6A RNA甲基化篇
干货系列:m6A RNA甲基化研究的数据挖掘思路
项目集锦 | 易基因近期m6A甲基化(MeRIP-seq)研究成果