Hum Brain Mapp:皮质脑-心轴的微状态
摘要
脑电图(EEG)微状态是具有准稳态头皮地形的大脑状态。这种状态是否会延伸到身体层面(即外周自主神经系统)目前尚不清楚。假设微状态作为一种中枢自主神经网络的功能状态会延伸到脑-心轴水平。因此,本研究结合了EEG和心跳动力学序列来估计起源于皮层的定向信息传递,以靶向交感和副交感神经活动振荡,反之亦然,以获得传入的功能方向。数据来自两组被试:36名健康被试进行心算认知负荷测试,以及26名被试进行冷压生理负荷测试。所有被试在研究期间均为健康状态。基于统计检验和拟合优度评估,本研究明了功能性脑-心轴微状态的存在,尤其是大脑皮层,因为微状态来源于脑电信号。这种神经系统微状态是一种时空准稳态,专指从大脑到心脏的传出方向。本研究证明了可能与特定实验条件相关的脑-心微状态,以及非特异性任务的脑-心微状态。
前言
大多数研究支持这样一种观点,即使用EEG测量的大脑动力学具有短暂的准稳定状态,通过与全局场电位(GFP)峰值时间相近的特定头皮地形的大脑活动来表现,这种状态被定义为大脑/脑电微状态,并与思维原子(atoms of thought)相关联。许多研究已经确定了几种典型的微状态。这些微状态被认为是自发意识心理过程链的基本组成部分,并与心理状态水平相关。最近的研究表明,微状态序列的时间演变取决于睡眠、运动任务、思维、催眠以及心理和精神障碍等各种生理过程。研究发现,这些疾病表现为无标度(scale-free)动力学的脑电微状态。
微状态的发生基于当前对脑功能的理解,即脑功能源于弥散和分布式脑网络中的大规模并行处理。尽管微状态历来与大脑静息态(RS)相关,但最近的研究将微状态动力学与其他功能性认知活动或生理状况联系起来。这使我们能够观察到许多皮层和皮层下脑区的活动与微状态动力学有关,特别是岛叶、丘脑、杏仁核、前扣带回等区域。
尽管没有明确提及,但据报道这些区域也属于中枢自主神经网络(CAN)。CAN不能归因于特定的脑区,因为它包括髓质区、中脑和杏仁核、丘脑、外周自主神经末梢和皮层区域(如内侧前额叶皮层、前扣带回和岛叶)。CAN由多个部分组成,包括与中枢神经系统的交感和副交感连接,并涉及到功能性脑-心相互作用(BHI)的定义。实际上,BHI代表了起源于CAN的化学、电和解剖连接网络的功能结果。通过分析脑电和心率变异性(HRV)序列揭示的功能性BHI研究表明,健康的BHI变化是对一些事件的生理反应,如情绪感知、睡眠交替、认知负荷、有意运动和自主运动。此外,据报告,BHI时间序列的变化与神经病理状态(如轻度抑郁症、癫痫和精神分裂症)有关。功能性BHI是一种定向现象,即大脑活动对心血管功能的影响不一定等同于心脏活动对大脑动力学的影响。此外,BHI是一个随时间和生理状况改变的动态过程。BHI的影响遍布整个大脑,包括中枢自主神经网络、默认模式网络等。
先前的研究将脑电微状态与中枢自主神经网络(CAN)内的脑区联系起来,但尚不清楚微状态是否也存在于中枢神经系统和自主神经系统(ANS)之间的交界处。为了探索这种可能性,本研究考察了大脑和心脏在休息、认知和身体压力下的功能连接。本研究的处理流程利用了功能性BHI相关GFP的时间分辨估计,本文将其称为BHI-GFP。通过假设微状态延伸到脑-心层面,我们可以解释BHI-GFP序列的全局方差,并根据实验启发观察到BHI-微状态动力学的相关变化。本研究使用了两个数据集来验证这一假设:一个数据集使用多个心算任务来引发认知负荷(CW)的BHI变化,另一个数据集使用冷压测试(CPT),这是一种引起强烈交感神经反应的著名方法。本研究的目的有三个:(i)证明BHI中存在准稳态的微状态;(ii)验证微状态分析在BHI背景下的适用性;(iii)研究心理生理状态是否影响BHI衍生的微状态动力学。
材料和方法
实验数据及预处理
采用两种独立的实验范式,同时诱发中枢神经系统(CNS)和自主神经系统(ANS)的反应,以验证所提出的系统级脑-心相互作用(BHI)分析框架。本研究获得了比萨大学当地伦理委员会的正式批准,批准编号为0036590/2021。
认知负荷数据集
通过中枢神经系统(CNS)操作来激活自主神经系统(ANS)的众多非侵入性方法之一是让被试进行心算来完成认知负荷(CW)任务。一般的实验范式包括要求被试通过点击按钮或在规定的时间内执行心算任务。除了涉及高级脑区的认知功能外,这些任务还会对自主神经系统产生强烈压力。事实上,CW任务在CNS和ANS水平上分别进行了研究,但只有少数研究关注其与功能性BHI的相关性。研究发现,在应激反应中,心血管活动的调节与大脑左额叶和颞叶的活动有关。此外,研究表明,在CW任务期间,大脑中央后回和大脑中叶向心脏方向传递的信息流增加。因此,分析的第一个数据集(CW)是心算任务期间的EEG数据,已经发布在Physionet.org数据存储库上(https://physionet.org/content/eegmat/1.0.0/)。
该数据集包括使用10-20标准的19导电极帽同步记录的脑电(EEG)和1导联心电图(ECG)活动数据,采样率为500Hz。每个被试在3分钟的静息态后执行同样时长的CW任务。通过目视检查后,有4名被试的数据因存在明显的伪迹而被排除。最终,32名被试(8名男性,平均年龄为18±2.01岁)的数据用于进一步分析。入选标准包括视力正常或矫正至正常、色觉正常、无精神或认知障碍的临床病史,以及无学习障碍。具体的排除标准包括精神或神经系统疾病、药物或酒精成瘾,以及使用精神活性药物。
数据经预处理后提供,预处理包括50Hz的陷波滤波,然后进行0.5-45Hz的带通滤波,并使用独立成分分析来剔除常见的伪迹(如眼电、肌电和心电)。关于该数据集的更多细节,包括数据采集和信号预处理,请参见Zyma等人(2019)的研究。
冷压试验数据集
冷压试验(CPT)是一种常用的自主神经功能测试方法,旨在验证身体对接触性温度刺激的自主功能和中枢神经系统(CNS)的反应。通常是将远端肢体(如手或脚)或面部浸入温度在0-4℃的冷水中,保持1-5min。实际上,CPT能够强烈激活身体各个系统,如压力反射和交感神经系统,以积极响应因刺激引起的适应状态,并恢复到稳态平衡。在EEG中,CPT引起了大范围的皮层和皮层下脑区的激活,包括额叶区域(宽频段)、双侧颞叶区域(β频段)和后顶叶区域(α频段)。先前的研究已经探讨了CPT引起的BHI变化,发现了广泛的双向相互作用,而且大脑动力学对心跳有着更大的影响。因此,器官水平的全脑方法估计BHI(脑-心相互作用)应该特别适用于这种实验环境。
第二个数据集(CPT)包含24名健康被试(平均年龄为26.7岁;9名女性),均为右利手。被试坐在舒适的椅子上,在3分钟的静息态后进行冷压试验。CPT的实施方法是要求被试用非利手(即左手)放入装满冰水的篮子中,持续时间长达3分钟。有研究表明,这个时间阈值通常不会引发疼痛感。但被试在此过程中若感到不适,可以随时终止实验。
使用128导EEG和1导联心电图(ECG)进行电生理记录,采样率为500Hz。两个数据集(即CW和CPT)之间没有共同的被试、记录设备或任何仪器。ECG原始序列经过带通滤波,并使用Pan-Tompkins算法检测R峰,随后使用Kubios软件进行分析,以排除伪迹,最后进行目视检查以便进一步分析。EEG序列部分按照哈佛脑电自动处理工具(HAPPE)进行预处理,具体请参见Gabard-Durnam等人(2018)的研究,使用MATLAB(MathWorks Inc.)中的EEGLAB工具包。简而言之,首先排除外围通道,然后进行带通滤波(1-100Hz)和陷波滤波(50Hz)。通过计算每个通道的曲线下面积来识别并移除伪迹通道,如果超过所有通道分布的3个标准差,则标记为伪迹通道。剩下通道与其相邻通道使用加权距离相关性作为距离度量进行比较。为了提高微状态结果的准确性,本研究使用REST方法对通道进行离线重参考。REST方法涉及将脑电数据转换为独立于参考的源空间,然后使用加权矩阵将数据反向投影到头皮电极上。该方法已被证明可以提高EEG微状态分析的可靠性和重复性。
信号预处理
采用汉明窗为2s(1000个样本)、步长为0.1s的短时傅里叶变换对脑电时间序列进行时间分辨功率谱密度(PSD)分析,得到采样率为10Hz的时间序列。然后,将PSD整合到常用的EEG频段(1-45Hz)进行分析。另一方面,使用平滑的伪Wigner-Ville分布估计HRV(心率变异性)序列的时间分辨PSD,将其整合到0.04Hz-0.15Hz(低频段LF,作为交感神经活动的非特异性标记)和0.15Hz-0.4Hz(高频段HF,用于副交感神经活动)的范围内。HRV的两个PSD功率序列(LF和HF)均以10Hz进行采样,与从EEG得到的功率序列保持一致。
脑-心相互作用(BHI)估计
BHI报告是使用SDG模型生成的。具体而言,该模型根据多振荡器模型构建了一个脑电序列,其振幅是由一阶外生自回归过程产生,其中外生项模拟了心脏向大脑传递信息的时变通信。同时,通过扩展Brennan等人(2002)提出的脉冲频率调制模型,建立RR动力学模型,其中驱动交感神经活动的功能有一个外源性项,代表脑-心耦合指数的方向特异性。
总之,时变方向性BHI生物标志物代表了对EEG和HRV频率成分组合的心-脑和脑-心相互作用的即时评估。该模型的主要思想是,这两个系统的电生理信号不是彼此独立的,引入的耦合项试图形式化这些相互作用。具体而言,CB→HF(tn)的正值表示在tn时刻,频段B中脑电功率谱密度的增加与HF频段HRV-PSD序列的成比例增加相关。也就是说,脑电信号在指定频段的功率与HRV信号在HF频段的功率呈正相关,两者之间存在函数关系。
整个BHI生物标志物套件的逆模型表述和推导在Catrambone等人(2019)以及Catrambone和Messerotti Benvenuti等人(2021)的研究中有详细描述,并且在(https://it.mathworks.com/matlabcentral/fileexchange/72704-brain-heart-interactionindexes)提供了易于使用的MATLAB实现。为了计算方向性BHI指标,本研究使用了上述框架,其中包括分别分析LF和HF频段中的HRV-PSD,以及1-45Hz范围内的EEG-PSD频谱。具体而言,本研究提取了以下方向性BHI指标:CBrain→LF、CBrain→HF、CLF→Brain和CHF→Brain。这些指标反映了大脑和心脏之间的方向性影响,其中CBrain→LF和CBrain→HF分别表示大脑对LF和HF频段中HRV-PSD的影响,而CLF→Brain和CHF→Brain表示LF和HF频段中HRV-PSD对EEG-PSD的影响。
BHI-微状态推导
为了得出BHI微状态,本研究首先用BHI序列替代EEG序列来计算BHI衍生的GFP(全局场功率)地形图。这里,BHI-GFP对应于BHI的空间标准差,根据EEG-GFP定义,估计所有EEG电极数据中BHI的时间分辨量。其次,识别出BHI-GFP峰值,并使用改进的k-means算法将BHI-GFP聚类到空间原型中。BHI-微状态数量的选择基于一个元标准,该标准考虑了不同拟合度(GEV、交叉验证准则、Krzanowski-Lai准则和离散度)和算法确定的地形图的生理合理性之间的权衡。
在选择微状态原型后,将其拟合到整个BHI序列中。在此过程中,根据相似性水平将每个BHI地形样本分配给特定的微状态原型。拟合优度使用GEV进行衡量,GEV量化了新获得的微状态发生时间序列对原始GFP动力学的方差量。由于所得到序列的急剧变化可归因于生理噪声和算法噪声,为了确保连续性,本研究使用250ms的平滑窗进行平滑处理,且无重叠。
统计分析
本研究的主要目标有三个。首先,本研究旨在验证BHI微状态是否存在。其次,评估微状态技术解释BHI动态的能力。最后,本研究旨在考察交感神经激活是否会引起BHI动力学的变化。为了评估BHI微状态的存在性以及该技术捕获其动态的能力,本研究利用了逐通道BHI时间序列的GEV。该指标提供了对微状态解释整个头皮估计BHI全局方差能力的估计。此外,本研究还定性地评估了提取的微状态图的生理合理性,通常在脑电伪迹拒绝过程中进行。这些操作分别考虑了不同的HRV相关频段和BHI方向。然后,在不同刺激无变化的零假设下,每种微状态出现的次数不应发生变化。为了验证这一点,本研究对列联表进行了χ2统计检验。处理流程示意图如图1所示。
图1.计算方法示意图。
实验结果
将相同的神经系统分析框架分别应用于两个数据集。
认知负荷任务
在对认知负荷(CW)数据集进行分析后,得到了以下实验结果。数据集分析确定了每个BHI方向和频段组合的三种BHI微状态,分别为CBrain→LF、CBrain→HF、CLF→Brain和CHF→Brain,其中LF和HF分别代表HRV-PSD的低频(LF)和高频(HF)。图2显示了识别出的微状态原型的地形图,及其全局解释方差(GEV)。值得注意的是,脑-心微状态下的GEV均高于70%(即Brain→LF和Brain→HF分别约为72%和74%),这表明微状态分析可以有效解释CBrain→LF和CBrain→HF的时空动态,而反之则不成立,其中CLF→Brain和CHF→Brain的GEV均低于50%。
图2.认知负荷(CW)数据集的实验结果。
表格1详细说明了所有被试在两种实验条件(RS和CW任务)下每个微状态的发生次数,以及每个窗长的均值。图3以图形的方式显示了不同被试在两种实验条件下每个微状态的出现次数。这使我们能够验证在从RS到CW任务的转变过程中,三个BHI微状态的分布如何发生变化。在CBrain→LF情况下,第二个微状态原型在RS阶段出现频率最高,而在CW任务中与第三个微状态的频率相同。相比之下,第一个微状态在两个阶段的出现频率似乎没有显著变化。在静息态下,CBrain→HF微状态的三个原型出现频率明显不均匀,其中第三个原型频率最高,第一个原型频率最低。相比之下,在CW任务过程中,三个微状态原型的出现次数分布更均匀。具体而言,第一个微状态的出现次数大幅增加(从大约44增加到100),而第三个微状态的出现次数大幅减少(从179减少到约119)。
表1.在两种实验条件下,每个脑-心BHI微状态(即μ1、μ2、μ3)的出现次数。
图3.在CW数据集的两种实验条件下,脑-心相互作用(BHI)微状态出现次数的图形表示。
冷压试验
通过对CPT数据集的分析,实验结果表明在所有BHI方向和频段上,存在着五个BHI微状态。图4显示了识别出的微状态原型及其相关的全局解释方差(GEV)的地形图。与CW数据集一致,大脑到心脏的BHI微状态的GEV大于70%,这表明微状态分析能够解释CBrain→LF和CBrain→HF的时空动态(两个HRV频段中的GEV均约为71%)。相比之下,在CLF→Brain(约为35%)和CHF→Brain(约为37%)的GEV均小于40%。从大脑到心脏方向上(即CBrain→LF和CBrain→HF)提取的BHI微状态原型在分布上更加平滑且更符合生理分布,而从CLF→Brain和CHF→Brain提取的微状态原型则显得不够连续且混乱。这个结果揭示了BHI的时空动态,表明从大脑到心脏的方向性,具有更加合理和连续的微状态原型。CW数据集的实验结果中也观察到了这种情况。
图4.冷压试验(CPT)数据集的实验结果。
较高数量的BHI微状态使得结果的图形表示具有挑战性,因此表格表示是首选。这些实验结果在表2中进行了报告,其中汇总了所有被试在三种实验条件下,每个微状态的出现次数。在CBrain→LF方向上,第二个微状态原型在各阶段中出现频率最高。在静息态时达到峰值,随后逐渐减少,直至恢复阶段最低。相比之下,第一个微状态原型在静息期间的出现频率最低,在CPT阶段达到峰值。从相对变化的角度来看,第四个(μ4)和第五个(μ5)微状态的变化最为显著。μ5的出现次数从静息到恢复期间增加了一倍以上,而μ4在相应阶段的出现次数减少到三分之一。
表2.在三种实验条件下,每个脑-心BHI微状态(即μ1,…,μ5)的出现次数。
在CBrain→HF方向上,第三个原型在所有实验条件下的出现频率最高,但在各实验阶段中,其发生次数发生了显著变化,从静息和CPT阶段的约240次下降至恢复阶段的约180次。此外,第一、第四和第五个原型(分别为μ1、μ4、μ5)的存在受实验阶段的强烈影响。从静息到恢复阶段,μ1的出现次数几乎翻倍(从约51次增加到约96次),μ4的出现次数几乎减半(从约62次减少到约34次),而μ5的出现次数则增加了三倍(从约20次增加到约59次)。
BHI微状态的时间分布从静息态(RS)到CPT阶段再到恢复阶段发生了变化,统计分析结果发现,CBrain→LF的p值≈10-18;CBrain→HF的p值≈10-35。值得注意的是,在CPT数据集上进行的统计检验并未显示出心-脑微状态存在任何显著差异。因为它们的GEV值较低,这意味着它们无法有效地解释整体动态。因此,这些微状态的分布是随机和独立于实验阶段的。事实上,如果BHI微状态的时间分布不受实验方案引发的被试生理状态影响,那么所有微状态的发生趋势就不会改变,而且所有的微状态发生在整个实验阶段都具有几乎均匀的分布。
数据集之间的微状态比较
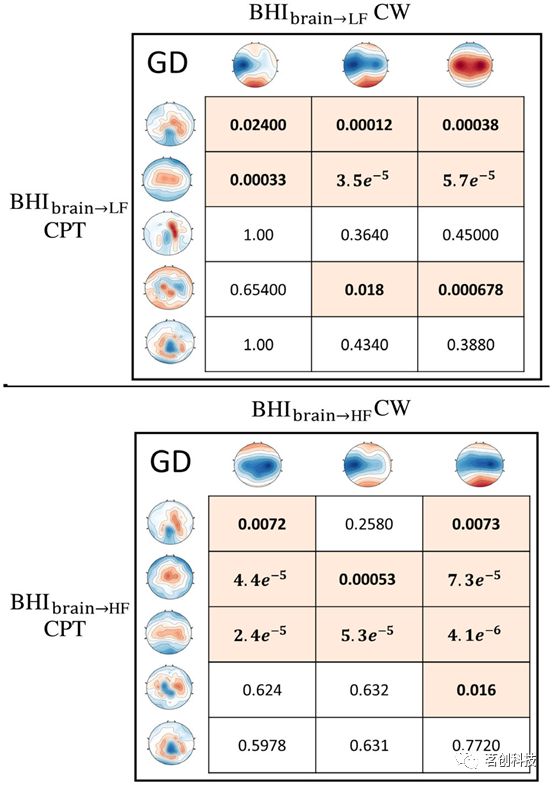
图5显示了所有微状态对之间与全局差异性(GD)相关的p值,重点关注大脑到低频(LF)和大脑到高频(HF)之间的相互作用。值得注意的是,关于大脑到LF的微状态,第一个数据集(CW)中的所有微状态与CPT数据集中的至少两个原型表现出显著的相似性。然而,CPT中的两个原型(即第三个和第五个)与CW数据集中检测到的任何微状态都没有显著的相似性。同样,在大脑到HF相互作用的背景下,所有被识别出的CW原型与CPT数据集中检测到的一些微状态呈显著的相似性,p值低至4.1e-6。然而,有一个CPT微状态与任何CW原型都不存在显著的全局相似性。
图5.在CPT数据集(行)和CW数据集(列)的静息态下,提取所有大脑到LF(上图)和大脑到HF(下图)的BHI微状态,并计算其与全局差异性(GD)相关的p值。彩色单元格和加粗文本突出显示了显著的GD(p<0.05)。
结论
本研究通过EEG序列估计的皮层动力学和ECG的心跳动力学证明了脑-心轴微状态的存在。这种神经系统微状态是一种时空准稳定状态,指的是在不同的实验条件下,脑-心输出方向以及数量和形态的变化。大多数脑-心微状态都是任务非特异性的,包括身体或精神压力。因此,定向的、下行的大脑-心脏通信不仅起源于单个区域水平,而且在功能上是全脑水平的。总体而言,本研究揭示了BHI的复杂动态特性,并强调了微状态分析作为研究大脑-心脏相互作用的有用工具的潜力。将脑电微状态扩展到身体层面可能为内感受的研究开辟新的视角。
参考文献:Catrambone, V., & Valenza, G. (2023). Microstates of the cortical brain-heart axis. Human Brain Mapping, 1-12. https://doi.org/10.1002/hbm.26480