一.替雷利珠单抗(PD-1抗体)
1)纳武利尤单抗 申请-批准上市226天(2017.11.1-2018.6.15)
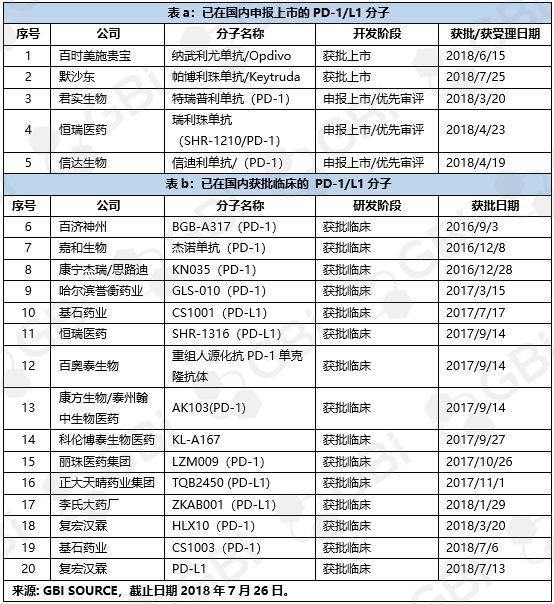
此次获批的纳武利尤单抗注射液(Nivolumab Injection,商品名Opdivo,以下简称“纳武单抗”),用于治疗表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性、既往接受过含铂方案化疗后疾病进展或不可耐受的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。这不仅意味着国内癌症治疗正式进入肿瘤免疫时代,也意味着百时美施贵宝旗下的“Opdivo”和默沙东旗下的“Keytruda”在肿瘤免疫领域的竞争,前者在中国市场占得先机
百时美施贵宝的欧迪沃(Opdivo),2018年6月15日,国家药品监督管理局在官网发布公告,国内首个以PD-1为靶点的单抗药物已经获批上市。这也意味着,被视为“抗癌神药”的PD-1抑制剂将很快为国内癌症患者所用。
2)可瑞达 申请-批准上市165天(2018.2.11-2018.7.15)
2018年2月11日,默沙东递交PD-1抗体Keytruda(中文商品名:可瑞达;通用名:帕博利珠单抗,民间俗称K药)中国上市申请(JXSS1800002)获得CDE承办受理。2018年7月25日,Keytruda正式通过中国药品监督管理局批准上市!适应症为一线治疗失败的不可切除或转移性黑色素瘤。
3)特瑞普利单抗 申请-批准上市284天(2018.3.9-2018.12.17)
2018年3月9日,君实生物发布公告称其重组人源化抗PD-1单克隆抗体注射液(JS001)于近日正式获得CFDA的新药申请受理通知书。JS001的中文名称也正式亮相,为特瑞普利单抗。据悉,此次获得受理的申请是JS001的新药上市申请,适应症为黑色素瘤。
年关将近,药物审评审批加速。千呼万唤的国产PD-1在2018年12月17日下午宣布获批上市,君实生物的特瑞普利单抗注射液卡位成功。
根据国家药品监督管理局(NMPA)公告,“有条件批准首个国产PD-1单抗——特瑞普利单抗注射液(商品名:拓益)上市。这是我国企业独立研发、具有完全自主知识产权的生物创新药品,用于治疗既往标准治疗失败后的局部进展或转移性黑色素瘤。”
君实生物的特瑞普利单抗注射液商品名为拓益,是于3月8日递交了上市申请,而到今天以优先审评方式获批,一共只经历了284天。从申报上市到获批,时间上可谓飞速,无疑值得为药监局点赞。
4)信迪单抗 2017-12-13-2018.3.27撤回/2018.4.19重新受理申请----预计2019年Q1
回顾一路走来,信迪单抗注册审批几经波折,相信信达生物也是操碎了心。2017年12月13日,对信达生物而言意义非凡,因为当天信迪单抗注射液(PD1单抗)上市申请首次获得CDE受理,适应症是霍奇金淋巴瘤,信迪单抗由此成为首个申请上市的国产PD1单抗,因为此前BMS(百时美施贵宝)的PD1单抗Nivolumab已抢先在中国提交上市申请。但3月27日,信达生物却意外传出今年2月底主动撤回PD1单抗申请,令人诧异之余也引众人猜疑,莫非信达“摊上大事”了?常言“好事不出门,坏事传千里”,一时间“信达单抗被劝退”的流言弥漫整个网路。
很快,信达生物负责人出来澄清事实,称此前主动撤回申请确有此事,但正在补充材料中一定会再次提交。直到上周,信达生物再次传来喜讯,二次提交的该单抗申请已被CDE受理(2018年4月19日)。从今年2月底撤回到4月凯旋,仅用了一个多月,信达生物就重返神坛,继续作为国人骄傲。
虽然二次递交受理的时间短暂,但是信达生物从提交临床申请到提交上市申请一共花了23个月,接近2年,而一般而言中国创新药从递交临床申报材料到拿到许可证只需18个月,所以信达生物是花了更长时间的。
至于原因,最主要可能源于PD-1/PD-L1是新型生物药,算史无前例,而信达生物又是国内首家提出本土PD-L1单抗药上市申请的企业,CDE必然态度谨慎,审核也相当严格。据悉,2018年 1月,CDE曾召开“抗PD1/PD-L1单抗申报资料要求专题研讨会”,主要就研发中的问题和申报资料的准备,通过企业、临床专家和审评团队进行讨论,从而形成该类产品的申报资料基本要求。
今年2月8日,CDE药审中心随即正式发布了《抗PD1/PD-L1单抗品种申报上市的资料数据基本要求》,文中提到,“目前全球范围内已有5个抗PD1/PD-L1单抗药物上市,其中以PD1为靶点的单克隆抗体药物包括Keytruda(Pembrolizumab)、 Opdivo(Nivolumab),以PD-L1为靶点的单克隆抗体药物包括:Tecentriq(Atezolizumab)、Bavenci(Avelumab)和Imfinzi(Durvalumab)。国内已有16个同类产品获得临床批件,并在不同瘤种中开展临床试验。但是截至目前,我国尚未有抗PD-1或PD-L1单抗药物获批上市。”
4)恒瑞医药的卡瑞利珠单抗
2018年4月23日,恒瑞PD-1单抗Camrelizumab注射液(SHR-1210)的上市申请(CXSS1800009)获得CDE承办受理。
5) 今日上午(2018年9月12日),据百济神州官方微信,公司自主研发的PD-1抗体,替雷利珠单抗tislelizumab治疗复发/难治性经典型霍奇金淋巴瘤(R/R cHL)患者的新药上市申请被国家药监局受理。据悉,百济神州这款PD-1抗体于2012年2月开始进行研发。《每日经济新闻》记者注意到,这是迄今为止第四款上市申请获得国家药监局受理的国产PD-1抗体,此前已有信达生物和君实生物的PD-1抗体等待批准上市。