Nature Metabolism I 衰老的单细胞组学研究进展及展望
单细胞组学和衰老研究的二三事
NGS系列文章包括NGS基础、转录组分析 (Nature重磅综述|关于RNA-seq你想知道的全在这)、ChIP-seq分析 (ChIP-seq基本分析流程)、单细胞测序分析 (重磅综述:三万字长文读懂单细胞RNA测序分析的最佳实践教程 (原理、代码和评述))、DNA甲基化分析、重测序分析、GEO数据挖掘(典型医学设计实验GEO数据分析 (step-by-step) - Limma差异分析、火山图、功能富集)等内容。
翻译 By 黎啸 嘉明 彦东 小望
当我们行至古稀,对着一张张老照片,回望至童年的某个午后,窗前树下阵阵蝉鸣,冰棍冒出丝丝白气,仿佛这样的夏天永远不会过去。但晃过神来才发现我们的身体已发生了万般变化。不仅肌肤上出现了道道皱纹,身体中一个又一个的细胞也都出现了衰老的痕迹。这些变化错综复杂,但它们到底是如何出现的却不得而知。而最近,单细胞组学技术的出现和发展为揭开这些谜底提供了线索。2020年4月20日,Nature Metabolism在线发表的一篇题为“Single-cell omics in ageing: a young and growing field”的文章,系统阐述了单细胞组学的现状以及发展趋势,并讨论了单细胞组学在衰老领域的应用及面临的挑战,小编在此对该文章进行了全文翻译。
摘要
随着年龄的增长,组织器官中相互关联的分子变化逐渐导致机体的衰老。在分子水平上衰老研究极其复杂,这是由于在器官内部或器官之间,在细胞内外因子的驱动下,衰老特征和动力学因素都会发生变化。新兴的单细胞组学方法可以对单个细胞进行分子和空间的剖析,探究细胞调控状态、检测细胞命运,这为揭示衰老的异质过程、探究干预衰老的方法提供了“利器”。有了基因组、表观基因组和转录组等技术的助力,结合蛋白质组学和代谢组学分析方法,单细胞技术可产生具有前所未有的细节和通量的多维集成数据。本篇综述对这一新兴领域的现状进行了概述,提出了对未来的展望,并着重讨论了单细胞方法在衰老研究中的应用价值——促进对机体衰老机制的理解、利于开发针对衰老和衰老相关疾病的干预措施等等。
正文
多种细胞类型高度而有序地组成了生物体和有机体。传统实验方法(如组织学染色)一般依据细胞的形态和位置、细胞特异分子标记的表达,以及在组织内已知或假定的功能区分细胞类型。然而,这些传统实验方法具有很大的局限性,由于特定细胞类型中已确定的分子标记通常很少,且我们不能仅仅根据一个或多个基因的表达来定义某类细胞的功能。研究者渴望以更高的分辨率来系统地研究复杂的生物学过程,因此,包括单细胞水平多维研究在内的一系列的新兴技术应运而生。自2009年首次报道单细胞转录组测序以来,这项技术得到了迅速的应用与发展,同时还出现了多种类型的单细胞分析策略,包括单细胞基因组学、单细胞转录组学、单细胞表观基因组学、单细胞蛋白质组学和单细胞代谢组学。
01
单细胞组学技术和应用
单细胞转录组测序
单细胞RNA测序(scRNA-seq)可以同时测量单个细胞内数千个基因的表达水平。该技术在很大程度上独立于细胞生物学的先验知识,它允许对组织的细胞亚型和细胞状态进行详尽、细致的描述。高效的高通量单细胞分离技术(例如Fluidigm C1平台,微滴芯片技术,微孔技术等)以及细胞特异性互补DNA文库技术的开发,使得以高分辨率来探测细胞群的多样性成为可能。单细胞转录组技术,如Drop-seq、Smart-seq、Smart-seq2、CEL-seq、MARS-seq、STRT-seq、Quartz-seq和SPLIT-seq的应用,有助于发现新的和罕见的细胞类型和亚型;复杂组织内的细胞异质性;细胞状态的存在和分布(如细胞周期)以及在健康和疾病条件下的生物学机制。
细胞图谱和细胞分类
大规模的单细胞转录组数据集为特定组织提供了详细的细胞类型目录和器官的综合转录图谱。目前若干项目正在进行,其中最值得关注的是人类细胞图谱(Human Cell Atlas,HCA),它是一个目标长远的项目,旨在通过国际合作确定所有的人类细胞类型。这个项目的目标是创建一个人类细胞的参考图谱,并将每个细胞类型的分子图谱与其形态、空间分布和功能等特征联系起来。本项目及相关项目还对不同生命阶段的细胞类型和细胞状态进行了分类,目的是通过将参考数据与从疾病患者中获得的数据进行比较,从而揭示致病机制。尤其是病变器官或组织中细胞类型组成的差异,可以从单细胞转录组数据中获取,并且已经被证明能够提供有关潜在病理机制的信息。促进或抑制特定细胞亚群生长的干预手段可作为潜在的治疗靶标(Nature 首次对阿尔茨海默病进行单细胞转录组分析|详细解读)。
伪时间和发育轨迹
单个的scRNA-seq实验可以为构建不同细胞状态的细胞图谱提供必要的数据,如细胞谱系等级、发育阶段的异质性或细胞对刺激作出反应的状态,从而促进发育轨迹的重建。这种洞察力是通过分析细胞变异和基于伪时间顺序或最近建立的内含子读取概念的计算模型获得的。计算出的细胞轨迹显示了细胞在发育过程中是如何变化的,并揭示了参与整个细胞发育进程的基因。这些方法不仅用于检测特定细胞类型的发育轨迹,而且还能用于在成年组织中甚至在整个动物中识别新的潜在祖细胞或干细胞,这在以前是无法实现的,同时也为未来的实验提供了基础(NCB|心咽发育多样化的单细胞转录轨迹分析)。
单细胞基因组测序
转录信息与基因组信息的结合,如基因组稳定性和染色质可及性,能为机制研究提供更深入的见解。单细胞基因组测序将基因组及其功能改变的研究扩展到单细胞水平。体细胞突变,包括单核苷酸变异(single-nucleotide variations,SNV)和拷贝数变异(copy-number variations,CNV),这些通常是罕见和特异的,但现在可以被如实地检测出来,揭示可能与疾病过程有关的细胞间的基因组异质性,从而提高研究器官或组织内细胞间变异的通量和精确度。
生殖细胞和体细胞突变
DNA突变可以在生殖细胞(精子细胞和卵母细胞)和体细胞中发生。最近的研究已经确定了人类单个精子细胞和卵母细胞的相关突变率,并为其构建了重组图谱。这些研究揭示了生殖细胞中存在极为丰富的基因组多样性,并有助于了解配子基因组多样性。除了生殖细胞突变外,体细胞组织的突变通常与癌症、衰老和神经退行性疾病有关。来自健康人类个体的单个神经元大部分携带有1M碱基以上的CNV,但这一结果还存在争议,而且其潜在的生物学效应目前还不清楚。在单细胞水平上记录体细胞突变的研究正在迅速开展,其产生机制以及在健康和疾病中的潜在作用,至今在很大程度上尚不清楚或未被探索。
体内谱系示踪
为了进行细胞命运追踪,通过对受关注的细胞类群进行转录组快照分析,并根据与参考细胞的相似性来推断其发育状态。然而,这些信息通常会受限于采样时间的尺度,从而不能提供跨细胞世代的长期谱系追踪信息。为了在多代之间进行长期追踪,需要进行单细胞DNA分析。利用基因组测序技术,可以检测单个细胞获得的随机体细胞突变,用于构建细胞谱系树(在线RaxML构建系统发育树)。由于体细胞突变很少见,这种方法的分辨率和灵敏度较低。通过使用CRISPR-Cas9基因编辑技术(CRISPR-CAS9发展历程小记)在基因组中引入疤痕并结合scRNA-seq技术,可以大大改善这种限制。为此,研究人员开发了一些方法来识别目标细胞中突变的快速积累,从而绘制谱系轨迹图,同时记录用于识别细胞类型的基因表达情况。
单细胞表观基因组测序
在单细胞水平上研究表观遗传调控可以让我们对单个细胞状态的多样性和细胞状态的维持过程有了更深的理解。特定单细胞DNA测序可以揭示有关DNA修饰、DNA开放性和染色质构象的表观遗传学信息,从而进一步了解表观基因组对转录组的影响。目前已经开发了多种单细胞表观基因组测序技术,例如用于测定DNA甲基化的单细胞亚硫酸氢盐测序技术、用于测定组蛋白修饰和蛋白质-DNA相互作用的单细胞染色质免疫沉淀测序技术以及用于测定染色质开放性和染色质构象的单细胞ATAC和Hi-C测序技术。这些技术已经和单细胞转录组学相结合来研究基因调控系统和细胞异质性。例如,单细胞亚硫酸氢盐测序技术已被用于揭示肝细胞之间DNA修饰状态的异质性。最近,新建立的方法可以用来记录同一细胞内的转录组和染色质开放性,从而能够研究这两个特征之间的功能关系。
表观遗传修饰和转录之间的调控联系的强度在不同的发育阶段和不同的细胞类型之间也可能存在差异,但在目前的研究中这些差异很大程度上尚不清楚。这些单细胞组学技术的应用使我们能够在生理和病理状态下更深入地了解表观遗传因子对基因表达的调控。
单细胞蛋白质组学
单细胞蛋白质组学主要基于荧光流式细胞分析和分选技术的应用,以对细胞表型进行分类和鉴定。测量表面标记蛋白可以在单细胞水平上分析至少几种功能蛋白。荧光流式细胞分析和分选技术是单细胞蛋白质组学的主要方法,允许较高水平的多重标记。通过与光散射相关的参数(例如前向散射和侧向散射)区分细胞大小,而与用荧光抗体标记的不同膜蛋白相关的其他参数相结合可以提供细胞类型(尤其是免疫细胞)的分类。
尽管目前用于单细胞蛋白质组学的方法尚不成熟,但最近开发的质谱分析技术在单细胞水平上可以将测量范围扩展到多达34个参数。该方法实现了质谱流式细胞技术与能够结合细胞内外不同表位的抗体一起使用。将单细胞液滴喷入感应耦合的氩等离子体中,可以同时测量每个细胞的34个参数。这种方法在单细胞水平上实现了对详细的细胞表型进行深入的蛋白质组学分析,从而为复杂异质性器官提供细胞类型特异性的信号传导信息。
另一种用于单细胞蛋白质组学的高通量测序方法是使用质谱(SCoPE-MS)来克服两个挑战:以最小的蛋白损失将蛋白质组递送到质谱仪,以及同时鉴定和定量单个细胞中的肽段。这项技术可以检测出单个细胞中1000多种蛋白质。其他检测细胞蛋白的方法是使用与DNA条形码结合的抗体,该抗体在改良的单细胞转录组方法中可以与单细胞转录组一起进行测量。通过这些精巧且可重复的实验方法,单细胞转录组测序可以提供准确的蛋白质定量。
单细胞代谢组学
单细胞代谢组学的目的是阐明具有异质性的组织的代谢组学,揭示代谢谱改变的细胞类型。这种方法具有极大的挑战性,因为质谱方法不适用于鉴定半衰期短的生物分子,而且这些生物分子在体外时化学性质很不稳定。虽然目前的单细胞代谢组学技术尚处于起步阶段,存在灵敏度极低且技术噪音大等缺点,但随着质谱分析方法的不断扩展和完善,已经能够检测出存在于单个单细胞中的少量代谢物。如果这些方法能够成功地与实验相结合,或者与表观遗传测量的数据相结合,将有望解决目前关于小分子、代谢物和相关信号事件如何在单细胞水平改变表观遗传特征进而改变转录组特征的难题。
02
单细胞组学在衰老研究中的应用
衰老是一个异质性的过程,在这个过程中,单个细胞的紊乱表现出不同程度地增加,从而导致器官和组织功能逐渐下降。研究衰老相关的细胞和分子特征将有助于深入了解复杂的衰老过程的细节,并揭示导致衰老的因素。为了实现这一目标,已经通过使用混合细胞群或使用已知标记物富集的细胞群在模式生物和人类的细胞水平上进行了研究,这两种方式都可能随年龄而变化。
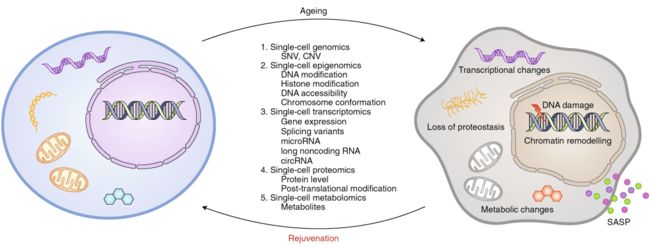
衰老的表型(1)在组织之间和组织内部是异质的;(2)在多个分子水平的调控下涉及不同的过程,例如表观遗传、转录、翻译、翻译后修饰或代谢调控;(3)可能是由一群空间位置和功能受限的特殊的、罕见的细胞引起的;(4)衰老的细胞中小而特殊的亚群积累,这些亚群占据关键生态位并分泌衰老相关的分泌表型因子,从而导致衰老。因此,尽管许多研究表明,各种基因和表达模式会随着年龄的增长而不断变化,但与年龄相关的变化是普遍且均匀地分布在整个组织中,还是局限于特定组织或由特定的细胞类型所驱动?目前仍不清楚。上述单细胞组学技术的发展为回答以下问题奠定了基础,有望加强对衰老器官中细胞异质性和分子变化的理解(图1)。
图1 研究机体衰老的单细胞平台。衰老的特点是细胞功能会随时间的推移而丧失。这种变化是复杂和异质的,因为它对不同的器官和细胞类型有着不同的影响。例如,细胞形态的改变、基因表达的控制、RNA的表达及其变化,以及蛋白质的聚合和代谢组的重构都是导致衰老的原因。单细胞组学平台为单个细胞研究提供了详细而全面的分子图像,这在衰老研究中会特别有趣。目前的技术可以用于在衰老或衰老干预过程中对基因组、转录组、表观基因组、蛋白质组和代谢组的研究。其中,可鉴定的分子因素包括体细胞突变、基因转录水平、DNA修饰、蛋白质-DNA相互作用、染色质开放性、染色质构象、蛋白质水平及其翻译后修饰和代谢变化。SASP,衰老相关分泌表型。
在以下各节中,我们将介绍单细胞测序数据分析中涉及的核心概念,它们在当前和将来的应用以及在衰老领域中的潜在重要性。这些应用已经促进了对一些最脆弱器官(例如脑、骨髓、胰腺和肺)的衰老过程的理解(表1)。最新的结果证明了单细胞技术的变革潜力,尤其是对于目前组织老化必然过程的研究和临床干预。
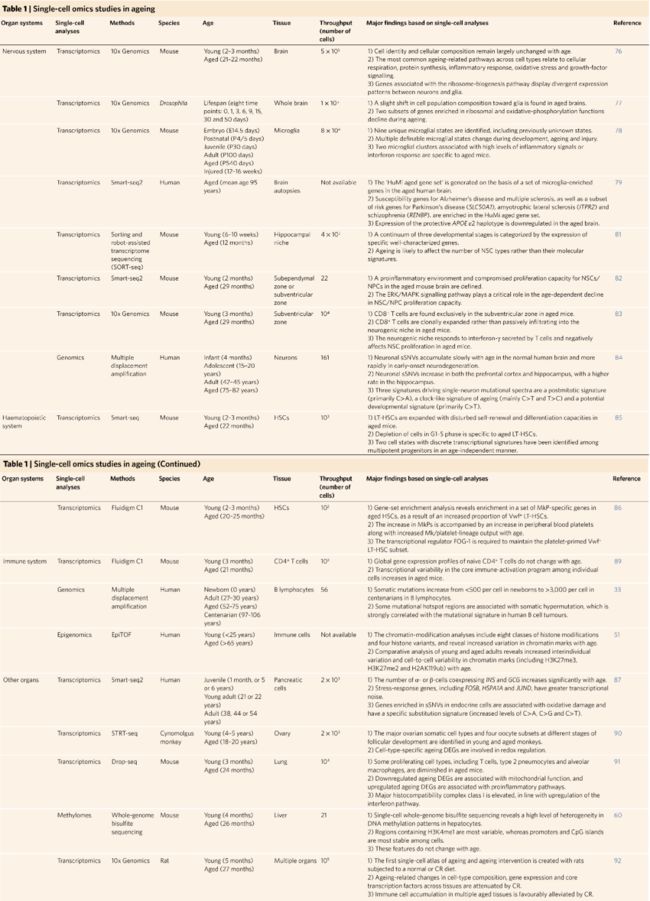
表1 衰老相关的单细胞组学研究
神经系统
大脑依靠特化的神经元、胶质细胞和内皮细胞整合的网络来执行正常功能。衰老小鼠大脑的单细胞转录组学研究表明,随着年龄的增长,细胞类型和细胞组成基本保持不变。跨细胞类型中最常见的衰老相关途径涉及细胞呼吸、蛋白质合成、炎症反应、氧化应激和生长因子信号传导,而核糖体的生物合成途径在神经元和神经胶质细胞之间表现出不同的模式。在衰老的大脑中,与衰老相关的小胶质细胞的变化导致慢性炎症的增加。果蝇和小鼠大脑的单细胞分析显示,衰老大脑中细胞组成出现了向小胶质细胞的轻微转移。这些细胞发生的变化会增强衰老过程中的慢性炎症,并与衰老相关的神经退行性疾病的发病机制密切相关。小鼠中已经鉴定出一些独特的小胶质细胞状态,包括以前未知的细胞状态。该分析表明,在衰老过程中,多个可鉴定的小胶质细胞的状态发生了变化。两群高表达炎症信号(Lgals3、Cst7、Ccl4、Ccl3和Il1b)或上调的干扰素反应基因(Ifitm3、Rtp4和Oasl2)的小胶质细胞群是老年小鼠特有的。此外,从人类老年小胶质细胞的转录组中发现了与帕金森病(SLC50A1)、肌萎缩性脊髓侧索硬化症(ITPR2)和精神分裂症(RENBP)相关的部分风险基因,这些基因是老年小胶质细胞特征的一部分。
老年个体中神经生发的程度是另一个广泛研究和有争议的焦点。从小鼠齿状回中分离出的非神经元的单细胞分析揭示了神经干细胞(neural stem cells,NSCs)的三个发育阶段,按特定基因的表达可以进行分类。例如,Neurod1,Sox11和Dcx标记晚期祖细胞,而Ccnd2,Mki67,Pcna和Mcm2对早期祖细胞具有特异性。此外,分析表明,衰老更有可能影响NSC类型的数量,而不是其分子特征。另一项类似的研究发现在老年小鼠的大脑中存在促炎的微环境,NSCs和神经元祖细胞(neuronal progenitor cells, NPCs)的增殖能力下降。第三项关于衰老神经生发区域的scRNA-seq研究发现,CD8+ T细胞只存在于老年小鼠的室下区,这是由于CD8+ T原位克隆扩增而非被动浸润所致。随后,神经生发区域响应T细胞分泌的干扰素-γ,从而负调控老年小鼠中NSC的增殖。
体细胞DNA突变的积累被认为是衰老的原因之一。一项有关的研究使用单细胞水平的全基因组测序揭示人前额叶皮层和海马神经元DNA中的全基因组体细胞单碱基变异(sSNVs:somatic single-nucleotide variants)。sSNVs在正常人脑中随着年龄的增长而缓慢积累,而在早期发作的神经退行性疾病中由于DNA修复中的基因破坏而迅速积累。因此,随着年龄的增长,体细胞突变的积累已被证明是一种与年龄和疾病相关的分子特征,目前可在此基础上通过实验推断其功能。
造血系统
在衰老过程中,造血干细胞的再生潜能显著下降。scRNA-seq研究发现,在衰老过程中,无论是在骨髓中还是在干细胞腔室中,长时程造血干细胞(LT-HSCs)都有显著的扩增。与此相反,所属Lin- Sca1+ cKit+细胞的短时程造血干细胞数量未见改变,而多能祖细胞则随年龄增长而减少。scRNA-seq分析揭示了G1-S期的LT-HSCs特异性耗竭。此外,在衰老过程中还发现了LT-HSCs特异性的差异表达基因(DEGs),并观察到一致的自我更新和分化的扰乱作用。
对来自小鼠的Lin– Sca1+ cKit+类群的另一项scRNA-seq分析表明,年轻和老年的HSCs在衰老过程中具有大量的差异基因。通过对这些数据的基因集富集分析,发现了在老年造血干细胞中巨核细胞祖细胞(megakaryocyte progenitor cell,MkP)特异性基因的表达,这是Vwf+ LT-HSCs比例增加导致的。Vwf+ LT-HSCs代表血小板致敏细胞,对应于老年HSCs中髓样基因的上调。与该发现一致的是,已发现MkPs数量的增加伴随着衰老小鼠外周血血小板的增加。此外,转录调节因子FOG-1已被发现与血小板前体细胞偏倚有关。对该数据集中的年轻和老年造血干细胞的scRNA-seq分析发现,在衰老过程中,一类新的造血干细胞的增加以及造血干细胞向髓系分化的分子启动可能导致与衰老相关的淋巴细胞生成损伤。衰老过程中HSCs的变化无法被其他方法详细阐述,因此这也证明了scRNA-seq的强大功能。
免疫系统
除细胞类型的改变之外,导致衰老的细胞和生理功能的渐行性衰退还伴随着组织特异的基因表达改变和转录噪音的升高,转录噪音指同种细胞类型中基因表达的可变性。通过对年老小鼠的CD4+ T细胞进行scRNA-seq分析,已经有研究发现,免疫激活后对转录事件的紧密调控将会随衰老而部分丢失,从而造成同种细胞类型中可变性增强,进而导致CD4+ T细胞的不同亚型之间免疫应答的受损。一项单细胞基因组分析研究表明,从新生儿到百岁老人,每个B淋巴细胞的体细胞突变数从不到500次增加到了3,000次以上。这种现象表明,B淋巴细胞中这种随衰老而积累的体细胞突变会导致老年个体B细胞功能衰退和患白血病风险的增加。这些研究一致说明衰老会导致体细胞突变的积累,从而在一定程度上增加衰老相关疾病的风险和细胞、器官功能的衰退,而这只有通过单细胞测序才得以被证实。除了转录噪音和体细胞突变之外,该研究还通过质谱流式细胞技术(EpiTOF),在单细胞水平对22种主要的免疫细胞亚型的染色质修饰信息进行了解析,得到了信息丰富的单细胞表观图谱。这些信息表明,随着衰老的进行,个体或细胞之间的染色质修饰的可变性会逐渐增加,暗示这样的变化可能与年老导致的转录调控丢失有关。
其他器官
除了前文所述,单细胞技术也应用于其他器官的衰老研究。一项对人类胰腺的scRNA-seq研究为在单细胞水平探究衰老过程中转录噪音变化提供了框架。这项结果揭示了年老个体中的转录不稳定性和细胞命运的转变,表明调控这些变化的机制很有可能参与糖尿病的病理过程。除此之外,SNV分析说明了衰老过程中的细胞类型特异的体细胞突变。尤其是在内分泌细胞中,与氧化损伤相关的基因上发生了一种特定的碱基替换。诸如此类的研究还有在心肌细胞中观察到了随衰老而增加的转录噪音。
最近一项研究建立了灵长类卵巢衰老的单细胞转录组图谱,通过单细胞转录组测序技术,共鉴定出了7种卵巢的细胞类型,其中包括了4种不同的连续发育阶段的卵母细胞类型,经鉴定,这些细胞类型在食蟹猴中具有截然不同的基因表达特征。这项研究在单细胞水平为灵长类卵巢衰老提供了综合性的理解。通过对单细胞数据进行深入的生物信息学分析和在人类卵巢颗粒细胞中的实验验证,抗氧化信号的扰乱被认为是灵长类卵巢衰老的一个主要特征。除此之外,该研究还鉴定出参与氧化还原调节的基因作为可能的诊断生物标志物和对抗衰老相关人类卵巢功能失调的潜在治疗靶标。
通过Drop-seq技术,一项研究鉴定出年轻和年老小鼠的肺脏之间具有相似的细胞比例组成,与此同时研究人员还发现了伴随衰老发生的增殖能力下降和转录噪音升高。通过对这些数据的分析,并且结合蛋白组数据集,研究人员鉴定出了包括线粒体功能相关因子下调和促炎通路上调在内的肺衰老标志。通过全基因组亚硫酸氢盐测序而建立单细胞DNA甲基化组信息,研究人员在肝脏中揭示了肝细胞的高度异质性:其中含有K4甲基化的H3组蛋白(H3K4me1)的区域最为多变,而启动子和CpG岛区域则最为稳定。另外,5-甲基胞嘧啶异质性通常与基因组特点和所推断的非功能位点相关(通常包括重复元件和内含子),这些位点更易变化,但可能是真正具有功能的位点。这些特点在年轻和年老个体间未见明显的区别。
衰老干预的单细胞图谱
卡路里限制(calories restriction,CR)已在多个物种中被证实可以有效延缓衰老,但是其中的组织和细胞特异的分子机制仍不清楚。近期,一项研究建立了首个衰老和从中年期开始节食9个月(70%卡路里限制饮食)的大鼠的多组织单细胞转录组图谱。在对来自9个组织的超过200,000个细胞和细胞核转录组分析的基础上,研究人员建立了衰老和CR大鼠的多组织单细胞转录组图谱。该研究从多个层面对衰老和CR对不同组织和细胞的影响进行了系统的研究,其中包括了细胞类型组成、基因表达、核心转录调控网络和细胞间相互作用。炎症应答增加被认为是一个跨组织的衰老标志,并且可以被CR逆转。除此之外,一些潜在的衰老与CR生物学标志物和分子变化也得到了揭示(吃多一时爽,吃少活更长!)。
上述的这些研究展示了单细胞组学手段能够在没有相关信息的前提下,从多个维度上对器官衰老调节过程提供新的理解,如果仅仅通过对整个组织进行研究是很难甚至不可能实现的。细胞类型变化和细胞类型特异的转录组变化(如转录噪音增加)的发现尤其为衰老研究新的方向提供了宝贵的提示。
03
现存局限性
在过去的十年间,单细胞技术推动生物学研究进入了一个在前所未有的分辨率水平上探究细胞和分子表型的新时代。这一进展主要得益于高通量技术革新式的进步和新型计算工具的研发,这使我们能够在没有相关信息的前提下同时捕捉成千上万个单细胞的基因组、转录组、蛋白组和代谢状态等多维信息。这一进步标志着传统单细胞实验(如显微镜)质的飞越。有了这些新兴技术,我们可以对细胞类型、细胞状态以及单个细胞对外界刺激或内在生物学过程的应答进行研究。尽管如此,在将这些技术应用到衰老研究的过程中,仍然需要克服一些实验技术或生物信息学的挑战。
实验技术局限性
单细胞组学手段的第一步是从高度异质的组织中分离单个细胞。其中一个主要的局限性是在组织分离的过程中很可能在一定程度上改变细胞的基因表达并剥脱细胞表面的部分蛋白质。例如,压力相关基因可能在这个过程中被促进表达。相应的,为了最小化在制备单细胞悬液过程中造成的转录变化,新的实验方案也正在研发当中。
另一个问题是所捕捉的细胞是否真实体现其在体内的存在状态。例如在大脑研究中,神经元要比胶质细胞更容易在组织分离过程中丢失,而这种丢失可能改变相应的细胞类型组成。对于那些难以制成单细胞悬液的细胞类型(如神经元和心肌细胞),能够从冷冻组织中提取单个细胞的细胞核分析已成为一个有效的替代手段。单核手段能够减少在分离单细胞过程中因剧烈处理造成的相应细胞类型的丢失和基因表达的变化。然而这一优点是以降低转录组覆盖度为代价的,因为细胞核中的RNA要比整个细胞中的丰度更低。
除此之外,大部分scRNA-seq平台都是通过利用5’或3’引物来捕捉RNA,这样会导致microRNA和非多腺苷酸化RNA的丢失(如长非编码RNA、组蛋白mRNA或环状RNA)。目前为止,少数针对小RNA、环状RNA和microRNA的单细胞研究已被报道,尽管其分辨率都较低。这些因素都有可能在衰老过程中起到重要调控作用,因此,亟需新的实验方法来对其进行检测。
在保留组织空间信息的前提下,同时进行综合的分子图谱分析也十分重要。尽管基于荧光原位杂交的方法可以直接在一个组织中同时标记多个转录本,但利用该方法在单细胞水平上对整个转录组和蛋白组的探究仍被成像范围和分辨率所局限。目前几个新的技术已被提出:位置信息测序(Geo-seq)将激光捕捉分离技术和scRNA-seq相整合,实现了精确的空间转录信息的捕捉;Slide-seq则通过另一种策略来得到相应的空间信息,它给予组织不同定位的细胞以特定的标签信息,以此在接近单细胞分辨率的水平上同时对空间信息和转录组信息进行获取。
来自不同平台的单细胞测序技术仍存在诸多局限性,如转录覆盖度、测序覆盖度、较低的细胞捕捉效率等技术差异和昂贵的测序费用,这些问题仍有待克服。因此,我们需要综合考虑技术特点和优势、检测的细胞数以及相应的费用等因素,来选取合适的单细胞测序策略。这些考虑对于支撑假设驱动的、精心设计的研究十分重要。
生物信息学挑战
大规模的生物学数据分析需要强大的计算能力。目前所存在的一个重要挑战是分析具有不同分辨率、敏感性和可变性的,来自不同单细胞平台甚至不同物种的数据,这使得我们很难跨技术来建立综合的数据库。尽管已有研究人员对这一问题发起了挑战,更加可靠的计算分析手段仍是亟需的。只有解决了数据整合的问题,诸如来自NIH人类生物分子图谱(HuBMAP联合)和欧洲寿命倡议计划(https://lifetime-fetflagship.eu)的数据资源才能够被充分利用。
另一挑战则是扩展单细胞组学,实现高精度、高效率地系统并综合性分析目前可测到的生物分子,包括代谢物、蛋白质(及其修饰)和核酸(及其修饰)。这些分子层面的信息都是从独立的实验中和不同的单个细胞中获取,使得这样的整合变得困难。目前研究人员已经向解决这一难题跨出了第一步,如单细胞染色质全基因组景观测序(scCOOL-seq)、单细胞核小体和甲基化组测序(scNOMe-seq)和单细胞核小体、甲基化和转录测序(scNMT-seq)已经逐渐实现了避免单独基于转录组的根据计算模型进行的数据整合,同时提供了来自同一细胞的多个层面的数据信息。
04
衰老领域单细胞组学的新趋势
单细胞组学技术固然有其局限性,但它在许多方面可以为我们提供衰老和衰老相关疾病机制的新见解。
单细胞技术和整体组织分析相比有着更高的分辨率,可以识别表达水平有限或在较少细胞类型中变化的衰老相关基因。还可以检测细胞类型特异的衰老特征(如干细胞衰竭)以及某些类型细胞随着年龄增长而发生的常见变化(如表观遗传学改变),而这些都是传统的整体分析无法完成的。
单细胞组学的高分辨率使得细胞群转移和细胞状态的变化可以被检测到,包括在整体测序分析中经常被忽视的某一细胞群的减少或增加。此外,细胞在衰老过程中可能会出现新的特征,但传统的整体测序或流式细胞分析一般都无法识别这些特征。所有这些优点对于剖析细胞内在的、局部的和系统的因素在衰老过程中的作用极为重要。
一部分以前被认为是细胞类型特异性标记的基因,实际上可能是细胞类型特异的衰老特征,这需要用单细胞方法进一步研究。
在细胞类型高异质性的衰老组织和器官中,整体分析无法分辨其中的细胞类型特异的基因调控,而全转录组范围的scRNA-seq则在单细胞分辨率下更清晰地呈现了异质情况。
单细胞测序可以检测到年龄相关的基因组DNA突变的增加、特定细胞类型染色质结构的改变以及衰老过程中的转录噪音。
通过对多器官的细胞图谱分析,可以阐明器官间共同的以及特异性的衰老特征。
将单细胞组学数据与组织内细胞的空间定位相结合,可以更全面地了解衰老过程中的分子和细胞特征,为衰老提供新信息,如衰老过程中免疫细胞在器官间的浸润形式 (图2)。
单细胞组学、基因编辑、干细胞技术和生物信息学的结合会生成在单细胞分辨率下的、衰老相关生理和病理变化的、多层次的参考图谱。衰老会改变诸多基因的表达,这些变化究竟是衰老的结果还是驱动因素?是生物正交效应的作用,还是偶然产生的?这里讨论的单细胞组学方法对后续的研究起着至关重要的作用。其中,单细胞组学和功能基因组学相结合,利用快速单基因和高通量方法来评估衰老可能是一种解决方案。
图2 构建全面且综合的人类衰老图谱。衰老过程中,各种器官都表现出功能衰退。人类衰老单细胞图谱在保持单细胞分辨率的同时整合多个器官和不同生物学水平的信息,将为衰老过程提供前所未有的详细信息,并揭示治疗和干预的潜在途径。
结论与展望
衰老是众多慢性疾病的最大危险因素,包括神经退行性疾病、心血管疾病和糖尿病。想要有效地干预衰老及衰老相关疾病,需要回答许多问题,如:在单细胞水平上衰老如何影响器官的组成?在衰老过程中调节基因表达的因素有哪些?如何确定衰老的“真正”驱动因素?如今,单细胞组学技术对衰老的研究还处于起步阶段,多维和系统化的人类衰老单细胞图谱可以从根本上提高对老年健康和患病情况的理解,并促进精准干预衰老和衰老相关疾病的发展。
原文链接:https://www.nature.com/articles/s42255-020-0196-7
你可能还想看
重磅综述:三万字长文读懂单细胞RNA测序分析的最佳实践教程 (原理、代码和评述)
如何使用Bioconductor进行单细胞分析?
对一篇单细胞RNA综述的评述:细胞和基因质控参数的选择
NBT|45种单细胞轨迹推断方法比较,110个实际数据集和229个合成数据集
Nature系列 整合单细胞转录组学和质谱流式确定类风湿性关节炎滑膜组织中的炎症细胞状态 详细解读
往期精品(点击图片直达文字对应教程)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
后台回复“生信宝典福利第一波”获取教程合集
![]()
![]()
![]()