- 原文: Isolation of Uncultured Bacteria from Antarctica Using Long Incubation Periods and Low Nutritional Media
- 作者:Andre A. Pulschen
- 杂志: Frontiers in Microbiology, 2017; 8: 1346.
- DOI:
摘要
- 未培养的微生物构成了我们星球上存在的大多数微生物多样性。 尽管环境测序和单细胞基因组学取得了进步,但有关细菌代谢和新型生物产物筛选的深入研究只能通过在实验室中培养微生物来评估。 在这里,我们报告了使用相对简单的方法从南极土壤样品中分离出的未培养的或顽固的微生物:寡营养培养基,延长的潜伏期,在立体显微镜下观察以及选择生长缓慢的细菌。 我们设法分离了属于罕见分离或最近才被描述的属的几种稀有微生物,例如乳杆菌,Flavitalea,Quadrisphaera,Motilibacter 和Polymorphobacter。
- 此外,我们获得了与其他任何已知培养物种呈现16S rRNA序列相似性从92.08到94.46%的分离株,包括两种嗜热嗜热菌分离株,尽管它们在南极土壤中很常见(通过宏基因组学鉴定),但从未报道过有从此类样品中分离出来。 我们的数据表明,即使处理来自极端环境的样品,简单的方法仍可用于培养顽固的微生物。
- 关键词:未培养的,南极洲,单核细菌,嗜热菌,缓慢生长的细菌
引言
- 考虑到所有生物都应能够生长和分裂,因此能够生长,大多数环境微生物仍被归为不可培养类(Hug等,2016),或使用最佳定义在适当的条件下“尚待培养”。 实验室中大多数现有微生物无法生长的原因各不相同。 其中一些很简单,例如使用错误的pH值,培养时间不足 或使用极端的营养品,无法补充正确的营养素。营养丰富的培养基(有利于快速生长的细胞,可以使慢速微生物过度生长)。有些更为复杂,例如需要特定的生长信号,对其他微生物的依赖来生长为小菌落 。
- 有许多原因证明了人们对培养“无法培养”的生物的兴趣。 确定生长偏好,消耗或生产环境代谢物(参与营养循环),生理特性(细胞大小,形态,色素沉着,运动性等)和毒力特性等特征只能通过在实验室条件下培养细胞才能被研究 。 此外,顽固性微生物的生长具有生物技术应用的潜力,例如,最近发现的能够降解环境污染物聚对苯二甲酸乙二醇酯的细菌或发现了由先前未描述的属的细菌产生的新型抗生素类teixobactin。 最后,诸如抵抗环境挑战(例如辐射,干燥,极低或极高的温度)之类的功能也需要对微生物隔离进行适当的研究。这样的研究不仅对于提高我们对微生物生理学的认识,而且对于提高我们对生命极限的认识都很重要,这是天体生物学非常感兴趣的一个话题。
- 为了评估和生长顽强的微生物,已经开发了几种技术和方法。 最著名的技术之一是使用扩散室(diffusion chambers),该技术可使营养物质和代谢产物从环境中流到室内的被捕集的微生物,从而达到对扩散室的某些细胞的生长的特殊要求。iCHIP方法(隔离芯片)是一种优化扩散室原理的类似技术,已被用于隔离多种新型细菌。 全基因组测序可用于基于基因组DNA中存在的代谢信息开发分离策略 。
- 元转录组学分析也已用于指导顽固细菌的培养。然而,许多这样的技术是费时的和/或意味着高成本。检索难以培养的微生物的其他一些技术要简单得多,例如选择不同的固化剂,孵育时间更长,在低营养培养基中生长以及培养基成分的单独制备。**地球上大多数生物圈(超过80%)始终处于低温状态,温度低于5°C。由于其对于提高我们对低温下生命如何life壮成长的认识以及我们对它们如何影响全球化学循环的理解具有生物技术的潜力,因此对冷适应微生物的研究非常重要。在这样的寒冷环境中,南极洲是世界上最大的沙漠,这种环境具有产生微生物的潜力,可以极大地改善我们对在如此严酷条件下的生活状况的了解,并且可以被认为是像火星等外星环境的良好模拟。
- 在这里我们报告了使用简单技术的组合从南极土壤样品中分离未培养微生物的方法。在低温(12°C)下延长孵育时间(15周)后,在用Gellan胶固化的稀释的Nutrient Broth培养基上选择生长缓慢的细菌。在立体显微镜下观察分离板上的细菌菌落,并选择仅在温育4周后才出现的菌落,以仅获得生长缓慢的细菌。根据菌落的形态特征选择菌落,避免在平板上同时生长的相似菌落。
材料和方法 ·
- 样品采集
2014年12月29日,在巴西第三十三届南极行动(2014/2015)期间,在南极国王乔治岛金钟湾的Hennequin Point采集了样本(图11)。采样点的特定坐标是62°07.112′S,58°23.199′W,高度155 m。样品收集期间的温度为约0℃。 使用火焰消毒工具收集20至50克土壤,将其存储在密封在“ Whirl-Pak”袋(美国,Nasco)中的无菌管中,并在运输过程中保持在-20°C直至到达实验室。
图1 南极乔治岛国王岛的采样地点
菌株分离程序:
- 所有对污染敏感的操作步骤均在层流罩内进行。 为了分离微生物,将2 g土壤悬浮在10 mL无菌0.9%(w / v)NaCl溶液中并涡旋30 s。 将上清液进行连续稀释(10-1至10-6),并分散在1/100稀释(0.08 g /升)的Difco Nutrient Broth – NB(美国Becton Dickinson)板上(1/100 NB),使用0.7%(w / v)吉兰糖胶固化,并添加MgSO4·7H2O(0.1%w / v)作为二价阳离子以促进固化; 每种稀释液准备8-10个板。 然后将平板在没有光照的情况下于12°C孵育15周。 为避免干燥,将板在聚乙烯袋中孵育。
- 每周在体视显微镜下观察菌落形成(放大40倍),并在出现新菌落时对其进行标记。 通过仅选择温育4周后出现的菌落来进行分离株的选择。 根据菌落的形态特征选择菌落,因此避免选择在平板上同时发育的相似菌落。 为了分离,将选择的菌落在新的1/100 NB平板上划线。 分离后,将细胞分别在1/100 NB平板,1/10 NB平板(稀释10倍)和Difco Reasoner的2A琼脂– R2A(美国Becton Dickinson)上划线,以评估生长偏好。 只要有可能,细胞就可以在液体1/100 NB,1/10 NB或R2A肉汤中生长,以产生用于冷冻备料的生物质。 但是,许多分离株在液体培养基上发育不良。 在这些情况下,从培养皿中的菌落中收集生物质。 用30%v / v甘油制备原料并保持在-80℃。 补充表1中列出了所有分离株。
DNA提取和16S测序
- 使用PureLink基因组DNA迷你试剂盒(美国Invitrogen)提取基因组DNA。扩增16S rRNA基因(在98°C初始变性步骤5分钟,然后在95°C 30 s进行30个循环,在50°C 30 s和72°C进行2分钟的变性,然后在72°C进行最终步骤 ·使用通用引物27F和1401R(°C持续3分钟),使用GeneJet PCR纯化试剂盒(美国Thermo Scientific)纯化,并使用BigDye终止剂试剂盒(美国Applied Biosystems),使用27F,1401R和518uF引物进行测序。通过使用Abi Prism 3130xl遗传分析仪(美国Applied Biosystems)的Sanger测序获得序列。 获得了接近完整的16S rRNA序列(1400个碱基对)。 序列以访问代码(KX990222.1至KX990262.1)存放在Genbank中。 使用MEGA6(Tamura et al。,2013)构建系统进化树,使用Muscle进行序列比对,并使用最大似然测试(500个引导程序)获得树估计值。 对于序列获取和分析,使用EzTaxon来获得包括类型材料序列(所描述的物种)。对于环境细菌和培养细菌(非类型材料序列),使用了 Megablast(Genbank)。 除了EzTaxon和NCBI数据库之外,我们的分离株的序列也使用Silva数据库项目进行了分析(Quast等,2013)。
荧光显微镜成像
- 对于荧光显微镜成像,直接从板上收集细胞,并将其悬浮于50μl无菌0.9%(w / v)NaCl溶液中。 对于细胞膜染色,使用荧光染料FM1-43(美国Invitrogen),终浓度为50μg.mL-1。 对于DNA染色,染料DAPI(Thermo Fisher,美国)的最终浓度为15μg.mL-1。 对于图像,将细胞置于琼脂垫上(用1.5%w / v琼脂糖固化的0.9%(w / v)NaCl溶液),并在配备有Plan APO VC Nikon 100的Nikon Eclipse TiE显微镜(日本尼康)上观察 ·×物镜(NA = 1.4),25毫米SmartShutter和Andor EMCCD i-Xon相机。
拉曼光谱和颜料表征
- 为了评估色素,使用带有激光线(532 nm),50倍物镜和CCD检测器的雷尼绍(Renishaw PLC,Renishaw PLC,Wotton-under-Edge,英国)inVia微型拉曼光谱仪通过拉曼光谱分析了分离物。 ·带有三重单色仪,457 nm激光线,100倍物镜和CCD检测器的Horiba-Jobin-Yvon显微拉曼光谱仪。 ·通过从板中去除菌落并将其沉积在载玻片上,无需进一步样品制备即可对分离物进行分析。 ·对于Aphanothece stagnina和Salinarum Salonrum NRC-1光谱,从液体生长(Aphanothece的BG11培养基和Halobacterium的ATCC 217培养基)中以5000×g离心2分钟,收集细胞,弃去上清液,并将沉淀沉淀在玻璃上 ·幻灯片。 低激光功率被用来避免热或光化学损伤。 使用软件Fityk(Wojdyr,2010)分析获得的光谱,并在峰拟合后估算峰位置。
结果与讨论
- 在培养的前8周中分离出属于稀有或最近描述的属的微生物我们的分离程序主要针对耐寒,生长缓慢的微生物。考虑到这一点,我们将精力集中在在12°C下孵育4周后在稀释培养基板上培养的菌落上。由于我们的目的不是对样品进行生态或丰度表征,因此对这项快速增长的细菌群落的研究并未得到深入研究。以相同的方式,我们没有收集出现在平板上的所有缓慢生长的菌落,因为在相同的孵育时间后观察到了几种相似的缓慢生长的形态型。但是,我们观察到,在开始的几周内,大多数细菌的生长都属于节杆菌和鞘氨醇单胞菌属(通过16S rRNA测序推断)(数据未显示),以及在视觉上看似是真菌和酵母菌的几个菌落在显微镜下观察证实。
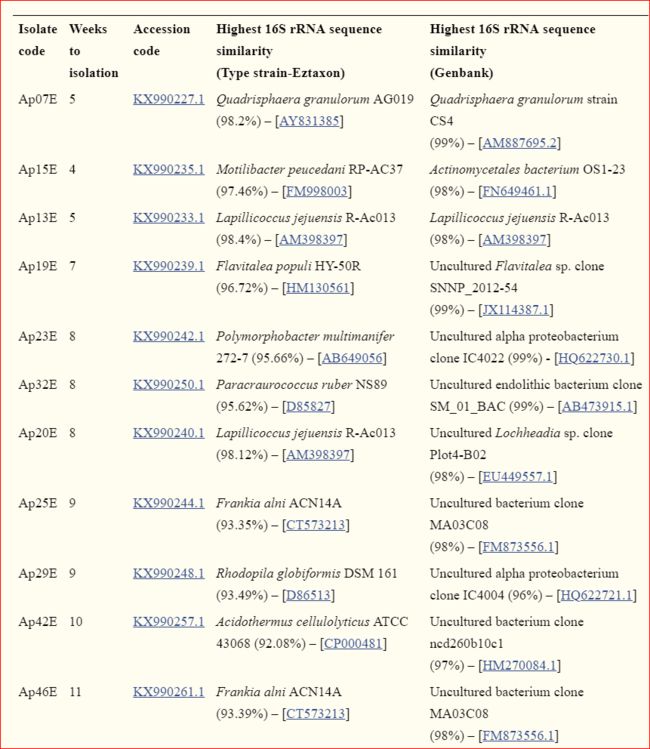
- 最终,我们选择了41种在形态上不同的细菌菌落,这些菌落在孵育4-14周的时间内生长(补充表1)。 ·考虑到我们生长缓慢的分离株中最热门的16S rRNA序列匹配,有可能将它们分类为至少26个不同属:鞘氨醇单胞菌,藻球菌,Quadrisphaera,Friedmanniella,甲基杆菌,乳头球菌,极地单胞菌,Motilibacter,Rhodoferax,Kineosporia ·,诺卡氏菌,Flavitalea,多形杆菌,处女膜,根瘤菌,Nakamurella,Angustibacter,Brazyrhizobium和Marmoricola。 十个分离株在副臂球菌,杜鹃花,嗜酸菌,弗兰肯菌,贝氏菌,Modestobacter和Conexibacter属中得分最高,尽管对于这些分离株,由于16S rRNA序列相似性低以及它们在我们的系统树中的位置,它们都可能属于未描述的 ·属。 ·尽管已经建立了基于16S rRNA序列相似性来确定分离物新颖性的“临界值”,但该值尚无共识(Janda和Abbott,2007)。 ·当16S rRNA序列相似性低于97%时,保守阈值考虑新物种;当这些值在95%至91%之间时,考虑新属和科;当值低于91%时考虑新目。但是,最近的研究提出,新物种的临界值为98.7%(Stackebrandt和Ebers,2006年)。 此外,正如Rossi-Tamisier等人最近指出的那样。 ·(2015年),对新属和科的分类还必须考虑已经为该特定群体描述的物种之间观察到的最小和最大相似性值(Rossi-Tamisier等人,2015),因为不同细菌群体之间存在很大差异。在本稿讨论中,将考虑保守的临界值以及在系统发生树上的位置。
- 我们的方法成功地从南极土壤样品中获得了以前从未培养过的新型微生物。 通过系统进化树确定,获得了属于稀有或最近描述的属(表11)的微生物,例如乳杆菌,Flavitalea,Quadrisphaera,Motilibacter和Polymorphobacter(补充图1A-E)。
表格1:属于很少分离的属或可能未描述的属和科的分离株
- Flavitalea属最初于2011年进行了描述(Wang等,2011),迄今为止已描述了3个物种。 ·我们的分离物Ap19E与我们的F. populi和F. gansuensis在系统发育树中聚集在一起(补充图1B),这表明这些生物属于同一属。 ·Lapillicoccus属在2007年首次被描述(Lee和Lee,2007)。 ·济州乳杆菌(Lapillicoccus jejuensis)R-Ac013类型是该属中目前唯一描述的物种。 ·我们分离了两种形态学上不同的细菌(Ap13E和Ap20E),由于16S rRNA序列的相似性和在系统树中的位置(表Table11和补充图1A),它们可能属于乳头球菌属。
- 2005年描述了Q. granulorum AG019型菌株(Maszenan,2005年),它是唯一被描述的属。 ·我们的分离株Ap07E与Q.,granulorum AG019一起形成了一个独立的分支(补充图1C)。用我们的分离株进行的其他测定表明,Ap07E菌株能够在4°C下生长,并且在30°C或30°C的温度下不会发育。 ·然而,据报道,Q。granulorum AG019不能在低于15°C的温度下生长,而在37°C的最佳生长温度下却不能生长(Maszenan,2005年)。
- 多型多形细菌于2014年首次被描述(Fukuda等,2014),该属迄今已描述了两个物种。 ·我们的分离株Ap23E与这两个物种一起在系统发育树中分组(补充图1D),但是,由于与最接近的菌株的16S rRNA序列相似性低(与多形变多菌272-7有95.66%的相似性),很可能 ·我们的分离物Ap23E可能构成了新的多形细菌种。 ·最后,2012年描述了Motilibacter peucedani物种(Lee,2012),随后的出版物描述了第二种根瘤菌(Motilibacter rhizosphaerae),也提出将其作为Frankinae子亚科Frankie的新属和新家族(Lee,2013)。 ·由于系统发育树中的位置(补充图1E),我们建议分离株Ap15E属于同一属和家族。 ##### 较长的潜伏期可以隔离潜在的细菌属和家庭成员
- 此外,在我们生长缓慢的分离株中(补充表1),我们获得了与其他任何已知培养物种具有16S rRNA序列相似性从92.08%到94.6%的生物(表Table11;
- 分离株Ap25E,Ap29E,Ap36E,Ap38E Ap42E ·,Ap43E,Ap44E,Ap45E和Ap46E)。 ·这些分离物在孵育8至14周后获得。 ·特别是对于这些分离物,平板的显微镜观察对于分离至关重要,因为它们中的许多都发展为极小的菌落,并被生长较快的细菌菌落和丝状真菌围绕,最终可能使它们过度生长。 ·分离株Ap29E,Ap32E,Ap36E和Ap43被认为是Proteobacteria。 ·它们与最近描述的物种(表表11)以及属于非类型物质的微生物(94-95%)(Ap32E除外)都具有低16S rRNA序列相似性(〜94%)。 ·此分离物Ap32E在我们的系统树中与醋杆菌科细菌WS10序列聚集在一起(补充图2A)。 ·最近,金等。 ·(2016)提出了分离株WS10作为Dankookia rubra gen。 ·十一月 ·因此,在确认了这些新属之后,我们的分离物可能属于Dankookia属,因为它与WS10菌株具有98%的序列相似性。
- 分离株Ap32E,Ap29E,Ap43E属于醋菌科大细菌家族(图2A2A)。 Ap29E和Ap43E具有99%的16S rRNA序列相似性,并具有相似的表型特征,表明这两个分离株属于同一物种。 ·分离物Ap36E与根瘤菌(Rhizobiales)中的细菌分组在一起(图2B2B)。 ·但是,由于它们的16S rRNA序列相似性很低,因此在我们的系统树中,它们似乎没有聚集成任何描述的属(Ap29E和Ap43E)或科(Ap36E)。 ·通过构建带有环境序列和培养细菌的树,Ap29E和Ap43E与属于寒冷环境,冰川冰,雪和冰芯的几个序列聚在一起,这可能表明它是适应寒冷和干燥的,但尚未描述的属(补充 ·图2A),而Ap36E与在寒冷和温暖环境中发现的环境序列聚在一起,包括海洋沉积物,冰川,雪和胃肠道样本(补充图2D)。 ·这些序列与我们的分离株一起,形成了一个与最接近的家族独立的分支。
图2·分离株Ap29E,Ap32E,Ap36E和Ap43E的最大似然系统树。·(A)分离株Ap29E,Ap32E和Ap43E以及类型物质生物最相似的16S序列的亲缘关系。·(B)分离株Ap36E和类型物质生物的最相似16S序列的系统发生关系。比例尺指示每个核苷酸变化是0.02。
- 分离株Ap25E,Ap42E,Ap44E和Ap46E属于放线菌目。 ·它们与任何所述物种均具有低16S rRNA序列相似性(表Table11),其中一些低至92%。 ·通过构建具有最高16S rRNA序列相似性的系统发育树(类型材料序列),我们无法将它们分为任何描述的属或科(图3A3A)。 ·这些生物均不与任何培养细菌(非类型物质,使用Megablast评估)的16S rRNA序列相似性高于94%。 ·值得一提的是,Ap25E和Ap46E分离物以大群聚集在一起,包含几个属于山区环境(Tang等人,2016)和沙漠环境(补充图2B)的序列。 ·在阿塔卡马沙漠的高干旱地区Yungay地区报道了3个这样的序列(Connon等,2007),作者还提出了这样的序列,属于一个未描述的新属。 ·奇怪的是,研究人员试图从此类样品中分离出细菌,但在孵育3周后却没有设法从簇中分离出细菌。
图3·分离株Ap25E,Ap38E,Ap42E,Ap44E,Ap45E,Ap46E的最大似然系统树。·(A)分离株Ap25E,Ap42E,Ap44E和Ap46E的系统发育关系以及类型物质生物的最相似16S序列。·(B)分离株Ap38E和Ap45E以及类型物质生物体最相似的16S序列的亲缘关系。·比例尺指示每个核苷酸变化0.02。
Yungay环境的水分活度极低,这可能会迫使微生物在可能发生的罕见降水事件中繁殖(Connon等,2007)。 ·在这种情况下,我们分离株在分离过程中和分离后的缓慢生长行为甚至可能代表了这种细菌簇对这种环境的环境适应性,这可能是迄今为止尚未分离出该群体代表的原因。 ·考虑到我们的分离株Ap25E和Ap46E是这种细菌簇的首个培养代表,它们的特征可能有助于将这种适应性行为外推到其他沙漠,例如阿塔卡马,并有助于进一步的分离尝试。
- 最后,分离株Ap38E和Ap45E与属于放线菌属嗜热菌门的深分支系统发生谱系的细菌分组(单核嗜细菌菌)(图3B3B),与其他所述物种共有〜94%的16S rRNA序列相似性(表11) ·)。 ·在南极洲的样本中一直不断报告属于嗜热嗜热菌的生物序列(Chong等,2012; Aislabie等,2013; Kumar等,2013; Rampelotto等,2015; Ji等,2016 ·; Pudasaini等人,2017),在某些样品中达到15%的相对丰度(Ji等人,2016)。 ·尽管存在率很高,但迄今尚未从此类环境中报道过此类细菌的分离物,这使该物种除具有新颖性外,还首次从南极样品中分离嗜热菌。 ·我们观察到在80天内,两种分离物(Ap38E和Ap45E)均在10和15°C下生长,而在30°C下未观察到生长。 ·在25°C时,只有Ap38E表现出较弱的生长,但低于15和10°C时所观察到的(补充图3)。 ·这表明这些分离株可能是潜在的嗜冷微生物,考虑到单核细菌属中描述的所有物种均为嗜温菌,这是一个重要特征(Whitman和Suzuki,2015; Foesel等人,2016)。
- 系统发育树(使用类型材料序列)没有将我们的分离株(Ap38E和Ap45E)置于寡核细菌属的任何描述的属或科中。 ·如图3B3B所示,我们的分离株聚集在一起并在分枝杆菌科,芽孢杆菌科,单核细菌科和最近描述的Parviterribacteraceae家族附近形成了一个明显的分支(Foesel et al。,2016)。 ·尽管在一个独立的分支中分组在一起,但Ap38E和Ap45E彼此之间仅共享95%的16S rRNA序列相似性,表明它们是同一家族中的两个不同物种。
- 通过在系统树中包括环境序列和培养的但非类型的材料的热门信息(补充图2C),我们观察到我们的分离物形成了一个群体,该群体与来自多个地理位置的环境序列聚在一起,这些环境序列都受到大量紫外线的侵袭和/或 ·低水分活度:南极洲(Chong等,2012),矿物表面生物膜(Ragon等,2012),藏族土壤,Llullaillaco火山(> 6000 m)和阿塔卡马沙漠(Lynch等,2012) ·,这可能表明一组高度适应这种极端条件的细菌。 ·有趣的是,我们的分离物Ap38E也与两个序列聚在一起:红细菌科细菌Gsoil 319(登录号AB245332)和红细菌科细菌Gsoil 1167(登录号AB245333)与这两个序列具有99%的16S rRNA序列相似性。 ·另一方面,分离株Ap45与这两个序列仅具有95%的相似性。 ·然而,红细菌科细菌Gsoil 319和红细菌科细菌Gsoil 1167序列均于2006年保藏在GenBank中,但迄今为止尚未与任何出版物关联。 ·尽管有两种生物似乎都是从人参田中分离出来的信息(可在GenBank上找到),但没有关于此类分离物的其他信息,这使得很难与我们的两种分离物进行比较。 ·因此,我们的分离物具有很高的潜力,可以在单核细菌属中构成两个不同的新物种。
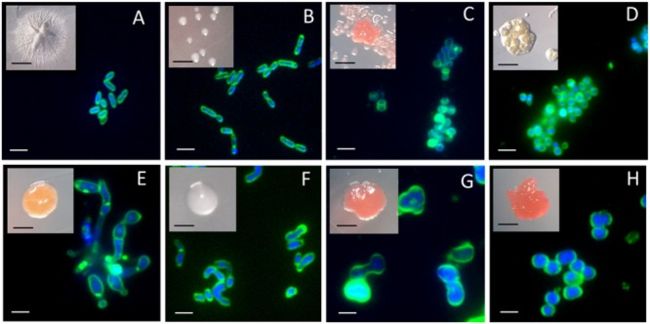
- 实际上,我们的分离株Ap38E和Ap45E具有不同的菌落形态,但两个分离株均为0.6–1.2μm的小棒(图4A,B),大小与锥虫科细菌相似(Monciardini,2003; Seki等。 ·,2012)。 ·分离株Ap25E,Ap46E和Ap42E也由小细胞组成,但是它们的形状呈类球菌状,并以聚集体形式生长(图4C,D)。 ·要注意的是,分离株Ap25E和Ap46E与在沙漠和山区土壤中发现的几个序列聚在一起,具有很强的红色色素沉着。 ·分离株Ap44E生长为橙色菌落,其细胞呈丝状并聚集(图4E4E)。 ·分离株Ap36E的细胞形态很奇怪:它看起来是双态的,并经历了不对称的分隔(图4F4F)。 ·已经针对其他根瘤菌描述了这种特征(Brown等,2012)。 ·分离Ap29E,Ap32E和Ap43E形成带有深红色的菌落(图4G,H)。 ·显微镜观察显示它们都是球状细胞(〜2μm)。
图4·从Hennequin点样品在稀释的NB介质上获得的分离株的菌落和荧光显微镜图像。·(A)isolate Ap38E;·(B)isolate Ap45E;·(C)isolate Ap25E。·分离株Ap46E获得了相似的图像,因此未显示。·(D)isolate Ap42E;·(E)isolate Ap44E;·(F)isolate Ap36E;·(G)isolate Ap29E。·用分离物Ap43E获得了相似的图像,因此未显示。·(H)isolate Ap32E。·膜用FM1-43染色,DNA用DAPI染色。·黑色比例尺:1毫米。·白色比例尺:2μm。
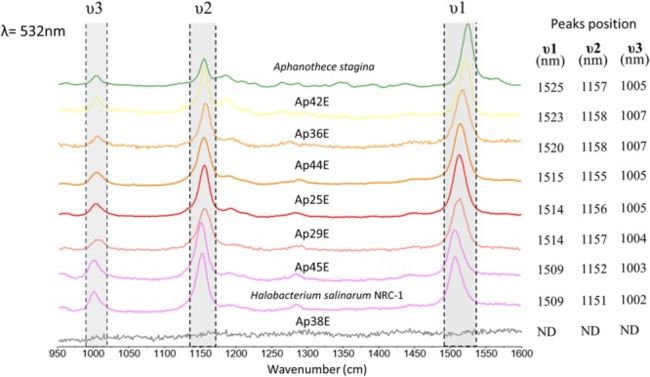
- 使用拉曼光谱对颜料进行了表征(图55)。 ·类胡萝卜素引起非常强烈的拉曼谱带,其特征是三个典型峰,分别位于1520、1150和1000 cm-1(de Oliveira等,2010;Jehlička等,2014a)。 ·除了分离株Ap38E,在所有其他分离株中均观察到类胡萝卜素。 ·令人惊讶的是,尽管没有可见的菌落着色,Ap45E和Ap36E在我们的生长条件下也产生了类胡萝卜素(图4B,F)。 ·突出显示,我们观察到分离物Ap45E(形成浅粉红色菌落)获得的拉曼光谱与盐藻嗜盐菌NCR-1(一种拉曼信号归因于细菌素的微生物)获得的光谱非常相似,由 ·与其他类胡萝卜素相比,所有峰的拉伸值均较低(Jehlička等人,2014b)。 ·杆菌肽是一种不寻常的C50类胡萝卜素,经常通过拉曼光谱法进行研究和分析(Imperi等人,2007; Morillas等人,2015),并存在于一些嗜盐古细菌和一些放线菌中,属于Rubro细菌科(Saito等人, ·1994; Imperi等人,2007)。
图5 ·分离的菌落的拉曼光谱在532 nm处激发,具有最强的类胡萝卜素拉曼谱带
- 我们试图检测细菌叶绿素的存在,特别是在分离株Ap29E和Ap43E中的存在,它们在我们的系统发育树中簇集在嗜酸性菌属附近,该组已显示产生细菌叶绿素(Kishimoto等,1995)。 ·但是,即使在使用不同的拉曼激光时,我们也无法在我们的生长条件下检测到Ap29E的色素(Donohoe等,1988;Jehlička等,2014a)的特征峰(750、910和1630 cm-1)。 ·叶绿素和细菌叶绿素具有最佳共振(补充图4)。
- 对于大多数分离株,更高浓度的培养基(NB 1/10)略微改善了细胞生长。 ·但是,除分离株Ap32E以外,分离株Ap25E,Ap29E,Ap36E,Ap38E,Ap42E,Ap43E,Ap44E,Ap45E和Ap46E无法在R2A培养基上生长。 ·R2A通常用于从南极洲和类似的寒冷环境样品中分离细菌(Skidmore等,2000; Aislabie等,2006,2013; Clocksin等,2007; Steven等,2007; Vester等, ·2013; Grzesiak等人,2015),因为它被认为是一种低营养培养基,已知会产生大量分离株(Reasoner和Geldreich,1985)。 ·我们大多数罕见的分离株都无法在R2A上发育,因此如果仅在本研究中使用R2A,就会被遗漏。
- 我们决定更深入地研究四种分离株(Ap25E,Ap38E,Ap42E和Ap45E)的生长偏好,结合使用纯和稀释培养基,中性(pH 7)和更多酸性pH(pH 5)NB培养基(5 ·和100%),TSA培养基(5和100%)和R2培养基用结冷胶(10和100%)固化(补充表2)。 ·有趣的是,所有测试的分离株均表现出对中性稀释培养基的偏爱趋势。 ·在某些情况下(分离到Ap38E,Ap25E和Ap45E),仅在稀释的培养基上记录了生长,表明这些生物确实是贫营养的。 ·此外,至少在我们测试的条件下,不可能提高分离株的生长速度:分离株Ap25E和Ap45E仍保持其缓慢生长的行为。
- 作为一个亮点,使用结冷胶作为固化剂,我们设法在R2培养基上生长了分离株Ap42E和Ap38E。 ·Ap38E在稀释的R2培养基(10%)上发育良好,但是,在纯100%R2培养基上生长不好,表明该培养基不能达到该分离株的营养要求(补充表2)。 ·即使使用在以结冷胶固化的R2培养基上发育的菌落作为接种物,Ap42E和Ap38E仍无法在R2A培养基(R2用琼脂糖固化)上生长。
- 总体而言,我们的数据表明,使用长时间的孵育,寡营养培养基,低温以及选择生长缓慢的细菌,可以从南极样品中提取顽固细菌。 ·这种策略使我们能够检索与任何所述分离株具有低16S rRNA序列相似性的几种细菌。 ·但是,其中一些分离株不仅与南极样本聚在一起,而且与在其他寒冷,极端生境中发现的序列聚在一起,例如冰川,冰芯,雪,山地土壤,石器生物膜和其他沙漠,例如阿塔卡马和塔克拉玛干 ·。 ·作为重点,我们分离了两个不同的冷适应物种,属于嗜热嗜热菌,从南极订购单核细菌,由于它们与其他所述物种的16S rRNA序列相似性低,可能属于一个未描述的属或科。 ·当前,我们正在改善分离株的生长条件,这将扩大对寒冷环境中缓慢生长的微生物的认识,它们的环境作用,胁迫适应性,并增加分类数据。