大家好,首先说明下昨天文章第二段有个错误,应该是“缺氧诱导”,而不是“缺氧敏感”。谢谢小伙伴指出。今天我们要分享的文章是:
Zhang A, Zhao JC, Kim J, Fong KW, Yang YA, Chakravarti D, Mo YY, Yu J.LncRNAHOTAIREnhancesthe Androgen-Receptor-Mediated Transcriptional Program and Drives Castration-Resistant Prostate Cancer.Cell Rep. 2015 Oct 6;13(1):209-21.
这篇15年10月份的文章发表在Cell Rep (IF 8.3) 上,研究的主题是LncRNA HOTAIR上调雄激素受体(AR)并激活下游转录事件促进前列腺癌生长,这篇文章与上篇发表在Mol Cell( IF 14.0)的研究lincRNA P21与HIF-1α在缺氧微环境条件下反馈激活的文章相比,有以下几个异同点:
1. 时间和IF,lincRNA P2114年1月(IF 14.0),LncRNA HOTAIR 15年10月 (IF 8.3);
2. 两篇文章研究的都是lncRNA,不过这篇文章选的是大名鼎鼎的HOTAIR, 在lncRNA领域基本是家喻户晓的了;
3. 上篇文章的lincRNA P21与调控靶点HIF-1α形成了反馈回路,彼此激活;这篇文章则没有,HOTAIR对AR的调控是开放的;
4. 在lncRNA对靶分子上调机制的阐述上,都是抑制泛素化介导的靶蛋白降解这一水平。实际上,lncRNA上调靶分子表达的水平和方式有太多种,我们后面会选取多篇文章分别展开说明,这是题外话。
5. 最后,既然前篇文章完胜后面这篇文章,我们今天为什么还要讲HOTAIR这篇文章呢?因为今天讲的这篇文章选的角度不同,我们主要讲免疫共沉淀(immunoprecipitation,IP)及衍生技术在研究以蛋白为中心的蛋白—蛋白、蛋白—RNA、蛋白—DNA相互作用的广泛应用,所以关于文章本身的介绍会粗略一些,对文章感兴趣的小伙伴可以从文末下载全文细看。
好了,先说下这篇文章的研究内容:
1. lncRNA HOTAIR被雄激素抑制,在去势抵抗前列腺癌(CRPC)中高表达;
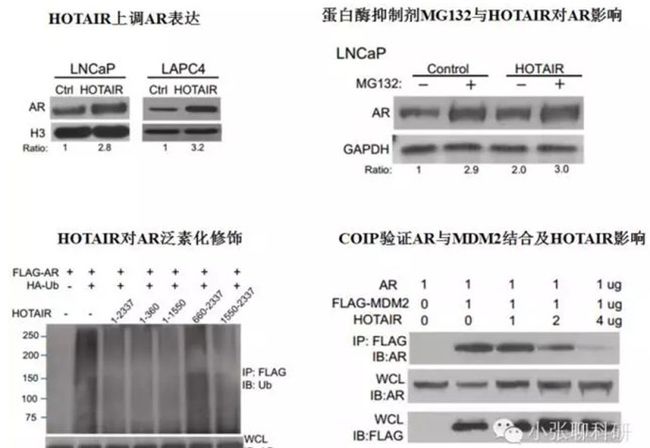
2.lncRNA HOTAIR通过抑制雄激素受体AR的泛素化降解上调AR表达;
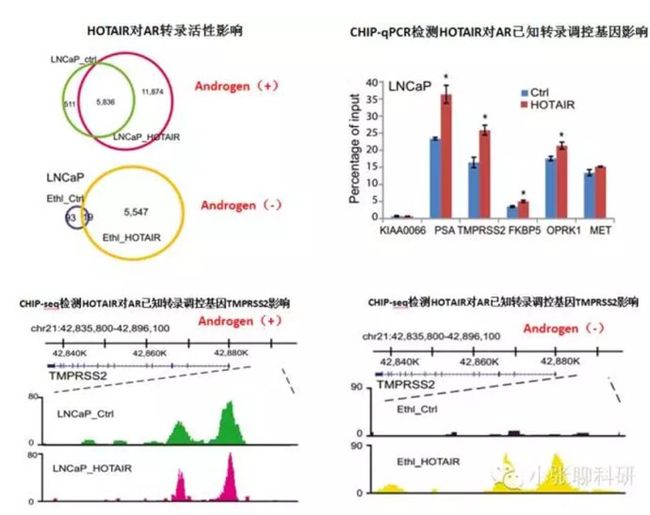
3.lncRNA HOTAIR提高了AR介导的下游靶基因调控活性;
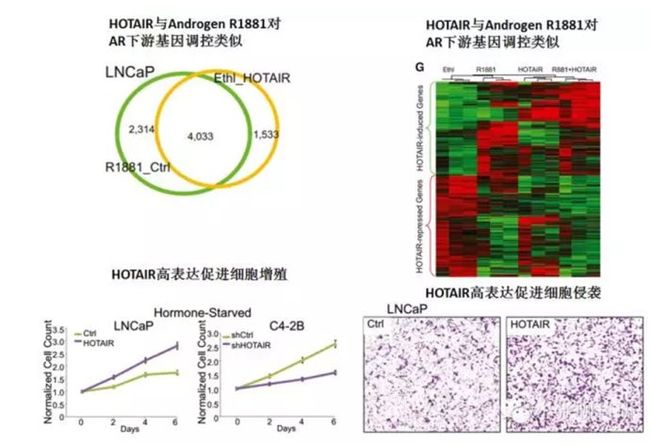
4.lncRNA HOTAIR以类似雄激素而非依赖的方式发挥促癌功能。
对于第1和第4部分我们简单介绍,重点说明第2和3部分。我们先看下文章的机制图:
LncRNAHOTAIR 高表达,通过与AR直接结合,抑制了E3泛素酶MDM2介导的AR降解,从而上调AR表达水平,并以雄激素非依赖的方式激活AR下游基因转录表达,促进CRPC细胞生长和侵袭。
在介绍全文以前,我们先科普几个技术,IP,RIP,RNA Pulldown和CHIP。
IP,immunoprecipitation,免疫共沉淀,检测蛋白
RIP,RNA Immunoprecipitation,RNA免疫共沉淀,检测RNA
RNA Pulldown,检测蛋白
CHIP,chromatin immunoprecipitation, 染色质免疫共沉淀,检测DNA
第一部分:lncRNA HOTAIR被雄激素抑制,在去势抵抗前列腺癌(CRPC)中高表达;
与上篇文章几乎一致,差别在临床部分;
第二部分:lncRNA HOTAIR通过抑制雄激素受体AR的泛素化降解上调AR表达,分为两部分来说明:
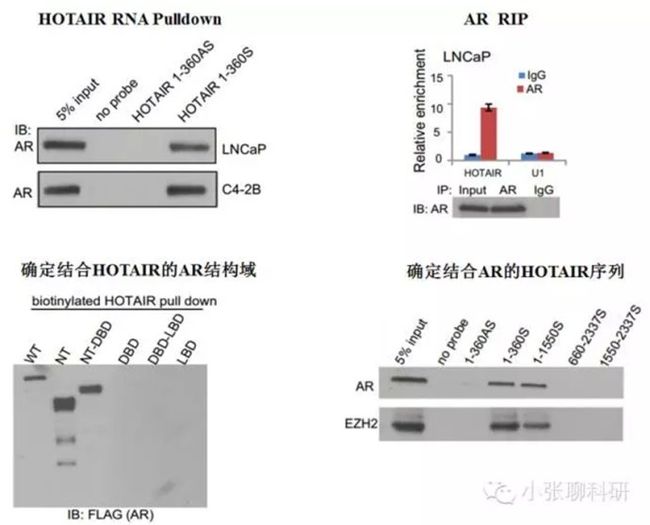
1. lncRNA HOTAIR与AR结合;
2. E3泛素酶MDM2与AR结合,而lncRNA HOTAIR抑制两者结合。
为了证明lncRNA HOTAIR与AR结合,用RIP和RNA pull-down实验分别明确HOTAIR与AR结合,并确定两者结合的序列和结构域。
为了证明lncRNA HOTAIR抑制E3泛素酶MDM2与AR结合
这一部分做了AR-MDM2的结合和lncRNA HOTAIR与AR的结合,与上篇文章方法非常像。
第三部分.lncRNA HOTAIR提高了AR介导的下游靶基因调控活性;
这一部分是说HOTAIR对AR介导的下游靶基因调控活性的影响,在lincRNA-P21那篇文章里面对应的是HIF-1α对lincRNA-P21的转录调节,都是转录因子蛋白对DNA的结合。
在这部分,主要强调的是lncRNA HOTAIR的作用,通过CHIP-seq/qPCR
对AR结合事件进行的检测。
第四部分:lncRNA HOTAIR激活AR不依赖雄激素,发挥促癌功能。
当然,如果有动物实验就更好了。
大家好,在上期的文章中,我们分享了lincRNA-P21通过结合翻译调节蛋白Rck从而阻断CTNNB1和JUNB mRNA翻译,下调β-catenin 和 JunB表达水平的文章,今天继续分享一篇文章:
Chenguang Gong,Zhizhong Li,Krishnan Ramanujan,Ieuan Clay,Yunyu Zhang,SophieLemire-Brachat,and David J. Glass.A Long Non-coding RNA, LncMyoD, Regulates Skeletal Muscle Differentiationby Blocking IMP2-Mediated mRNA Translation.Developmental Cell. (July 27, 2015) (IF9.7)
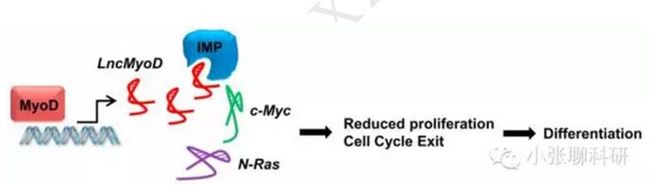
我们从换个角度看同样是参与蛋白的翻译,本文的主角LncMyoD与lincRNA-P21的作用机制有何不同。首先上机制图:
吕小布LncMyoD是一条由MyoD临近基因编码的霸王lncRNA,在成肌细胞分化时直接由MyoD基因激活。原本貂小蝉IMP2(IGF2-mRNA-binding protein 2)与增殖基因董大卓(N-Ras、c-Myc)愉快地结合在一起,激活增殖基因转录,导致细胞增殖。而小霸王吕小布LncMyoD来了之后,发现貂小蝉IMP2蛮不错,直接抢先与之竞争性结合,打压貂小蝉IMP2之前介导的董大卓增殖基因的转录,使得细胞增殖受到抑制,促使细胞分化。
这篇文章的研究内容主要包括以下几点:
1. 发现和鉴定LncMyoD,这一点我们看鉴定一条新的lncRNA,有哪些工作要做;
2. LncMyoD促进成肌细胞分化,这部分简单说明;
3. LncMyoD上调表达机制:被蛋白MyoD转录激活,这部分是蛋白与DNA作用的常见实验,前面已有文章涉及;
4. LncMyoD下游抑制蛋白翻译机制,这点我们重点来看。
首先,是第一部分:LncMyoD的发现及围绕LncMyoD所做的相关工作:
即新lncRNA鉴定工作之“”八部天龙:
1. RNA-seq找差异lncRNA
2. 根据基因位置关系确定候选lncRNA
3. RACE明确lncRNA序列
4.lncRNA在细胞内的定位(空间特异性);
5.lncRNA在组织内表达特异性;
6.lncRNA表达的时间特异性;
7. lncRNA编码蛋白能力预测;
8.lncRNA编码蛋白能力验证;
以上八步骤基本涵盖了我们在做新lncRNA研究时需要了解的基本信息,其中第1和第2的内容是我们前面一篇文章“(策略篇)千里挑一:挑选差异基因的七点策略”中的第一和第七点策略;第3点是明确lncRNA的序列和大小,因为lncRNA一般是大于200nt的;第4,5,6是研究的lncRNA表达的时间、空间和组织特异性;第7和8点是lncRNA不具备蛋白编码能力的生物信息学预测和实验结果。
另外,这部分还发现了LncMyoD的一个兄弟“LncMyoD*”,只不过在这篇文章中LncMyoD*不是主角,不过如果换个研究背景呢?说不定LncMyoD*就是主角了,如果LncMyoD*与LncMyoD的功能相同?相反?两者表达之间怎么调控?说不定是一个新的课题哦!
第二部分是LncMyoD促进成肌细胞分化的功能实验,这部分没什么好说的。
第三部分:LncMyoD与邻近基因MyoD的关系:MyoD介导LncMyoD的转录激活,从而上调LncMyoD表达。
我们在第一部分提到之所以挑选LncMyoD,除了因为LncMyoD表达上调外,还因为LncMyoD与基因MyoD位置上相近,而MyoD是参与成肌细胞分化的重要基因。那么位置上的相近仅仅暗示两者有调控,那么是LncMyoD调控MyoD?还是反过来?所以第一部分先确定两者是否存在调控,以及调控的上下有关系。结果表明:LncMyoD不影响MyoD表达,而MyoD影响LncMyoD表达,说明MyoD在LncMyoD的上游。然后预测到LncMyoD有多个MyoD的结合序列E-BOX(类似于HIF-1α对lincRNA-P21调节的文章中的HRE),后面用CHIP和荧光素酶报告基因实验验证MyoD对LncMyoD的转录激活,是我们以前说过研究转录因子常见的三大方法之二。
另外,如果LncMyoD同样激活MyoD表达呢?那么就是LncMyoD-MyoD正反馈回路了,实际上,由于LncRNA与基因位置接近而调控周围基因表达的例子还是比较多的,我们后面会选几种模式来介绍给大家。
第四部分:LncMyoD对下游基因的调控方式,这部分是我们说明的重点。
首先作者为了寻找LncMyoD调控的靶基因,通过RNA pulldown找到了IMP2蛋白,并且发现LncMyoD表达沉默后IMP2的表达水平被上调,那么LncMyoD是如何调控IMP2的水平的呢?结果发现IMP2的转录活性和蛋白稳定性都没有变化,有意思的是:IMP2的蛋白和mRNA能够直接结合,从而增加其本身mRNA的稳定性或翻译,而LncMyoD表达沉默增加了IMP2蛋白和mRNA的结合;然后,作者又发现LncMyoD除了能通过结合IMP2蛋白下调IMP2mRNA的水平外,还可以与其它结合IMP2蛋白的mRNA分子竞争结合IMP2蛋白,并下调其表达。
这一部分确定LncMyoD与IMP2蛋白作用的方法是RNA Pull downh和RIP实验,这是我们近几期每次都说的实验。值得一提的是,这里LncMyoD与包括IMP2蛋白本身的mRNA等竞争结合IMP2蛋白,从而下调靶蛋白的方式,与我们以前说过的“聊基金系列•第三期: 竞争性内源RNA(敌之敌,即吾之友)”很像,都是竞争某一类分子,但是结果是不同的,在竞争性内源RNA(ceRNA)的机制里,lncRNA通过与靶基因的mRNA竞争结合microRNA,从而正向调节靶基因的表达;而在这里,lncRNA通过与靶基因的mRNA竞争结合一类蛋白,从而反向调节靶基因的表达,至于后面这种方式能否成为一种研究模式,还要看后续的研究。