胶质瘤是常见的中枢神经系统(CNS)浸润性肿瘤,影响所有年龄的患者。它们被世界卫生组织细分为四个等级(I-IV级)。所有低级别胶质瘤(WHO II级和III级,LGGs)患者中超过半数最终将经历肿瘤复发。III级胶质瘤的5年生存率为27.3% - 52.2%,这具体取决于它们的亚型。IV级胶质瘤的5年生存率仅为5%。胶质瘤中IDH突变的存在具有重要的诊断和预后价值。具有IDH1突变的胶质瘤(或其同源的IDH2)比IDH1/2野生型肿瘤的总体存活率显著高,并且与组织学分级无关。相反,在分子水平和临床水平上,大多数伴有野生型IDH的低级胶质瘤与胶质母细胞瘤相似,生存结果同样糟糕。事实上,野生型III级胶质瘤的预后可能比IDH突变型IV级胶质瘤更差。在2016年世界卫生组织神经胶质瘤诊断标准更新中,将IDH突变状态作为分类参数,强调了其在决定预后中的关键作用,其突变可延长生存期,并可指导治疗决策。
一.研究背景
小编今天带来的这篇文章的研究目的是通过MR影像将残差卷积神经网络应用于术前的影像学数据,预测胶质瘤的IDH状态。
标题:Residual Convolutional Neural Network for the Determination of IDH Status in Low- and High-Grade Gliomas from MR Imaging
杂志:Clinical Cancer Research IF:9.619发表时间:2018.03
二.方法和材料
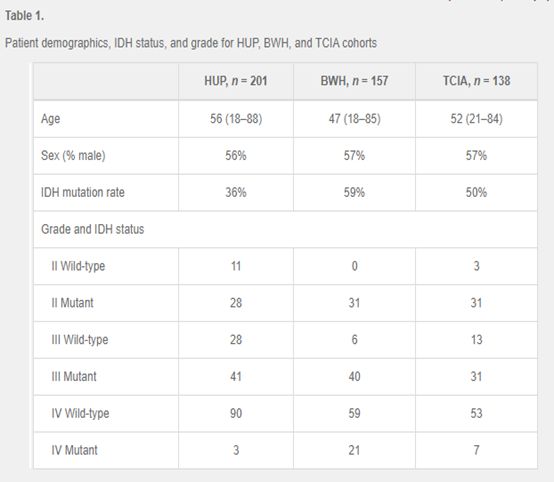
1) 样本数据集:患者队列包括来自HUP的201名患者,来自BWH的157名患者和来自TCIA的138名患者。
2) 组织诊断和基因分型:对于HUP队列,使用IHC (n = 93)或下一代测序来确定IDH1突变状态。对于BWH队列,IDH1/2突变通过IHC、基于质谱的突变基因分型或基于捕获的测序识别。对于TCIA队列中的患者,从TCGA和IvyGap下载IDH1/2突变数据。
3) 肿瘤分割:对于HUP以及TCIA队列,每个样本的MR图片被导入到Matrix User v2.2,并且手动挑出感兴趣的区域。对于BWH队列来说,肿瘤轮廓是由用户驱动的,使用3D切片软件在FLAIR imag上使用手动活动轮廓分割方法绘制的,并且由神经放射学家编辑。
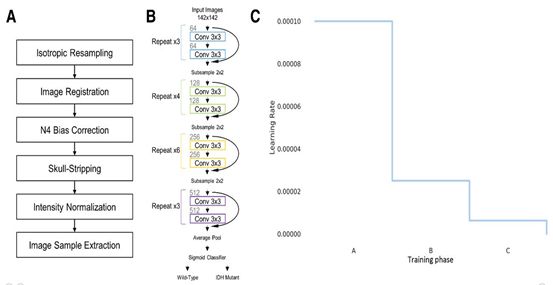
4) 图像的处理:为了提取一个切片,在肿瘤周围绘制一个从肿瘤分割得到的边界矩形。这确保了整个肿瘤区域以及肿瘤边缘的一部分被捕获。因为每个肿瘤的大小不同,所以所有的切片都被调整为142×142,以便输入神经网络。
5) 残差神经网络:卷积神经网络是专门为学习成像数据的层次表示而开发的一种神经网络。其流程如下:
6) 三个样本队列的训练:每个患者队列(HUP、BWH和TCIA)被随机分为训练、验证和测试组,比例为8:1:1,这是为了平衡突变状态和年龄。训练流程如下:
三.结果展示
1 样本的刻画
HUP、BWH和TCIA患者的中位年龄分别为56岁、47岁和52岁(表1)。男性患者的百分比分别为56%、57%和57%。HUP队列为19%的II级(72% IDH突变)、34%的III级(59% IDH突变)和46%的IV级(3% IDH突变)。BWH队列中20%为II级(100% IDH突变),29%为III级(87% IDH突变),51%为IV级(26% IDH突变)。TCIA队列为25%的II级(91% IDH突变)、32%的III级(70% IDH突变)和43%的IV级(12% IDH突变)。总的来说,HUP、BWH和TCIA组分别为36%、59%和50%的IDH突变。
2 深度学习模型优化
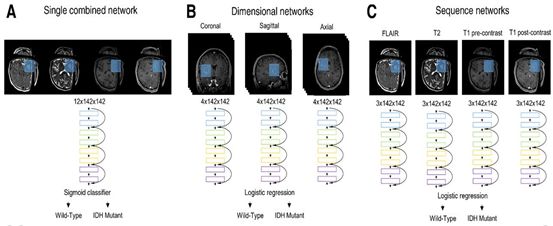
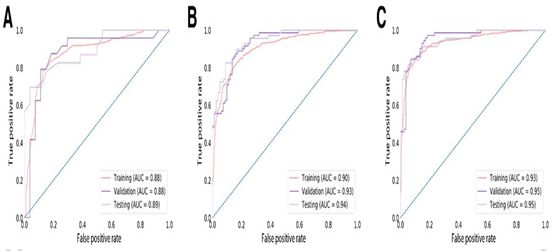
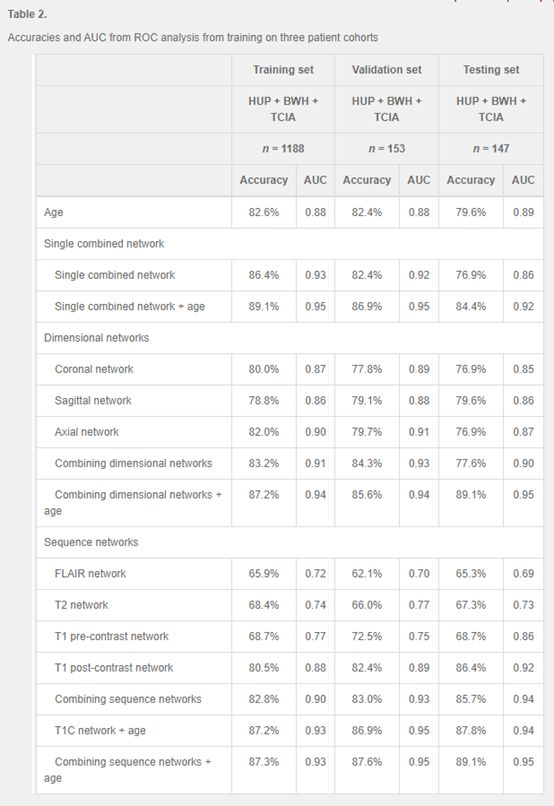
作者首先通过比较三种不同的启发式来确定完整多中心数据集的最优训练启发集(图3)。单独使用年龄的logistic回归模型,训练集的AUC为0.88,验证集的AUC为0.88,测试集的AUC为0.89(表2)。接着,作者构建了一个单独的组合网络模型。训练157次后,由此产生的模型在训练集的AUC为0.93,验证集为0.92,测试集为0.86。当与年龄相结合,这一结合网络改善了AUC,训练集为0.95,验证集为0.92,测试集位0.95。
3 对两组样本队列进行测试,并对第三组样本队列进行独立检验
为了检验模型的可推广性,作者将序列网络训练启发式方法应用于同时训练两个病人队列。FLAIR、T2、T1前对比、T1后对比残差网络分别在HUP + TCIA、HUP + BWH、TCGA + BWH联合训练集上进行训练。在训练、验证、测试和独立测试群组中,组合序列网络的平均AUC分别为0.90 (95% CI, 0.88-0.92)、0.89 (95% CI, 0.84-0.94)、0.92 (95% CI, 0.88-0.96)和0.85 (95% CI, 0.82-0.88)。当年龄与序列网络相结合时,在训练集、验证集、测试集和独立测试集中的AUC均值分别为0.94 (95% CI, 0.92-0.95)、0.95 (95% CI, 0.91 - 0.98)、0.95 (95% CI, 0.91 - 0.98)和0.91 (95% CI, 0.88-0.93)。相比之下,单独使用年龄的logistic回归模型在训练、验证、测试和独立测试集中的平均AUC分别为0.88、0.88、0.89和0.87。年龄和序列网络联合模型在独立测试集上的平均准确性、敏感性和特异性分别为82.1%、79.1%和87.0%。
四.结论
利用这个神经网络模型,作者分别在训练集、验证集和测试集实现了82.8% (AUC = 0.90)、83.0% (AUC = 0.93)和85.7% (AUC = 0.94)的IDH预测精度。当诊断年龄纳入模型时,训练、验证和测试的准确率分别增加到87.3% (AUC = 0.93)、87.6% (AUC = 0.95)和89.1% (AUC = 0.95)。表明这种深度学习技术能够实现非侵入性的高效准确预测II-IV级胶质瘤的IDH基因型,有助于指导治疗决策。
五.参考文献
1. Brat DJ, Verhaak RGW, Aldape KD, Yung WKA, Salama SR, et al.Cancer Genome Atlas Research Network, Brat DJ, Verhaak RGW, Aldape KD, Yung WKA, Salama SR, et al. Comprehensive, integrative genomic analysis of diffuse lower-grade gliomas. N Engl J Med 2015;372:2481–98.
2. Schomas DA, Laack NNI, Rao RD, Meyer FB, Shaw EG, O'Neill BP, et al. Intracranial low-grade gliomas in adults: 30-year experience with long-term follow-up at Mayo Clinic. Neuro Oncol 2009;11:437–45.
3. Pouratian N, Schiff D. Management of low-grade glioma. Curr Neurol Neurosci Rep 2010;10:224–31.
4. Venneti S, Huse JT. The evolving molecular genetics of low-grade glioma. Adv Anat Pathol 2015;22:94–101.
5. Ostrom QT, Gittleman H, Fulop J, Liu M, Blanda R, Kromer C, et al. CBTRUS statistical report: primary brain and central nervous system tumors diagnosed in the United States in 2008–2012. Neuro Oncol 2015;17Suppl 4:iv1–iv62.
6. Parsons DW, Jones S, Zhang X, Lin JC-H, Leary RJ, Angenendt P, et al. An integrated genomic analysis of human glioblastoma multiforme. Science 2008;321:1807–12.
7. Eckel-Passow JE, Lachance DH, Molinaro AM, Walsh KM, Decker PA, Sicotte H, et al. Glioma groups based on 1p/19q, IDH, and TERT promoter mutations in tumors. N Engl J Med 2015;372:2499–508.
往期分享
06-IF4+:年龄+甲基化+分子亚型+预后模型四项联合分析挖掘结肠癌的预后特征
07-IF6+:基于核磁、CT、PET数据进行特征选择来筛选头颈癌的分子亚型和预后标志物
09-IF4+:基于公共数据的干细胞特征分析挖掘膀胱癌预后特征基因
10-IF5+:纯生信分析髓母细胞瘤中干细胞和甲基化及药物的关系筛选预后特征