文章名称:Immune Cell Profiling of COVID-19 Patients in the Recovery Stage by Single-Cell Sequencing
发表期刊:medRxiv
发表单位:第二军医大学国家肝癌科学中心、中山大学中山眼科中心、军事科学院军事医学研究院和北京贝瑞和康生物技术有限公司等
发表时间:2020年3月27日
应用技术:10x Genomics单细胞5’转录组 + V(D)J
研究背景
截止到2020年3月21日,新冠肺炎COVID-19疫情已蔓延至160个国家,感染人数超过30万,死亡人数超过1万,被世界卫生组织(WHO)宣布为国际关注公共卫生突发事件(PHEIC)。此次疫情的始作俑者是一种新型严重急性呼吸道系统综合征冠状病毒2(SARS-CoV-2),可以引起发热、干咳、疲劳、腹泻、结膜炎和肺炎等,一些患者还会出现严重性肺炎、急性呼吸窘迫综合征(ARDS)和多器官衰竭。免疫系统失调,比如淋巴细胞减少和炎症细胞因子风暴被认为与致病性冠状病毒感染引起的疾病严重程度有关。目前该疾病发生发展的分子机理尚未完全阐明,缺少有效疫苗和特效药物,尽管已有研究对该病毒感染不同阶段患者的免疫状态有所阐释,但缺少在单细胞层面的精确描述和分析,细胞因子风暴的发生机制和信号通路尚不清楚。
研究方法
本研究采集5例早期恢复阶段(ERS)和5例后期恢复阶段(LRS)共10例COVID-19患者(包括5名男性和5名女性,年龄40~70岁)的外周血,并以5名正常志愿者(HCs)为对照,分离外周血单个核细胞(PBMCs),进行10x Genomics单细胞转录组测序以及单细胞BCR和TCR配对分析。其中患者组共获得70,858个细胞,正常人组共获得57,238个细胞,利用Cell Ranger software(version 3.1.0)对单细胞数据进行初步分析,t-SNE和UMAP进行细胞聚类,利用Seurat v3 和Monocle 3对类群进一步分析,差异基因(DEGs)利用GO和KEGG分析功能和通路,基于免疫相关受体和配体(细胞因子、趋化因子和共刺激因子)的表达进行细胞间相互交流的分析。
研究结果
新冠肺炎患者外周血免疫细胞图谱分析
利用t-SNE的细胞聚类结果,基于经典的markers和每个细胞群其他特异性表达上调基因共鉴定出3种免疫细胞类型:髓系细胞、NK&T细胞和B细胞。对每个细胞群进一步聚类,共鉴定出20个免疫细胞亚型。
(B)heatmaps图展示髓系细胞、NK&T细胞、B细胞以及PBMCs其他细胞群的差异上调基因;(C)t-SNE图展示PBMCs分群鉴定情况
新冠肺炎患者与健康人外周血免疫细胞差异比较
将新冠肺炎康复期患者和健康志愿者外周血PBMCs的单细胞数据(共128,096细胞)整合到一起进行聚类分析和鉴定,发现包括36,442个髓系细胞、64,247个NK&T细胞和10,177个B细胞。与健康志愿者相比,新冠肺炎康复期患者外周血中髓系细胞的比例较高,但NK&T细胞的比例较低。有意思的是,LRS患者比ERS患者的NK&T细胞和B细胞的比例更高但髓系细胞更少。可见,新冠肺炎患者的外周血中淋巴细胞数量减少,而髓系细胞数量增加。
对HCs组和患者组的髓系细胞、NK&T细胞和B细胞进行组间差异基因比较,Heatmap图显示,除髓系细胞外,患者组的炎症性细胞因子和趋化因子基因(如IL1B、CCL3、IRF1、DUSP1、JUN和FOS等)显著高表达。
(A)t-SNE图展示HCs、ERS和LRS组细胞群分布的比较;
(B)条形图展示髓系细胞、NK&T细胞和B细胞在每个个体中的相对分布;
(D)HCs、ERS和LRS组髓系细胞差异表达基因Heatmap图
新冠肺炎患者外周血免疫细胞群进一步聚类分析
为解析新冠肺炎患者早期和后期康复阶段外周血中单核细胞(monocytes)的变化,作者利用UMAP将髓系细胞进一步聚类分析,发现髓系细胞分成6个亚群,包括典型CD14++单核细胞(M1)、非典型CD16++(CGR3A)CD14-/+单核细胞(M2)、中间CD14++CD16+单核细胞(M3)、CD1C+ cDC2(M4)、CLEC9A+ cDC1(M5)和pDC(CLEC4C+CD123+)(M6)。以上单核细胞亚群的比例在新冠肺炎患者和健康人之间显著不同,比如,与健康人相比,ERS患者的典型CD14++单核细胞(M1)比例增加,而LRS患者基本回归正常。与健康人相比,新冠肺炎患者CD14++IL1β+单核细胞和IFN-activated单核细胞的丰度更高,CD14++炎症性单核细胞高表达炎症相关基因(如IL1β、JUN、FOS、JUNB和KLF6)、趋化因子基因(CCL4、CXCR4)和干扰素刺激基因(IFRD1、IRF1、IFI6);相反,抗炎相关基因则显著下调。值得注意的是,UAMP plot图显示IL1β在ERS患者中的表达显著上调,但是在LRS患者中的表达有所降低。可见,COVID-感染患者(尤其是ERS患者)的外周血中细胞因子的激活驱动了单核细胞类群(尤其是CD14++炎症性单核细胞亚型)的扩张。此外,作者还对差异基因进行了GO富集分析,发现主要在细胞因子信号和炎症激活的功能上富集。以此机制来应对SARS-CoV-2-病毒感染。
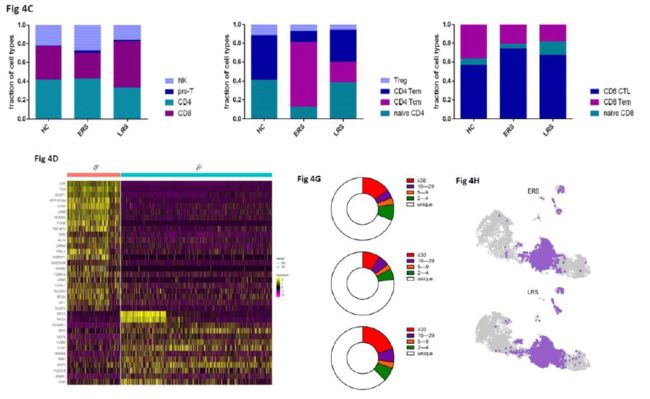
(A)根据marker基因的表达水平鉴定的髓系细胞6个细胞亚型;
(C)条形图展示HCs、ERS和LRS组髓系细胞6个亚型相对比例;
(D)COVID-19患者和HCs髓系细胞top DEGs的Heatmap图;
(F)UMAP图展示IL-1β在HCs、ERS和LRS组中的表达情况
T细胞和NK细胞在呼吸道感染的病毒清除过程中发挥着关键作用。作者通过聚类分析和经典markers将T&NK淋巴细胞进一步鉴定成10个亚型。其中,NK细胞高表达NCAM1、KLRF1、KLRC1和KLRD1,进一步分成CD56+CD16-NK细胞(NK1)和C56-CD16+ NK细胞(NK2)两个亚型;CD4+ T细胞高表达CD3E和CD4,进一步分成naïveCD4+ T细胞(T1,高表达CCR7、LEF1和TCF7)、中央记忆CD4+T细胞(T2,CD4 Tcm,高表达CCR7且比T1表达更高水平的AQP3和CD69)、效应记忆CD4+ T细胞(T3,CD4 Tem,高表达CCR6、CXCR6、CCL5和PRDM1)和调控型T细胞(T4,Treg,高表达FOXP3)共四个亚型;CD8+ T细胞高表达CD8A和CD8B,进一步分成naïveCD8+ T细胞(T5,高表达CCR7、LEF1和TCF7)、效应记忆CD8+T细胞(T6,CD8 Tm,高表达GZMK)和细胞毒性CD8+ T细胞(CD8+CTL,T7,高表达GZMB、GNLY和PRF1)共三个亚型;此外还有一个正在增殖的T细胞亚型(Pro-T,T8,为TYMS+MKI67+细胞)。与HCs组相比,COVID-19患者组外周血中T&NK细胞的组成发生显著差异:ERS COVID-19患者CD8+ T细胞的比例减少,NK细胞比例增加;CD4+ T细胞比例稳定但其亚群的组成显著不同,其中,中央记忆CD4+T细胞显著增加,但naïveCD4+ T细胞减少。CD4+ T细胞相对高表达炎症相关基因,并且在ERS COVID患者中显著上调(包括FOS、JUN、KLF6和S100A8)。CD4+T细胞是病毒感染过程中细胞免疫的主要参与者,其差异基因主要富集在细胞因子信号和炎症激活的功能中。作者建议针对COVID的发病机理研究应进一步阐述IFN pathways。
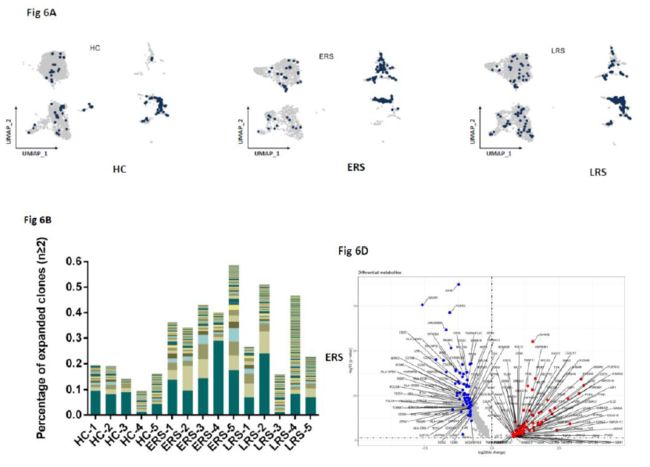
TCR-seq的分析显示,ERS组比HCs组的T细胞克隆型扩增显著减少,而且naïve或中央记忆T细胞几乎不发生克隆型扩增,但效应记忆T细胞、终末效应CD8+ T细胞(CTLs)和增殖性T细胞显著扩增。在ERS患者中扩增水平最高的克隆型为TRAV8-6-TRAJ45和TRAV7-8-TRBJ2-1。COVID-19患者外周血中CD8+ T细胞的克隆性扩增与炎症过激活有关,可以帮助清除病毒。
(A)UMAP图展示NK&T淋巴细胞10个细胞亚型;
(C)条形图展示NK&T细胞4个亚型、CD4+ T细胞4个亚型和CD8+细胞3个亚型的相对比例;
(D)Heatmap图展示COVID-19患者和HCs差异基因表达情况;
(G)饼图展示HCs、ERS和LRS组TCR克隆型的差异;
(H)UMAP图展示ERS和LRS组TCR克隆型
B细胞进一步分群和鉴定得出四个亚型:naïve B细胞(B1,表达CD19、CD20(MS4A1)、IGHD、IGHM、IL4R和TCL1A)、记忆B细胞(B2,表达CD27、CD38和IGHG)、成熟性B细胞(B3,只表达CD19和CD20(MS4A1))和浆细胞(B4,高表达XBP1和MZB1)。与HCs组相比,COVID-19患者的浆细胞比例显著增加,但naive B细胞显著减少。记忆B细胞和浆细胞(MPB)可能在控制病毒感染和适应性免疫发展上发挥重要作用,因为二者可以协同合作诱导特异性抗体的产生。而且与HCs组相比,在COVID-19患者的早期阶段,MPB主要表达B细胞激活相关基因(包括CD27、CD86、XBP1和MZB1)。作者将ERS组和HCs组的每个B细胞亚型的炎症基因平均表达水平进行了比较,这种不同说明了COVID-19患者B细胞反应和抗体分泌增强的原因。GO富集分析结果显示,COVID患者MPB中的过表达基因IGHA1、XBP1、MZB1、JUN、POLR2L和ZFP36能够增强B细胞增殖和病毒性转录。
单细胞BCR-seq分析发现,与HCs相比,COVID-19患者的IgA型B细胞过量出现,这与冠状病毒类感染患者血清中IgA抗体水平增加的现象一致。而且在ERS患者中,(IgA+IgG+IgE)/(IgD+IgM)的比率显著增加,说明了康复时间具有下降的趋势。
(A)UMAP图展示B细胞4个细胞亚型;
(C)条形图展示HCs、ERS和LRS组B细胞各亚型相对比例;
(E)小提琴图展示B细胞各亚群MZB1基因在COVID-19和HCs组的表达水平;
(G)条形图展示各细胞亚型在每个样本中的相对比例
新冠肺炎患者BCR克隆型扩增和VDJ基因重排偏向
利用Sc-BCR-seq来评估患者外周血中B细胞克隆型扩增的状态,作者发现在各种B细胞亚型中,IL4R+ naïve B细胞几乎没有发生克隆型扩增,但是CD27+CD38+记忆B细胞展现出很高的的扩增水平。作者在单细胞水平进一步发现,与HCs组相比,COVID-19患者的B细胞克隆型显著性扩增,说明受到SARS-CoV-2病毒感染后,B细胞会发生独特的VDJ重排和克隆,作者还发现与LRS患者相比,ERS患者的B细胞克隆性更高。为了解扩增的B细胞克隆型的功能,作者对克隆的记忆B细胞和非克隆的B细胞进行差异基因分析,发现克隆的B细胞中包括CD27、CD38、MZB1和XBP1等在内的B细胞基因表达增加。
为了研究COVID-19患者B细胞受体(BCR)的独特改变和VDJ重排倾向,作者将患者和HCs组的VDJ基因进行了比较,发现患者IG
HV1-8、IGHV3-7、IGHV3-21、IGHV3-23和IGHV3-49的比例过高,并且患者的IGLV对IGKV1-17、IGKV2-28和IGKV3-15更具倾向性。在ERS患者中,配对频率最高的是IGHV3-23-IGHJ4和IGHV3-7- IGHJ6,该IGH主要与IGLV1-44-IGLJ3和IGKV1-17-IGKJ1编码的IGL/V配对,从而表明了受SARS-CoV-2感染影响的独特的扩增状态。
综上,COVID-19患者B细胞克隆能力的增加的原因由IgA和IgM型的主导,同时受IGHV基因的VDJ重排偏好的影响,从而揭示了SARS-CoV-2感染对病理发生的分子机制。COVID-19患者B细胞IGVs基因的重排偏好,特别是IGHV3-23和GHV3-7,将有利于SARS-CoV-2疫苗的设计开发。
(A)UMAP图展示HCs、ERS和LRS组B细胞的扩增状况;
(B)条形图展示每个个体B细胞克隆型的扩增状况;
(D)火山图展示ERS和HCs组B细胞差异基因;
(E)条形图展示B细胞克隆扩增特异性;
(F)Heatmap图展示BCR克隆扩增特异性
新冠肺炎患者免疫细胞之间的交流
评估细胞间的相互交流有利于理解ERS和LRS患者外周血中T细胞、B细胞、单核细胞和DCs细胞的不同功能状态。在ERS COVID-19患者中,作者发现了包括单核细胞激活、增殖和炎症信号在内的适应性信号。T细胞表达编码TNFSF8、LTA、IFNG、IL17A、CCR5和LTB等配体的基因,对应的受体为TNFRSF8、TNFRSF1A/TNFRSF14、IFNGR1、IL-17RA、CCR1和LTBRT等,这些受体的基因在单核细胞中表达,可能有助于促炎状态。其他T细胞-单核细胞的相互交流还涉及CSF2和CSF1的表达,T细胞可能通过CSF2和CSF1的表达与CSFRs(CSFR2/1)相联系,将单核细胞激活,从而促成炎症风暴。CD14+单核细胞群特异性表达IL1β,与T细胞表达的IL1RAP相互作用。T细胞-单核细胞相互交流可能会增强免疫反应,在恶化的COVID-19患者中出现。至于B细胞-单核细胞和B细胞-T细胞之间的交流,作者发现B细胞能够分泌大量的IL-6、LTA和LTB,促进单核细胞IL-6R、LTAR和LTBR的表达,大量的IL-6也可以提升T细胞IFN-γ、IL-1β以及其他炎症性细胞因子和趋化因子的分泌。这种炎症性单核细胞高表达IL-6的级联特征在ERS COVID-19患者的发病高峰期形成。大量激活的免疫细胞进入肺循环和其他器官,发挥免疫损伤的作用。在LRSCOVID患者中,DC配体被发现与B细胞和T细胞受体在细胞增殖和抗体产生的过程中相互作用。作者发现LRS患者的外周血中含有多样性丰富的抗体,并且在分析DC-B细胞之间交流时发现了IL18−IL18RAP、TNFSF13-TNFRSF13B、TNFSF13-TNFRSF17、TNFSF13B−TNFRSF17、TNFSF13B−TNFRSF13B和TNFSF13B−TNFRSF13C的高表达,因此推测在ERS时期,DC细胞通过产生IL-18、TNFSF13和TNFSF13B来促进B细胞的增殖和大量抗体向外周血的分泌。从DC-T细胞和T-B细胞的交流中,作者还发现DC细胞不仅产生IL-18,还产生IL-7来促进T细胞的增殖,T细胞产生IL-2来促进B细胞的增殖和抗体的产生。细胞之间的相互交流能够帮助人们理解COVID-19患者外周血中单核细胞比例高,以及淋巴细胞比例低和在康复期逐渐增加的原因。
示意图说明了ERS和LRS COVID-19患者的关键先天性和适应性免疫功能的改变和差异。
研究结论
本研究利用单细胞测序构建了新冠肺炎患者的外周血免疫细胞图谱,发现了ERS患者高水平的炎症反应,从而解释了一些患者出院后再次出现症状的原因,因此需要加强对康复期患者的医学观察,使治疗效果得到进一步巩固。此外,作者解析了髓系细胞、NK、T和B细胞在病毒感染后的特征以及TCR和BCR的变化,为阐明人体抗病毒免疫机制和利用疫苗和抗体进行免疫治疗提供了线索。
参考文献
Wen Wen, et al. Immune Cell Profiling of COVID-19 Patients in the Recovery Stage by Single-Cell Sequencing. medRxiv, 2020.