人类小脑内在组织背后的基因图谱
摘要
人类小脑的功能多样性在很大程度上被认为更多地来自于其广泛的联系,而不是局限于其部分不变的结构。然而,小脑内在组织中连接的确定是否以及如何与微尺度基因表达相互作用仍不清楚。在这里,我们通过研究同时连接小脑功能异质性及其驱动因素的遗传基质,即连接因素,来解码小脑功能组织的遗传图谱。我们不仅鉴定了443个网络特异性基因,而且还发现它们的共表达模式与小脑内功能连接(FC)密切相关。其中90个基因也与皮质-小脑认知-边缘网络的FC有关。进一步发现这些基因的生物学功能,我们进行了“虚拟基因敲除”,通过观察基因之间的耦合和FC以及将基因分成两个子集,即,一个涉及小脑神经发育的阳性基因贡献指标(GCI+)和一个与神经传递有关的阴性基因集(GCI−)。一个更有趣的发现是,GCI−与小脑连接-行为关联显著相关,并与许多公认的与小脑功能异常密切相关的脑部疾病密切相关。我们的研究结果可以共同帮助重新思考小脑功能组织背后的遗传底物,并为神经精神疾病中涉及小脑的高阶功能和功能障碍提供可能的微宏观相互作用的机制解释。
1.引言
来自动物和人类研究的证据共同促进了我们对人类小脑的理解,人类小脑参与运动、复杂的认知和情绪行为。而小脑的这种功能多样性被认为更多地来自于其与小脑外结构之间的广泛的传入和传出连接,而不是局限于小脑-皮质细胞结构的一个规则的网叶状解剖特征。考虑到人类神经系统的宏观功能组织最终受潜在的微观基因表达调控的广泛理解,因此揭示小脑功能组织背后的基因谱是很有趣的。到目前为止,尚不清楚的是,小脑内在功能组织中连接的假设确定是否以及如何与微尺度基因表达相互作用。
迄今为止,支持人类小脑功能组织的遗传机制主要尚不清楚。只有少数研究试图调查人类小脑的基因表达模式,但他们提供了基因表达变异性的不一致的结果。例如,Hawrylycz等人和Negi和Guda都发现,在整个健康成人小脑的解剖区域中,基因表达是高度同质的。相比之下,Aldinger等人和Wang和Zoghbi发现,小脑的发育和功能受分子和细胞程序的精确调控,基因表达模式在空间和时间尺度上是异质的。此外,在小鼠小脑中发现了高通量单核RNA-seq,小脑回和沟之间基因表达模式的差异以及包含特定细胞类型的小脑区域特异性。
因为显示同质性的相关研究探索了小脑整体宏观解剖边界(如小脑小叶)的整体小脑遗传表达模式,这可能未能充分反映人类小脑的功能组织。小脑遗传变异的这种不一致性有待进一步探索。
在过去的十年中,人们提出了使用任务和无任务功能磁共振成像(fMRI)来描述人类小脑组织的功能拓扑图,特别是单独的小脑功能网络和小脑内功能梯度。特别是,Buckner等人采用了静息态功能小脑-皮层回路的连通性(FC)作为绘制人类小脑内在功能结构的工具,并提出了一种可能的功能分割成7个网络和17个网络。因此,通过研究连接小脑功能异质性及其驱动因素的分子遗传底物,即连接,可以解码小脑功能组织的遗传谱。一种很有前途的方法是影像-转录组学关联分析,它允许结合宏观神经成像表型对微观转录组数据进行全脑空间分析。此外,它还提供了通过神经成像将转录组数据与行为变化联系起来的机会。这些跨尺度分析可以更好地理解微观基因表达和宏观功能网络之间的相互作用,并最终参与个体行为,重要的是,它们被认为在小脑相关疾病存在的多尺度相互作用。
因此,我们的目标是研究人类小脑功能组织背后的神经生物学遗传底物。更具体地说,我们将寻求解决以下三个渐进式的问题。在不同的细胞结构基本不变的小脑内功能网络中是否存在差异表达的基因?基因表达和小脑连接是如何相互联系的,这种联系与人类行为以及大脑疾病之间有任何联系吗?在目前的研究中,我们首先通过差异基因表达分析来检测不同的小脑功能网络,这些网络的细胞结构基本不变。这一分析使我们能够进一步研究小脑功能异质性和细胞近同质性结构之间不一致的遗传学解释。然后,为了探究这些网络特异性基因与小脑连接之间的关系,我们利用网络特异性基因构建了基因共表达矩阵,发现其与小脑内和小脑-皮层认知-边缘FC高度相关。此外,我们通过虚拟基因敲除(KO)检测了每个网络特异性基因对这种相关性的贡献,并将网络特异性基因分为两个子集,即阳性基因贡献指标(GCI+)和阴性基因集(GCI−)。我们发现GCI+似乎主要参与小脑神经发育。而GCI−似乎与神经传递、情绪-认知行为有关,并在与小脑功能异常密切相关的各种神经精神疾病中显著丰富。总之,目前的探索为将功能网络的遗传和行为标记与小脑参与各种神经精神疾病的高阶非运动功能和功能障碍联系起来提供了一个起点。
2.材料和方法
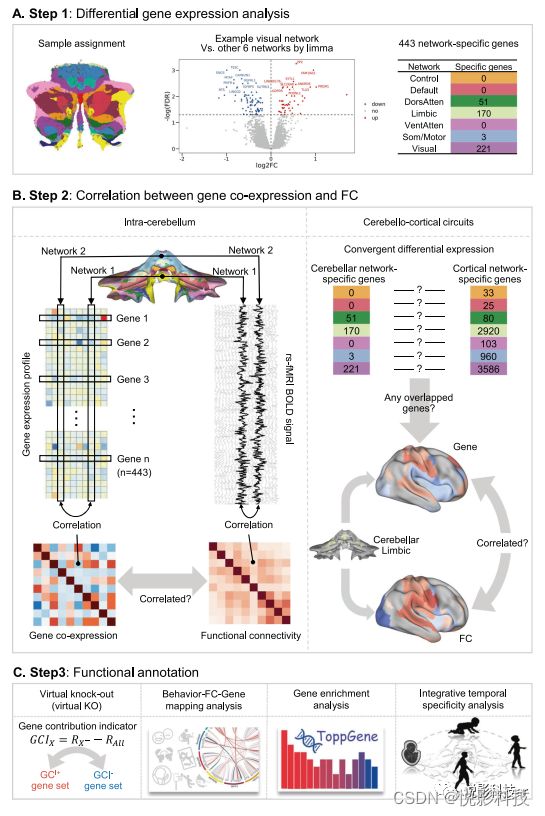
实验设计的原理图如图1所示,包括三个步骤。步骤1(图1A):为了研究网络特异性基因是否在小脑功能网络中发生,我们结合Allen人脑图谱(AHBA)转录组数据和小脑功能分割图谱进行了差异基因表达分析。步骤2(图1B):然后,利用第1步中的网络特异性基因构建共表达矩阵,并与FC进行比较,探讨其整体相关性(为简单起见称为Gene-FC相关性)。同时,还对基因与小脑-皮质FC之间的关系也进行了探讨。步骤3(图1C):利用“虚拟基因敲除”来检查每个基因对Gene-FC相关性的贡献方向,并用于将网络特异性基因分离为两个子集。此外,我们应用了一系列的功能注释工具来探索这些基因的作用,包括基因富集分析、行为-FC-基因定位分析、疾病富集分析和整合时间特异性分析。
图1.分析流程。A.步骤1:基因表达差异分析。我们将AHBA小脑样本划分为7个小脑功能网络(左),并分别平均每个基因在同一网络中的表达。然后,我们用limma(中)以差异倍数(fold change)>1和p < 0.05(FDR校正)的基因表达进行比较(红色表示基因在视觉网络中显著正表达)。因此,我们获得了7个网络的网络特异性基因(右)。B.步骤2:基因共表达与FC之间的相关性包括小脑内和小脑-皮质回路。小脑内:对于每对网络,我们利用小脑网络特异性基因计算它们之间的基因表达相似性,然后构建基因共表达矩阵。FC矩阵是通过关联所有成对的BOLD信号来构建的。然后评价了遗传相关与功能相关之间的关系。小脑-皮层回路:我们首先定义了皮质网络特异性基因,就像我们对小脑所做的那样,并测试是否发生了任何收敛性差异表达的基因。然后利用重叠基因获得每个小脑网络的皮层遗传相关性,并评估每个小脑网络的皮层遗传和功能相关性之间的关系。C.步骤3:功能注释包括虚拟基因敲除(KO)、行为-FC-基因定位、基因富集分析和生命周期特异性分析。
2.1 AHBA预处理
AHBA是一个公开的转录组数据集(http://www.brainmap.org),它提供了6个成人供体(年龄24岁、31岁、34岁、49岁、55岁和57岁的标准化微阵列基因表达数据,两个人包含左脑和右脑)的基因表达数据。组织样本收集得到了马里兰卫生和卫生系、马里兰大学巴尔的摩分校和加州大学欧文分校的机构审查委员会的批准,并获得了死者的近亲的知情同意。虽然AHBA只提供了6个成年供体的基因表达,但它仍然有许多前所未有的优势。虽然一些现有的人类基因表达图谱只覆盖了多个大脑区域,但只有AHBA提供了几乎整个大脑的高分辨率覆盖。它包括从从大脑皮层到小脑的3702个空间上不同的组织样本中提取的20,000多个基因的表达。
参考Anderson等人的研究,当前的预处理管道包括数据过滤、探针选择、样本选择和分配。我们首先使用AHBA二进制指示器过滤探针,以减轻背景噪声,并排除没有Entrez ID的探针。然后对于对应两个或多个探针的基因,我们选择邻接最大的探针来代表相应的基因表达;否则,我们保留平均表达最高的探针,使用R中的CollapseRows函数。前两步生成了20,738个独特的mRNA探针,提供了20,738个基因的表达数据。根据Arnatkeviciute的建议和鉴于已知的转录差异皮质和皮层下区域和小脑,我们分离皮质和小脑样本基于AHBA提供的slab类型和结构名称,最后分别处理它们。最后,小脑皮层保留337个样本,大脑皮层保留1701个样本。
最后,我们分别将这337个小脑样本和1701个皮质样本划分到小脑功能网络图谱和皮层功能网络图谱中,这两种图谱都有7个和17个网络分割策略。对于每个小脑样本,我们首先使用AFNI 3dmaskdump -nbox函数在每个样本的MNI坐标上生成一个1×1×1 mm3感兴趣区域(ROI)。如果ROI属于Buckner图谱的小脑网络,则分配7个或17个网络分割的网络标签。考虑到AHBA数据的不均匀和离散采样,如果1×1×1 mm3 ROI没有与任何网络重叠,则相关的ROI扩展到3×3×3 mm3。如果3×3×3 mm3ROI与功能图谱重叠,则具有最大数量的网络已经分配了与ROI共享的体素。否则,对5×5×5 mm3 ROI重复上述步骤。如果5×5×5 mm3ROI没有与任何小脑网络重叠,则排除小脑样本。将AHBA皮质样本划分为皮质功能网络图谱,与小脑使用的方法一致。
2.2 跨功能网络的差异基因表达分析
将同一网络中小脑样本的基因表达分别对每个样本的基因进行平均,得到每个供体的20,738个基因×7或17个网络矩阵。在这里,我们使用了尽可能多的最原始的整体基因,因为一些现有的筛选基因的方法没有考虑到人类小脑内基因表达的特异性。然后,我们使用R的 limma包计算7个网络中的差异表达基因,通过比较一个网络(如控制网络)与其余6个网络(如默认、边缘、视觉网络等)的基因表达,计算7个网络中的差异表达基因。由于来自不同供体的同一网络的基因表达载体可以被视为生物复制的,因此我们利用limma的重复相关工具来评估复制之间的独立性。具体来说,重复之间的相关性是使用重复相关函数估计的,该函数通过对每个基因的限制最大似然单独拟合混合线性模型,并返回共存的相关性。
这种复制之间的共存的相关性将被纳入limma的线性模型,以保存更多的信息,而不是简单地平均生物复制的。传统的最小折叠变化阈值不适合确定具有生物学意义但有细微不同的表达量,特别是小脑,因为其细胞结构高度同质。相反,我们采用Benjamini-hochberg(BH)方法来控制错误发现率(FDR),并以统计阈值p≤0.05(FDR校正)结合差异倍数> 1作为差异表达基因的关键指标。为简单起见,本文中跨小脑网络的差异表达基因被称为小脑网络特异性基因。大脑皮层网络特异性基因也以同样的方式被识别出来。唯一的差异是,皮质样本的基因表达首先在每个包裹(51个和114个包裹,分别对应于7个和17个网络)的内取平均值,然后在每个网络内取平均值。
为了检测这些基于无任务功能网络的网络特异性基因的特异性,我们还在其他不同的小脑图谱中应用了相同程序的基因表达差异分析。同一无任务功能图谱具有不同的分辨率,即17个网络分割,基于独立任务的多域任务组(MDTB)功能图谱,解剖图谱的不同分辨率不同,即11、28个小脑小叶分割。然后,我们估计了基于无任务的7个功能网络和其他图谱衍生的网络特异性基因之间的重叠基因。此外,我们仅对4个采用相同程序的左半球供体进行了差异基因表达分析,以检测这些网络特异性基因的敏感性。
2.3 小脑静息状态功能连接(FC)
使用了最小预处理的人类连接体项目(HCP)S1200发布数据集,其中有1018名受试者(年龄22-37岁),同时使用结构MRI和静息状态功能MRI(rsfMRI)。预处理管道包括伪影校正(梯度非线性失真的校正、头部运动的重新对齐、使用结构数据的fMRI数据配准、减少由于b0场不均匀性引起的几何失真等)。以及ICA-FIX 的去噪。从这些CIFTI灰度格式预处理的rs-fMRI图像中提取时间过程,并对全局信号进行回归。静息态血氧水平依赖的时间序列分别在7或17网络皮质图谱的每个皮质包和7或17网络小脑图谱的每个小脑网络内取平均值。小脑内的FC是使用皮尔逊相关性对每个兴趣ROI的平均时间过程进行计算的。因为每个被试进行了4次运行,每次运行分别计算相关值并进行Fisher-z变换,并在整个运行中取平均值,得到一个17×17小脑网络矩阵。采用相同的过程计算每个功能小脑网络与每个皮质分区之间的相关性,得到114个皮质脑区×7个小脑网络功能相关矩阵,代表整个小脑皮层回路的FC。无论FC是在小脑内还是穿过小脑-皮层回路,这两类FC都是使用更细粒度的17网络分割来提高空间分辨率。唯一的例外是,在计算整个小脑-皮质回路的FC时,应用了小脑7-网络,以直接比较每个小脑网络。
2.4 基因共表达与小脑内FC的相关性
为了充分捕捉与小脑内FC的遗传相关性,我们在构建基因共表达矩阵时,利用了两个双半球供体的遗传样本,因为小脑的FC是双侧的。因此,我们分析了2个双半球供体的基因共表达,使用来自6个供体的7个网络的特异性基因,也使用更精细的17个网络分割来提高空间分辨率。保留了包含两个双半球供体样本的网络。对于每个双半球供体,小脑样本的log2基因表达被平均标准化,然后在每个网络内取平均值。小脑10×10网络相关矩阵分别使用斯皮尔曼相关性计算(由于基因表达数据非正态),然后进行Fisher-z变换,最后平均构建最终的10个网络基因共表达矩阵。采用Bonferroni校正后,利用这两个个体的相关显著性矩阵之间的重叠来评估基因共表达的相关显著性水平。同时,我们将17×17网络的FC矩阵转化为10×10个网络大小,以与基因共表达矩阵相一致。最后,利用皮尔逊相关法计算了10×10网络基因共表达与10×10网络FC矩阵之间的关系。为了简单起见,本文中基因共表达与FC之间的相关性被称为基因-FC相关性。
为了在考虑空间自相关(SA)的同时检验基因-FC关系的重要性,我们利用具有自相关空间异质性的脑替代图生成了10000个替代图,保留了443个基因×106样本矩阵的遗传SA。这106个样本相当于用于构建基因共表达矩阵的10个网络的样本数量,因为它们包含了来自两个双半球供体的样本。参数“knn”被设置为100,以保持其与样本数量大致一致。这10000个替代图谱被用来构建基因共表达矩阵,从而在考虑SA的情况下生成基因-FC相关性的经验零分布。p值(pSA)定义为由替代图产生的相关值超过真实数据的相关系数的比例。
此外,为了评估已验证的基因-FC在小脑内的相关性的稳健性,我们还使用几个不同的分割重新计算了它,即无任务7网络分割和独立的基于任务的MDTB功能分割。每一步的标准都与我们的主要方法一致。此外,我们采用了一个对照测试来了解是否仅使用网络特异性基因就可以获得基因-FC相关性。也就是说,在使用其他基因时,没有基因-FC的相关性。我们从没有网络特异性基因的全基因集合中随机选择了443个基因,并将其称为非网络特异性基因。然后,我们使用非网络特异性基因计算基因-FC相关性,并随机运行这一步10,000次。除了这些无阈值的非网络特异性基因外,我们还对平均原始log2基因表达数据应用了一组阈值,以确认这些非网络特异性基因在小脑中表达。这样做也可以帮助我们测试使用这些阈值非网络特异性基因构建的基因共表达模式是否与FC相关。
最后,我们还使用来自HCP S1200版本的218名不相关的参与者,验证了这种基因-FC相关性的稳健性。此外,为了构成一个独立的神经成像验证数据集,我们利用了296名参与者,从预处理的HCP-Aging Lifespan 2.0中进行了4次试验(年龄38-58岁)。该数据集,以及来自我们主要分析策略的HCP S1200发布的1018名参与者,整齐地涵盖了AHBA的年龄范围(从24岁延伸到57岁)。这两个额外数据集的分析策略与我们的主要方法类似。
2.5 小脑-皮层回路中基因共表达与FC的相关性
为了深入研究小脑的功能组织,我们还基于Anderson等人所使用的策略,探讨了小脑-皮层FC与遗传相关性之间的关系。首先,我们用与小脑相同的程序来定义大脑皮层中的网络特异性基因,并检查了在小脑和大脑皮层的同一网络中重叠的基因。然后,利用来自皮层网络特异性基因和小脑网络特异性基因重叠的90个独特基因,构建了6个小脑网络和59个皮质脑区之间的基因共表达基质。这里选择小脑7网络分割来直接比较不同的小脑网络。视觉网络被排除在外,因为它只有两个样本来自两个双半球捐赠者中的一个。对于大脑皮层,我们估计了59个包含来自两个双半球捐赠者的样本的皮层分区。在每个小脑网络和每个皮质包内的log2均值化表达被单独估计,并使用斯皮尔曼的ρ、Fisher-z变换进行相关性分析。我们将114个皮层脑区×7小脑网络FC基因转化为59个皮层脑区×6小脑网络大小,以与基因共表达矩阵相一致。最后,利用6个小脑网络的皮尔逊相关性计算皮层基因相关矩阵与小脑-皮层FC矩阵之间的关系,并采用BH方法进行调整,以校正多重比较。
2.6 基因功能注释
2.6.1 虚拟基因敲除(KO)
为了扩展我们对小脑内基因共表达和FC之间整体关系的研究,我们参考了之前类似的方法,并将其称为“虚拟基因敲除(KO)”来评估每个基因对基因-FC相关性的贡献。简而言之,我们删除每个443个小脑网络特异性基因逐个模拟基因KO,然后构建没有该基因的基因共表达矩阵,分析FC和基因共同表达之间的相关性,最后计算模拟删除前后的相关系数的差异,结果被定义为基因贡献指标(GCI)。基于GCI,我们确定了两个对基因-FC相关性有相反影响的不同基因集:一个GCI阳性基因集(GCI+)和一个GCI阴性基因集(GCI−)。GCI+的虚拟KO增加了基因-FC相关性,因此其表达降低了基因-FC相关性;而GCI−的虚拟KO降低了相关性,因此其表达增加了基因-FC相关性。
2.6.2 行为-FC-基因映射分析
为了评估这些基因与人类行为之间的关系,我们利用了Ji等人提出的稳定的脑行为空间策略,该策略可以简单地分为以下三个部分。这些程序被称为行为-FC-基因映射分析,以促进论文更好地理解。
(1)HCP行为数据的主成分分析(PCA):使用了59个行为测量,涵盖了代表人类行为的一般领域的6个行为类别,包括警觉、认知、情绪、运动、人格和感觉。为了避免违反排列测试的互换性假设,我们选择了218名HCP非相关的参与者,并排除了数据缺失的被试,最终得到211名被试。显著主成分(PCs)通过排列检验计算,随机和独立地打乱受试者对每个行为测量的顺序,重新运行PCA 10000次,以建立零模型。解释方差超过随机的PC(p<0.05)被认为是显著的,并保留到下一步。PC的命名是基于在最初的59个行为措施上的负载模式。
(2) 单变量行为-FC图:17个网络之间显著PC得分和个体小脑内FC之间的关系通过对211个不相关的被试进行量化。对于每个显著的PC,然后对总共136个功能连接衍生的回归系数进行z评分,并称为该PC的行为-FC图。回归系数的显著性通过排列检验进行评估,对每个显著性PC评分的被试的顺序随机打乱10,000次。
(3) 行为-FC-基因共表达映射分析:为了评估行为-FC图和GCI+和GCI−共表达图之间的关系,我们首先构建了横跨10个小脑网络的这些映射,这些网络与包含来自AHBA双半球供体的基因样本的网络相对应。分别采用皮尔逊相关性计算8个显著PC的行为-FC图与GCI+和GCI−共表达模式之间的关系,并通过随机打乱10000次的置换检验评估显著性。
2.6.3 基因本体论,生物学通路和疾病富集分析
为了表征GCI+和GCI−的生物学作用,我们应用ToppGene网站进行了基因本体论(GO)、通路和疾病富集分析。GO 富集分析提供了本体来描述三个生物领域的基因积累的知识:生物过程、细胞成分和分子功能。选择FDR的BH方法(FDR-BH校正)(p<0.05)对多重比较进行校正。
2.6.4 生命周期特异性分析
为了研究这些基因的整体时间表达特征,我们应用CSEA工具对小脑内不同生命周期窗口内的基因进行了富集分析。这里,使用特异性指数概率(pSI = 0.05、0.01、0.001和0.0001,排列校正)来定义一个基因在每个时间窗相对于所有其他时间窗表达的概率,以代表富集的富集强度。通过Fisher精确检验来评估感兴趣基因集与在特定时间窗内富集的基因集之间重叠的显著性,并选择FDR的BH方法(FDR-BH校正)来对多重比较进行校正。
3.结果
3.1 基于小脑内功能分离衍生的小脑网络特异性基因
通过差异基因表达分析,在小脑和大脑皮层中一个网络表达比其他6个网络中表达更多的基因,分别称为小脑网络特异性基因和皮层网络特异性基因。我们鉴定了443个小脑网络特异性基因,使用了来自7个网络中的6个供体的所有样本。这些网络特异性基因的分布如表1所示,这些基因主要表达在边缘(n = 170)、背侧注意(n = 51)、躯体运动(n = 3)和视觉网络(n = 221)中。
为了检测这443个网络特异性基因在反映无任务小脑功能图谱中基因表达差异方面的特异性,我们在其他不同的小脑图谱中应用了相同程序的差异表达分析(详见“方法”)。在同一无任务功能图谱的不同分辨率下,这443个网络特异性基因与差异表达基因的重叠较多,而在基于独立任务的功能图谱和小叶图谱的不同分辨率下的重叠较少。我们还检测了4个左脑供体的网络特异性基因的敏感性,观察到230个小脑网络特异性基因,优先表达于边缘(n=49,重叠n= 44)和视觉(n=181,重叠n= 97)网络。
表1. 每个网络中与其他网络相比的显著差异表达基因的计数,称为网络特异性基因。

小脑(n = 443,左列)和皮层网络特异性基因(n = 6987,中间列)分别通过小脑和皮层7网络策略进行定义。最右边的一列测量了每个网络的小脑和皮质网络特异性基因之间的重叠
同时,我们采用相同的策略获得了6987个皮层网络特异性基因,发现小脑和皮层网络特异性基因在7个网络分割中的分布模式高度相关(r = 0.95,p = 0.001)。此外,我们发现这443个小脑网络特异性基因中有90个(~20%)在共同表达在大脑皮层(边缘网络重叠数n= 56,躯体运动重叠数n= 26,视觉网络重叠数n= 33)。这些结果表明,56个边缘网络基因在边缘皮层和边缘小脑中有共同的差异表达,两个躯体运动基因在躯体运动皮层和躯体运动小脑中有重叠差异表达,33个基因在视觉网络中有重叠差异表达。
3.2 小脑网络特异性基因的共表达与小脑内FC高度相关
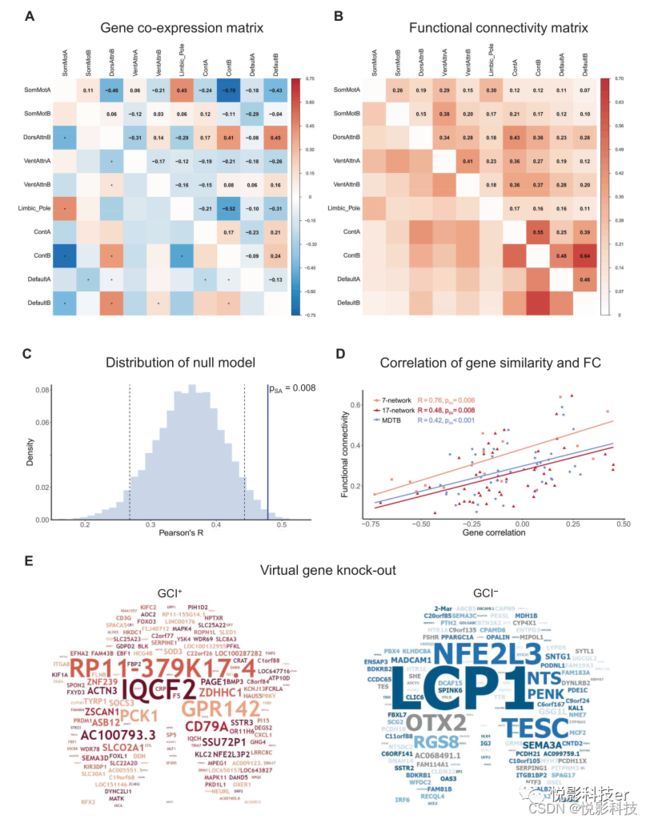
利用443个小脑网络特异性基因,我们构建了两个双半球供体的基因共表达矩阵,并探讨了基因相关性与小脑内FC之间的关系。值得注意的是,443个网络特异性基因是基于7网络分割定义的,而基因共表达采用17网络分割构建,以提高空间精度。在所有可用的网络对中,基因共表达与小脑内的FC相关(r = 0.48,pSA = 0.008,图2),通过空间自相关(SA)保留策略评估,这仍然显著。为了简单起见,这种基因共表达和FC之间的相关性被称为基因-FC相关性。为了验证小脑内的基因-FC相关性,我们还利用了相同的无任务功能图谱和基于独立任务的MDTB功能分割的不同分辨率来重新执行上述步骤(图2D)。根据7-网络分割的分析,小脑内的基因共表达和FC是相关的:r = 0.76,pSA = 0.006,和MDTB功能分割也是相关的:r = 0.42,pSA < 0.001。此外,来自HCP S1200发布的不相关被试的结果是相关的:r = 0.49,pSA = 0.010,以及另一个独立的HCP Aging神经成像数据集中也是相关的:r = 0.45,pSA = 0.013。
图2.网络特异性基因共表达与小脑内的功能连接(FC)相关。A. 利用来自所有6个供体的443个小脑网络特异性基因,构建了两个横跨10个小脑网络的共表达矩阵,显示其遗传相关性。这10个小脑网络对应于包含来自两个双半球供体的样本的网络。*p≤0.05(Bonferroni校正)。B. FC矩阵显示了使用来自HCP S1200的1018名被试的10个小脑网络的功能相关性。所有患者均通过了显著的阈值p≤0.01(Bonferroni校正)。C. 由BrainSMASH生成的保持遗传空间自相关的零模型的概率分布。垂直的黑色虚线对应p值为0.05和0.95;蓝色竖线表示实际观察到的Gene-FC相关性(r = 0.48)和相应的pSA = 0.008。D. 使用不同的图集进行小脑内基因-FC的整体相关性:无任务7网络(橙色),基于小脑-皮质FC的小脑功能图谱的17网络(红色)分割,以及基于任务激活模式的基于任务的MDTB功能分割(蓝色)。皮尔逊的相关性r和pSA值用相应的颜色表示。E. GCI+(n=246,左,红色)和GCI−(n = 197,右,蓝色)基因列表显示在小脑的扁平形状上。单词的大小和颜色的强度都表示GCI值。
因此,我们基于小脑的功能分离衍生出的443个小脑网络特异性基因也与小脑的功能整合相关。这种基因-FC相关性不是由基因SA产生的,所以当使用来自HCP的非相关被试、独立的HCP-Aging数据集、不同的分割分辨率或独立的小脑功能图谱进行计算时,它是一致显著的。此外,当使用非网络特异性基因构建基因共表达时,无论是否使用阈值,对照试验均未显示出Gene-FC相关性。这些发现证实了这443个网络特异性基因在小脑内功能组织中起着关键作用。
3.3 小脑和皮层网络特异性基因中的共同表达基因与小脑-皮层认知-边缘网络中的FC相关
由于443个小脑网络特异性基因中有90个在小脑-皮层回路中共同表达,我们想知道这些大约20%的基因是否与小脑-皮层回路中的FC相关。脑网络的基因和功能相关性之间的对应关系为,边缘系统(图3A):r=0.36,p=0.030(FDR校正)和控制网络(图3B):r =−0.33,p=0.034(FDR校正)。不显著相关的网络包括,感觉运动网络:r =−0.15,p=0.394(FDR校正),背侧注意网络:r =−0.19,p=0.281(FDR校正),腹侧注意网络:r =−0.04,p=0.779(FDR校正),和默认网络:r = 0.10,p = 0.544(FDR校正)。边缘系统与相邻的皮层网络之间遗传相似性为,控制网络:r =−0.90,p<0.001(FDR校正),躯体运动网络:r =−0.55,p<0.001(FDR校正),腹侧注意网络:r =−0.72,p<0.001(FDR校正)。这表明,小脑边缘网络和皮层之间的基因共表达反映了一个渐进的遗传梯度,而不是小脑边缘网络和其他小脑网络之间的遗传差异。此外,在控制边缘网络和控制网络之间的皮层遗传相似性的影响时,控制网络的皮层Gene-FC没有偏相关性:r =−0.13,p=0.316。这意味着控制网络中的显著皮质基因-FC相关性可以用小脑边缘和控制网络之间的高皮质遗传相似性来解释。这一观察结果也与共同的表达基因只在边缘网络而在控制网络中没有的发现相一致(表1)。总的来说,这443个小脑网络特异性基因不仅与小脑内FC相关,而且其中大约20%也与小脑-皮质认知-边缘网络相关。
图3. 小脑边缘和控制网络种子的皮层遗传和功能相关性。通过6个小脑网络和59个双半球供体的皮质包裹,其中包含来自两个双半球供体的样本。A. 边缘系统网络:通过Spearman相关性,利用小脑和皮层网络特异性基因之间的90个重叠基因,计算皮质基因共表达。使用Pearson相关性计算每个小脑网络与每个皮层脑区的FC。小脑-皮层边缘网络的遗传和功能相关性显著:r = 0.36,p = 0.030(FDR校正)。B.控制网络:小脑控制网络-皮层基因共表达和的功能相关显著:r =−0.33,p=0.034(FDR校正)。值得注意的是,考虑到控制网络的基因-FC的负相关性,基因共表达的颜色条是倒置的。
3.4 功能注释显示,通过虚拟KO分离的GCI+和GCI−具有不同的生物学特性
除了基因共表达与人类小脑功能整合之间的整体相关性外,我们还基于GCI对443个小脑网络特异性基因进行评分,研究了每个基因对小脑内Gene-FC相关性的重要性。使用虚拟基因KO过程,我们能够分类443网络基因连接小脑功能分离和集成分为两组:246个GCI阳性基因集(GCI+,图2E左)和197个 GCI阴性基因集(GCI−,图2E右)。这两组基因之间的区别在于,GCI+基因的虚拟KO增加了基因-FC相关性,而GCI−基因的虚拟KO降低了基因-FC相关性。基于赢家通吃的原则,GCI−基因可能对小脑的功能组织产生重要影响。例如,顶级基因LCP1和TESC分别使GTPase结合和钙结合,这是信号转导的关键功能,从而影响大脑功能。因此,我们应用了一系列的功能注释工具来进一步探索GCI+和GCI−的潜在作用。
3.4.1 行为-FC-基因定位分析
由于这些基因主要参与了可以预测人类行为的小脑功能网络,它们是否也参与了人类行为,FC作为中介作用?我们利用行为-FC-基因定位分析来探索GCI+和GCI−共同表达与人类行为之间的关系。基于211名HCP不相关被试的59个行为测量结果的PCA,得到了8个显著的PC。然后将单变量回归程序计算的每个显著PC的行为-FC图分别与GCI+和GCI−的共表达模式进行比较。在8个显著的PC中,我们观察到PC1、PC3和PC4的行为-FC图与GCI−共表达的相关性,而不是GCI+。
但与PC3相比,PC1和PC4在行为-FC图中很少回归系数在置换检验测试后幸存(分别为1.47%和0.74%)(图4B)。这些显著的行为-FC回归系数主要发生在默认网络、控制网络和躯体运动网络与其他网络之间的连接中(图4C),如默认B网络与躯体运动网络A、躯体运动网络B、腹侧注意网络A、边缘系统网络和默认网络A之间的连接。以小脑内FC为中介作用,PC3与GCI−共表达有显著相关性(图4E,F):r = 0.67,置换检验p < 0.001。相反,GCI+共表达与PC3的行为-FC图无相关性:r = 0.27,p > 0.05。基于原始的59个行为测量的PC3的负载模式,PC3反映了情绪认知行为测量的变化(图4A)。具体而言,PC3在情绪识别、执行功能和认知任务的流体能力中正确反应数量有较大的负荷,而在情绪识别和流体智力任务中正确反应时间有较大的负荷。提示PC3得分较高,可能反映了较高的情绪和认知能力。这一行为-FC-基因定位分析显示,GCI-不仅在小脑的功能组织中起着重要的分析作用,而且通过小脑内FC间接暗示了情绪-认知行为。
图4. 行为-FC-基因定位分析。A. 原始的59个行为测量的主成分3(PC3)的负载模式是通过主成分分析(PCA)得到的。单词大小表示负载系数的绝对值,不同的颜色表示这六种行为。B. PC3的行为-FC图,这是通过单变量回归程序在每个小脑内功能连接中PC3的z分数回归系数。C. 弦图显示了经过由10,000个置换后组成的显著回归系数。循环置换的灰色直方图表示回归系数的绝对值,它与B中所示的回归系数的值相对应。弦的颜色强度与B的色条相同。D. 用于构建GCI−共表达图谱的GCI−基因集(E)。F. 弦图显示了显著的相关性:p≤0.05(Bonferroni校正)。圆形排列的灰色直方图显示了相关系数的绝对大小,它对应于E中所示的相关系数的值。弦的颜色强度与E的颜色条相同。
3.4.2 基因本体论、生物学通路和疾病富集分析
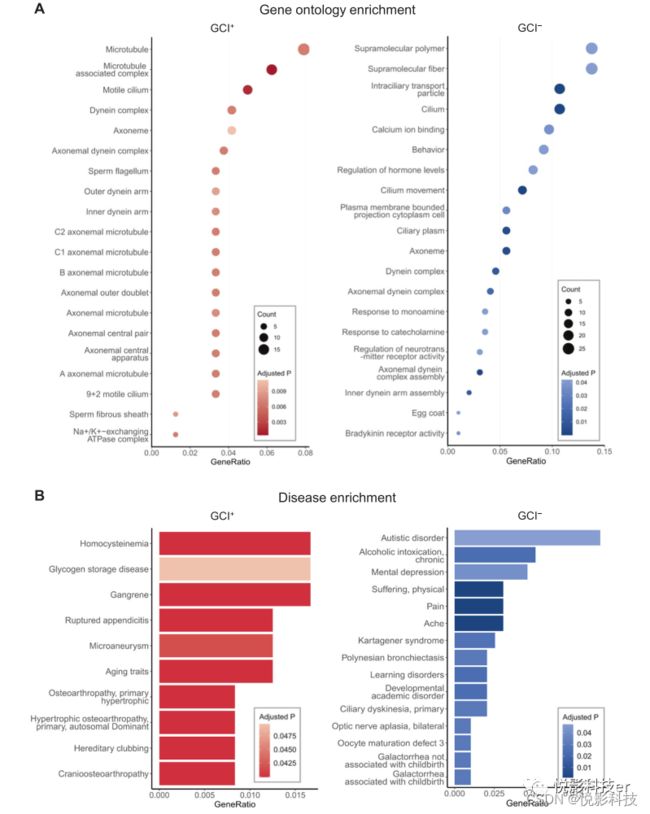
GCI+和GCI−的基因本体论富集分析如图5A所示。GCI+主要富集于微管相关的条目,包括微管相关复合物(ID: 0005875)、运动纤毛(ID: 0031514)和动力蛋白复合物(ID: 0030286)。与GCI+相比,GCI−不仅在微管相关方面富集,而且在与神经递质转运相关,如钙离子结合(ID: 0005509)、激素水平调节(ID: 0010817)、对儿茶酚胺反应(ID: 0071869)、对单胺反应(ID:0071867)和神经递质受体活性调节(ID: 0099601)方面显著富集。这些发现与他们不同的途径富集结果相一致,即GCI+主要富集于一些基本的生物途径:近端小管碳酸氢盐回收(ID:M4361)和糖酵解/糖异生(ID:M39474),这提供了微管相关过程中所需的能量。相比之下,GCI−主要参与信号转导,特别是在一些神经传递途径中,如神经活性配体-受体相互作用(ID:M13380)。
由于GCI+和GCI−参与了不同的生物过程,我们推测它们在脑疾病中也发挥着不同的作用或与不同的脑疾病相关。出乎意料的是,我们没有发现GCI+与任何脑相关疾病之间的联系(图5B,左),但观察到GCI−参与各种神经精神疾病(图5B,右),包括自闭症障碍(ID:C0004325)、酒精中毒(ID:C0001973)、精神抑郁症(ID:C0011570)、疼痛(ID:C0030193)、学习障碍(ID:C0023186)和其他。其中许多,特别是精神抑郁症和自闭症,与人类小脑密切相关,患者表现出小脑FC异常。精神抑郁和自闭症障碍相关基因是TRH,PENK,TTR,ADCY5,NRXN1,HTR1A,HTR2C,NTS,PEX5L(n=9)和DLGAP2,TRH,PENK,RYR3,SEMA3A,NRXN1,TESC,ABCG2,PCDH10,CNTN4,HTR1A,CALB2,HTR2C,DNAAF4,FOLR1,NTS,GRM8,UPP2(n=18),重叠基因包括TRH,PENK,NRXN1,HTR1A、HTR2C,NTS(n = 6)。
图5. GCI+和GCI−的基因本体论(GO)和疾病富集分析。一个气泡图显示了GCI+(左)和GCI−(右)中GO富集的前20项。生物过程(BP)、细胞组分(CC)和分子功能(MF)一起显示。点大小(计数)表示感兴趣的GCI+或GCI−基因面板内的基因数量以及特定的GO项(y轴)。不同的颜色强度表示p值(FDR校正后)。B. 梯度条形图显示了所有代表的疾病富集。
3.4.2 生命周期特异性分析
鉴于GCI+和GCI−的不同特性,我们想知道这两个基因集的作用是否在不同的年龄表现出不同的流行率。通过利用BrainSpan数据集和应用CSEA工具的分析策略,我们发现与GCI−相比,GCI+在胎儿早期、中胎儿晚期、胎儿晚期、新生儿早期和青春期显著过表达(图6A)。这些阶段与人类小脑的长期发育的时间线完全一致,它从胚胎早期一直延伸到出生后第一年的结束。这一结果似乎与GCI+参与一些基本的生物学过程,特别是微管相关活动相一致,它们的动力学在小脑神经发育中起着关键作用。相比之下,与GCI+相比,GCI−在胎儿早期、新生儿早期、婴儿晚期、儿童早期、青少年和青年期显著表达(图6B)。这些时期包括自闭症谱系障碍(ASD)和重度抑郁障碍(MDD)的最高神经发育风险窗口,这两种窗口也存在于GCI−的疾病富集分析中。
图6. GCI+和GCI−的人类小脑生命周期特异性分析。A. 条形图显示GCI+的生命周期特异性结果。使用特异性指数概率(pSI = 0.05、0.01、0.001和0.0001,置换检验校正,显示为不同的颜色强度),来确定一个基因相对于所有其他生命周期在给定的时间窗内表达的可能性。x轴对应−log10p(FDR校正。垂直的暗虚线对应于p=0.05(FDR校正)。B. 条形图显示GCI−的生命周期特异性结果。
- 讨论
本研究初步探索了与人类小脑功能组织相关的遗传差异和共表达,并有可能阐明和重新思考小脑功能组织的神经生物学基础。此外,我们确定了参与小脑神经发育和神经传递的两个基因集,并发现了间接但有趣的遗传证据,支持小脑功能网络在情绪-认知行为以及许多神经精神疾病中发挥的关键作用。这些发现暗示了小脑对情绪-认知行为的贡献的微观-宏观相互作用的机制可能性,从而导致相关的神经精神障碍。
4.1 小脑功能分离的遗传图谱与小脑内和小脑皮层连接相关
在本研究中,我们发现了已鉴定的小脑网络特异性基因与小脑内连接和小脑-大脑FC之间的相关性。这些发现可能为假设的决定性因素提供可能的经验遗传学支持小脑连接在小脑功能异质性中的作用。首先,在获得网络特异性基因时,我们发现功能特异性(即边缘、视觉网络)和功能多样性网络(即控制、默认网络)之间的识别基因数量存在显著差异;具体来说,前者的基因差异表达更大,反之亦然。在之前的皮层基因表达同质性分析中也发现了这一观察结果,表明在初级感觉皮层、布鲁德曼38区和初级视觉皮层中观察到相对较高的差异表达模式。但与躯体运动小脑(n = 3)和躯体运动皮质网络特异性基因(n = 960)数量不一致相关的研究结果尚不清楚。一种可能的解释可能是,身体空间的小脑表征与运动、躯体感觉和运动前皮质之间的优先联系很难区分。小脑网络特异性基因的发现与小脑皮层细胞结构的区域差异一致,以及细胞类型和连接性,如浦肯野细胞、颗粒细胞和高尔基细胞的细胞大小和堆积密度的区域差异。
其次,小脑和皮层网络特异性基因的总体分布模式高度相关,这一发现与在小脑和皮质功能组织中发现的类似的宏观原理相一致。这些相关模式可能与小脑网络的定义有关,小脑网络是通过计算两个结构之间的功能连接,将大脑皮层网络投射到小脑上。更有趣的是,在不同的功能细分中,可以观察到同时连接功能异质性和整合的分子遗传底物,无论分割是基于无任务的小脑-皮质FC 还是基于小脑内任务的激活模式。这些解释进一步得到了广泛接受的关于人类小脑的观点的支持,即其功能特化更多地是由其与小脑外结构的联系,而不是其一般同质的细胞结构。虽然没有观察到连接相邻或远处的小脑内解剖纤维连接,但我们公认,小脑内功能图是其小脑外解剖连接拓扑排列的结果。在解释行为-FC结果时,这一事实尤为重要,尽管我们的结果是通过小脑内连接获得的,但小脑-皮层连接实际上也必须参与其中。小脑外连接和小脑内连接之间的关系,反过来又会影响小脑区域之间的静息态活动。此外,对于基因与FC之间的相互作用,它们通过基因-环境(G-E)相互双向影响,使作为一个必要元素的发育相互作用,而不是基因在大脑连接中的单向决定作用。在这里,我们从成人的角度(24-57岁的AHBA供体)观察了基因-FC相互作用,与早期发育相比,G-E相互作用缺乏探索。
第三,除了小脑内基因-FC的相关性外,我们还观察到小脑功能特异性背后的基因与边缘网络和控制网络的小脑-大脑FC之间的直接相关性。控制网络中的基因-FC相关性主要是由这两个网络之间的遗传相似性引起的;边缘-情绪和控制-认知之间的相互作用已在解剖学和行为学上得到证实。例如,情绪和认知区域的综合加工仅根据它们的解剖连接来确定了。这种关系也可以观察到,当看到山顶时,悲伤的情绪比快乐的情绪更强烈。我们只在边缘网络中获得这种对应关系的一个可能原因可能是边缘网络的低功能异质性和个体间功能变异性,以及基因表达的复杂性;即,基因-FC的相关性并没有完全被差异表达的基因来描述。考虑到小脑与皮层之间的间接联系,以及小脑与皮层在基因表达模式和结构-功能关系方面存在巨大差异,以及个体变异的功能网络和在小脑-皮层认知-边缘网络共同表达基因,证明这些基因是非常重要的,可能是认知情感作用的环路的分子基础。例如,HTR1A和HTR2C,都优先表达于小脑和皮层边缘网络,是血清素传递的关键基因,并在边缘系统中发挥调节作用,作为重要的治疗作用边缘系统相关疾病的靶点。小脑内行为-FC-基因定位分析进一步证实了这一观察结果,表明其中一些基因与情绪-认知行为密切相关。
4.2 GCI+的小脑神经发育特征、小脑神经传递、情绪-认知行为、GCI−的神经精神学相关特征
有趣的是,我们通过对443个小脑网络特异性基因应用简单的虚拟KO方法,仅根据每个基因影响小脑内基因-FC相关性的方向,确定了两个具有明显不同特征的基因亚群。通过使用一系列生物信息学工具,我们发现GCI+和GCI−分别参与小脑神经发育和小脑神经传递的证据。另一个有趣的推测是,这443个联系小脑功能分类和整合的网络特定基因与一些大脑疾病有一定的关系,因为之前的证据表明,小脑功能组织起着关键作用在各种神经和精神疾病,其中大多数拥有共同的潜在遗传风险。但一个棘手的问题出现了,因为我们感兴趣的基因都来自于健康的个体。利用虚拟KO方法可以在一定程度上解决,该方法可以模拟每个基因的不同表达水平,从而在正常健康和疾病情况下大致对应于表达水平的一部分。这就是为什么我们认为我们可能能够看到GCI+和GCI−是否与一种特定的疾病有关,即使这些基因来自于健康的个体。
GCI+参与了许多与微管相关的条目,并在小脑的长期发育过程中过表达。通过引导浦肯野细胞的形态学改变,我们发现微管的动态和灵活性在整个小脑发育过程中是必不可少的。此外,GCI+的一些基因,如GTPBP2和Lin28b,在神经发育中起关键作用;过表达Lin28b基因的表达可诱导小脑病理性分叶的发育。这一趋同的证据促使我们推测GCI+参与了小脑神经发育。出乎意料的是,GCI+显示出与脑相关疾病没有联系,这似乎与它主要参与许多基本生物学功能的过程相一致。然而,这种疾病连锁关系的缺乏与GCI+基因在小脑长期发育过程中的显著过表达并不一致。许多研究人员指出,这种长期的发展增加了小脑对许多精神疾病的易感性。它可能是由早期GCI−和新生儿早期的过表达补充的。其他可能的解释包括,与大脑皮层相比,对小脑的遗传学研究较少,以及小脑和小脑外结构之间的基因表达差异较大,因此相关数据集可能缺乏针对小脑的足够信息。它要求未来的研究通过考虑多种视角来提供一个完整的解释。
与GCI+相比,GCI−与情绪-认知行为相关并参与许多神经传递过程,在各种神经和精神疾病中富集,并在婴儿后期、儿童早期、青少年和成年期显著过表达。这些结果是相互支持的。神经传递长期以来一直被认为在情绪和认知行为的关键作用,其异常已广泛与各种神经和精神障碍认知和情感障碍的特征。例如,单胺和儿茶酚胺的异常传递,如血清素和多巴胺,已被广泛地与许多精神疾病联系在一起,因此这些递质已成为潜在的治疗目标。GCI−基因表达的时期包括GCI−富集疾病的高危时期,如精神抑郁症(18-29岁)和自闭症障碍(从婴儿期到儿童)。GCI−的高表达可能与抑郁和自闭症相关的产前危险因素有关。
4.3 人类小脑功能/功能障碍的微观宏观相互作用的机制解释
小脑通过作为振荡阻尼器调节运动、情绪和认知,将多种内部表征与外部刺激和适当的反应相结合,自动维持稳态基线周围的行为,从而根据皮层优化表现。有趣的是,我们发现GCI−通过小脑内FC与情绪-认知行为相关,主要包括控制、默认和躯体运动网络之间的联系,这些网络已被人类临床数据或功能成像研究广泛证实参与了这些行为。这一结果表明,基因和FC之间的相互作用也参与了小脑的各种高级功能,为小脑调节认知和情绪和运动控制的逐步完整的概念提供了新的证据和分子底物。除此之外,关于小脑如何参与情感和认知功能的细节也可以用许多兼容的理论来解释。如内部模型,在逆转学习任务中,比起正反馈,小脑在负反馈时的激活增加,这可能与本研究中发现的负的行为-FC图相一致。
同时,情绪认知行为显著相关的区域和通过连接的GCI−完全对应于小脑后叶的病变产生的思想和情绪障碍,即小脑认知情感综合征,其特点是执行功能、视觉空间处理、语言技能和情感调节的缺失。孤立的小脑损伤患者与复杂的小脑-皮层连接障碍患者在新建立的客观认知测试组中的表现没有显著差异,如精神分裂症,精神抑郁症和自闭症障碍。因此,我们发现GCI−在许多神经精神疾病中富集,涉及这两类行为的交替,包括精神抑郁、精神障碍、自闭症障碍、疼痛、酒精中毒、学习障碍等。此外,这些疾病都与小脑FC的改变密切相关。
因此,GCI−为人类小脑的功能和功能障碍提供了一个可能的微观-宏观相互作用的机制解释。人类小脑功能组织背后的基因很可能通过与小脑连接的相互作用参与了情绪认知行为。一种可能的风险基因在相应疾病的发病机制可能通过与小脑FC,导致小脑FC失调,从而病理表现为其功能连接异常,因此短暂或长期损伤这些疾病的认知和情感行为水平。例如,在本研究中发现的基因-FC关系的对应关系的波动,以及之前在各种神经精神疾病中挖掘出的广泛的小脑FC改变。GCI−也为研究小脑参与情绪-认知行为和相关脑疾病的研究提供了一个很有前途的遗传资源。例如,观察到的重叠基因,即NRXN1,与精神抑郁症和自闭症障碍相关,支持了先前的临床研究,表明NRXN1中罕见和常见的变异具有MDD、ASD和精神分裂症的风险。HTR1A在小脑中高表达,在动物模型和人类中都与认知过程有关,它被发现与疼痛、精神抑郁、自闭症障碍、酒精中毒、学习障碍和其他疾病有关。
- 方法上的考虑
对我们的发现的解释并非没有局限性。首先,我们在覆盖AHBA年龄范围的独立成像数据集,以及具有不同分割标准和分辨率的各种小脑图谱上验证了我们的结果。但是我们无法在一个独立的基因数据集中测试我们的结果,因为没有其他公开的数据集与人类小脑亚区域的详细采样。其次,我们构建的基因共表达只考虑了基因与FC之间关系的一小部分。因此,它并没有完全概括大脑转录组的复杂性,如基因-基因相互作用。这可能是我们只发现认知边缘网络的小脑-皮层基因-FC相关性的一个原因之一。第三,本研究中使用的简单相关方法和偏最小二乘分析等线性回归模型,只能对基因进行优先级排序以进行进一步研究,不能充分探索基因与功能组织之间的因果关系。因此,复杂的遗传和表观遗传调控阻碍了进一步的探索。这使得对这种相关性的不同方向的讨论和解释具有挑战性。例如,为什么对基因-FC的影响方向相关性可以将这443个基因分离为两个具有不同功能的不同基因集尚不清楚。因此,进一步的相关探索是必要的,但非常具有挑战性。第四,由于443个基因不是基于与空间定义的表型的相关性获得的,新提出的策略不能直接利用在空间转录组数据中利用基因富集方法的偏差。尽管如此,目前还不能确定这种偏见是否会影响目前的结果,这就需要未来努力开发方法来回答这个问题。
简单地说,更多的捐赠者,基因表达的整体模式,基因调控、表观基因组学,和改善细胞分辨率是必要的和必须开发更合适的和巧妙的方法来理解基因和功能组织之间的双向关系,这是一个更大的挑战不仅仅是识别基因和成像数据之间的联系。然而,鉴于目前对微尺度基因如何促进宏观脑功能组织的理解有限,本文提出的基因优先级和相关功能注释仍然是必要的。
6.结论
总之,我们发现,小脑功能异质性背后的网络特异性基因与小脑内和小脑-大脑FC相关。这表明,与功能分离相关的遗传基础合并形成了一个集体系统,这与这些功能亚区域的功能整合密切相关。因此,目前的研究揭示了小脑功能组织背后的部分神经生物学遗传底物。我们还发现了一些重要的间接遗传标记,它们支持小脑功能网络在情绪认知行为和许多大脑疾病中发挥的关键作用。这些发现暗示了建立小脑“基因连接-功能/功能障碍”链的可能性,以及有助于弥合驱动小脑功能组织的遗传机制和行为和遗传障碍风险的预测标记,特别是重度抑郁症和自闭症障碍之间的知识差距。
参考文献:Uncovering the genetic profiles underlying the intrinsic organization of the human cerebellum