改良型新药之详细分类
随着一类新药开发越来越困难、仿制药竞争激烈,改良型新药被认为符合我国医药企业转型升级的方向,吸引了更多企业切入,本文也将针对改良型新药的6个常见共性问题给予解答,涉及科普、专利、分类、临床价值、立项、注册申请、数据统计等多个方面,帮助大家对其加深理解。
(PS:改良型新药和创新药都是属于新药范畴)
- 改良型新药的定义
改良型新药,是在已知活性成分API的基础上,对其结构、剂型、处方工艺、给药途径、适应症等进行优化;同时被改良药品的结合靶点、作用机制、药效学数据、人体药代动力学数据、有效性证据和安全性特征均较为明确;具有明显临床优势的药品。
- 改良型新药的专利保护期有多久
改良型新药于国内申报为化药2类,根据收集整理第2、3类新药经国家药品监督管理局批准颁发新药证书后获得专利保护时间为8年左右(第1类新药12年,第4、5类新药6年)。但实际上,国内许多化学1类新药,本质上即为改良型新药,但凭借“全新”的化学结构,大都按照1类新药来注册申报。这样的好处是,可以拥有更具创新的品牌影响。但弊端是,不能按照更为合理的注册申报程序来走,过程中难免投入巨大,存在一定的资源浪费。
3.改良型新药的详细分类
改良型新药注册分类为2类,2类申报细分有2.1光学异构体、成酯、新盐等;2.2改剂型;2.3新复方;2.4新适应症。其中2.1类和2.3类改良型新药都需要做大规模的临床试验加以证明其安全性和有效性,研发时间长,风险相对较大,申请数量较少;2.4类是开发新适应症,从申报药品种类统计,主要集中在抗肿瘤领域,随着临床表现和时间的推移发现新适应症就会再次申报,一般2.4类的申报主要为原研企业;2.2类改良型新药主要对剂型、工艺进行改进,通过新剂型的优势体现临床优势,不改变药理活性,相对较为简单,具有明确的临床优势,很多改进不需要做大规模临床试验,只需要通过生物等效性试验证明其药动学一致。
4.改良型新药临床价值的考量是基于技术平台优势还是为患者带来更多收益?
以前这个问题经常被研发人员忽略。对于改良型新药,无论是国家监管部门出台的系列指南,还是临床试验的开展,其指向都是如何使患者获益以及是否具有临床价值。所以,立题之初就应该明确药物的临床优势。对此,可以从以下四方面考虑:
其一,是否源于临床需求。这是立项的基本点。
其二,深入了解患者人群的生存状态,包括年龄、性别、经济收入情况等。评估是否能满足这些患者的需求。
其三,比较同类产品的国内外现状,是否具有临床优势,以及改良是否会带来新的风险。
其四,拟定合适的临床优势目标,考虑是否对患者寿命和生活质量有所改善。
同时,也要考虑医保能否负担。一般一个新药临床研究要投入几千万元资金,那么医保能否承受增加的产品价格?所以研发投入也要符合市场价值规则。产品的临床价值差异化会决定产品的市场价值,只有更具备临床价值的产品,才会在市场竞争中保持优势。
- 目前中美改良型新药的法律和注册申报存在哪些异同点?
改良型新药在我国属于注册分类第2类,要求境内外均未上市,是在已知活性成分的基础上,对其结构、剂型、处方工艺、给药途径、适应症等进行优化,且具有明显临床优势的药品。
在美国,改良型新药的注册途径可以是505(b)(1),也可以是505(b)(2),区别在于新药申请(NDA)是否基于申请人自己的研究数据。505(b)(1)申请指的是支持NDA的数据来自于申请人自己开展的研究或者获得使用许可的申请,通常适用于第1类新分子实体的NDA,也适用于在上市产品的基础上进行改变的申请(不包括仿制药)。505(b)(2)申请指支持NDA的数据不是全部由申请人自行研究获得,而是一部分引用了公开发表的文献或者FDA已批准新药的NDA中的研究内容,并且未获得引用许可的申请。这种申请是FDA为了鼓励药品研发创新,避免不必要重复研究。
因此,美国的505(b)(2)并不完全等同于中国的改良型新药,除了我国注册分类2类申报中已经包含的可申报类型,505(b)(2)申请还包括复方中的活性成分被取代为未被批准活性成分的申请、处方药到非处方药(OTC)的申请、与OTC专著(21 CFR 330.11)描述不同的药品申请等情形。
中国对改良型新药的注册申报核心在于,与被改良的药品相比,要体现出明显的临床优势,且满足新药的安全、有效性要求。明显的临床优势包括:可显著提高疗效或者新适应症(有效性优势);或在不降低疗效的同时,显著降低当前用药患者的不良反应或用药的相关风险(安全性优势),或显著提高患者用药依从性(依从性优势)以及其他利于患者用药的改良方向。
FDA 505(b)(2)和国内改良型新药有一定的异同。FDA505(b)(2)新药申请的整体要求仍然是安全性和有效性,并不强调临床优势。对505(b)(2)规定的注册申报路径核心在于是否使用了他人(比如其他药品说明书、经同行评议公开发表的文献等)的安全性和有效性等数据用于支持产品获批。FDA把505(b)(2)产品是否具备临床优势交给市场来判断,通常临床优势不显著的产品很难在美国取得商业化的成功。
- 改良型新药的数据分析与统计(立项调研)
改良型新药立项之初首先要充分调研,包括与临床一线的专家沟通,充分了解某个治疗领域、某种疾病未被满足的临床需求、临床痛点以及现有治疗手段或药物的缺陷。其次,也要关注市场营销人员沟通,从市场份额、医院需求中发现患者需求。
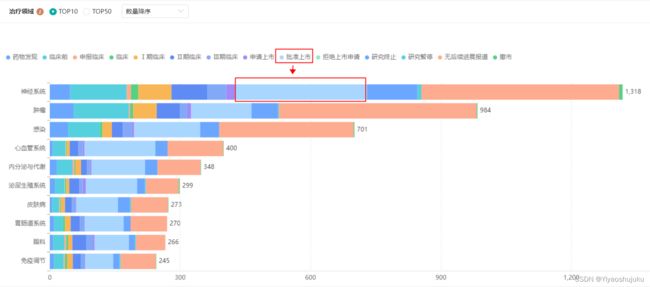
一般来说改良型新药的数据分析与统计(立项调研)都需要借助专业的医药数据统计工具,比如之前就提到改良型新药2.4类主要集中在肿瘤领域,但从总的量上来说改良型新药排第一的是神经系统领域。
图片来源:药融云数据库(改良型新药治疗领域统计)
具体的数据分析与统计还是非常简单,以药融云医药数据库工具为例,打开该数据库系统-->选择‘全球药物研发数据库’-->筛选‘改良型新药’,就能统计到改良型新药在研发阶段、首研企业、靶点、适应症、治疗领域等多个维度的数据。
图片来源:药融云-改良型新药(首研企业)
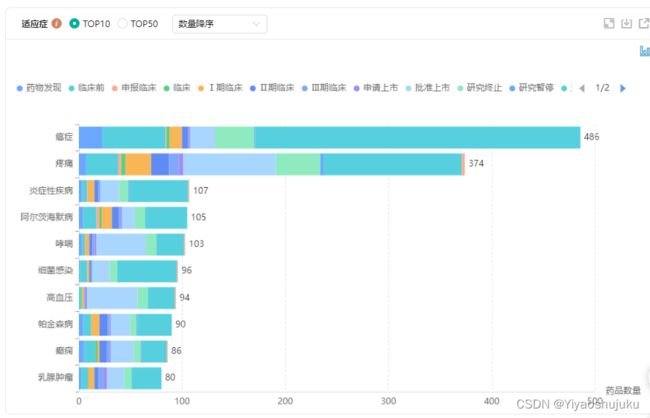
图片来源:药融云-改良型新药(适应症)
该药物研发数据库能提供以下价值:
① 发现研发领域,预估上市前景
提供靶点、适应症、治疗领域等的调研分析,帮助企业发现热点研发领域、估计将上市药物的商业前景。
②提供药物信息,掌握研发状态
提供创新药、改良型新药、生物类似药等的立项报告,是企业立项调研、实时掌握全球药物研发动态的重要工具。
③提供研究方向,助力企业规划
提供热门治疗领域、研究方向和具体适应症等的研究报告,帮助企业制定战略规划。
④分析研发信息,掌握研发状态
直观地分析药物各适应症的研发历史与研发现状,掌握全球新药的研发状态。
⑤了解临床数据,掌握临床资讯
药物临各研发阶段的临床试验结果数据,掌握药物的相关临床试验资讯。
小结
以上就是笔者针对改良型新药的6个常见问题给予的解答,欢迎交流补充。