代谢组学-南京医科大学胡志斌团队绘制心脏发育全周期多组学图谱
文章标题:Multi-omics profifiling visualizes dynamics of cardiac development and functions
发表期刊:Cell Reports
影响因子:9.995
作者单位:南京医科大学
百趣提供服务:发现代谢组学HD-MIX版
百趣代谢组学分享-研究背景
哺乳动物的心脏发育是一个多阶段且受到严格调控的复杂过程,受到多种信号分子和通路在不同时间和空间上的共同精确控制,倘若此过程中的基因调控网络受到影响将会导致先天性心脏病的发生。代谢组学分享,因此,系统阐述心脏发育和成熟中的关键分子并解析相关疾病发生分子机制尤为重要。代谢组学分享,然而,目前心脏发育的组学研究大多基于基因的转录表达水平,且未有研究通过全生命周期的多组学研究来探讨心脏发育和成熟的关键因子,阻碍了我们系统地理解心脏发育全过程和心脏出生缺陷发病的病因。
百趣代谢组学分享-研究方法
为了绘制心脏发育全周期多组学图谱,南京医科大学科研团队基于磷酸化蛋白质组学、蛋白质组学、代谢组学、单细胞转录组学等多种组学手段,代谢组学分享,描绘了心脏发育和成熟进程中关键通路和调控因子的分子图谱和转换模式。
百趣代谢组学分享-研究结果 1小鼠心脏的多组学分析
图1. 心脏发育过程中磷酸蛋白质组、蛋白质组和转录组的时间动态
基于转录组和蛋白质组的分析发现,超过一半的基因在mRNA和蛋白质水平之间显示出相对较低的相关性(图1A和1B)。但随着时间的推移,相关性逐渐增加最终趋于稳定,结果表明绝对mRNA水平可能不能预测蛋白质丰度。
使用K-means聚类分析将小鼠心脏发育的10个时间点分为4个时期:E10.5–14.5的I期、E16.5–2W的II-III期和4W–8W的IV期(图1E)。代谢组学分享,I期基因表达和磷酸化的相关性显著更高(图1F),这验证了磷酸化在早期心脏发育中参与信号强烈。
2心脏发育和成熟的多组推断和富集途径
图2. 心脏发育和成熟过程中三组学的关键途径
研究人员分别对转录组、蛋白质组和磷酸蛋白质组中4个时期中的每个时期中所代表的差异表达基因和差异表达蛋白进行了GO分析(图2)。结果表明,细胞增殖和分化的主要途径在I期丰富,包括转录调控、RNA剪接和mRNA加工。II-III期是心脏形状增大和功能增强的阶段。所涉及的途径包括线粒体翻译、翻译、细胞粘附和细胞基质粘附。IV期是心脏获得代谢相关功能的成熟阶段。IV期的基因和蛋白质参与了氧化还原过程、代谢过程(三羧酸[TCA]循环和脂肪酸代谢过程)和转运。
3MAPK和AKT通路平衡在调节心脏发育表型转换中的作用
图3. 心脏发育过程中信号动力学的表征和关键激酶底物的预测
蛋白磷酸化是信号转导和级联中翻译后修饰的关键。研究人员假设具有相似时间动力学的磷酸化位点更可能是相同激酶的底物,将所有磷酸化位点分为三个主要磷酸肽簇(图3A、4B)。分别阐述不同簇的特征:簇1的特征是早期显著激活,随后磷酸化水平降低,包括MAPK、CDK和CLK3种蛋白激酶(图3B),并在下游途径中显著富集,如蛋白质翻译、细胞间粘附和蛋白质降解(图3C)。代谢组学分享,簇2在II-III阶段显示延迟激活和衰减(图3B)。除了进一步激活细胞-细胞粘附和切换到激素信号通路之外,簇2中显著富集通路与簇1中的通路相似(图3C)。簇3显示磷酸化水平的稳定增加,表明在心脏发育后期激活(图3B),该簇磷酸化位点的磷酸蛋白主要富集于心脏的生理和病理过程,包括心肌收缩(图3C)。
另外,研究团队采用了iGPS算法(带相互作用过滤器的GPS算法,或体内GPS),确定了MAPK、CDK和CLK在早期胚胎发育中起着关键作用,它们显著富集了簇1磷酸肽,强调了其在启动磷酸化信号传导中的作用。同时还观察到激酶和底物磷酸化之间的时间一致性(图3D),这说明了激酶的时间特异性功能。从E10.5到E18.5小鼠心脏,p38 MAPK的总蛋白水平保持不变,而磷酸化(p-)p38 MAPK(180T)的蛋白水平显著下降,进一步证实了MAPK的磷酸化在心脏发育的早期阶段是重要的(图3E)。然而,磷酸化AKT1(S124)和磷酸化AKT2(S129)的蛋白水平对E14.5中的MAPK产生互斥激活,暗示其对心脏发育的潜在相反影响(图3D和3E)。
这些结果反映了MAPK和AKT对心脏发育的平衡作用,其中MAPK的磷酸化主要影响心肌细胞的分化,而AKT的磷酸化则主要影响心肌的增殖。
4识别参与早期心脏发育的核心TFs
图4. 鉴定调节心脏发育的主转录因子的表观基因组方法
为了进一步探讨转录因子(Transcription factors, TFs)对哺乳动物心脏发育的重要性,使用表观组学ATAC-seq技术对E10.5产前小鼠心脏样本进行了染色质转座酶可及性测序分析。通过预测转录因子结合位点,从而构建TF-TF调控网络,使用足迹分析来说明该阶段的调控词典(图4A)。代谢组学分享,将所有TFs分为三组:排名前200名的I级,排名201–400名的II级,其余的III级(图4B)。在确定的前10个TFs中,多个TFs对小鼠或胚胎干细胞模型中的心脏发育至关重要。
此外,由于更高的时间特异性和对功能性突变的不耐受性也表明了潜在的重要作用,我们评估了I期(E10.5–E14.5)的mRNA表达,以及检测到的所有TFs的基因对功能丧失(LoF)突变不耐受的概率(pLI评分),结果与上述结论一致(图4C)。在心脏发育早期高表达且对LoF突变不耐受的TFs中观察到I级TFs的富集(图4D)。代谢组学分享,此外,TFRE18的实验证明了这些TFs的表达和活性,I级组中检测到的TFs的比例显著高于II级和III级(图4E和4F),表明I级TFs在早期心脏发育中的重要作用。
此外,作为最常见的先天性心脏病——法洛四联症(TOF)的患者中I级TFs的LoF和有害错义突变显著高于正常对照组(图4G),而II级和III级TFs则没有。通过足迹分析发现确定的关键TFs对心脏发育非常重要,可能是潜在的新型TOF致病基因候选。这些分析揭示了早期心脏发生时基因表达程序的严格时间调控,核心TFs对心脏的正常发育至关重要。
同时,为了阐明介导信号级联的转录和染色质调节因子,团队研究了MAPK底物的共调节因子之间的蛋白质-蛋白质相互作用(PPI)。代谢组学分享,结果表明,基于实验验证的STRING数据,富含转录调节途径和I级TF的PPI被认为在早期心脏发育中起关键作用。
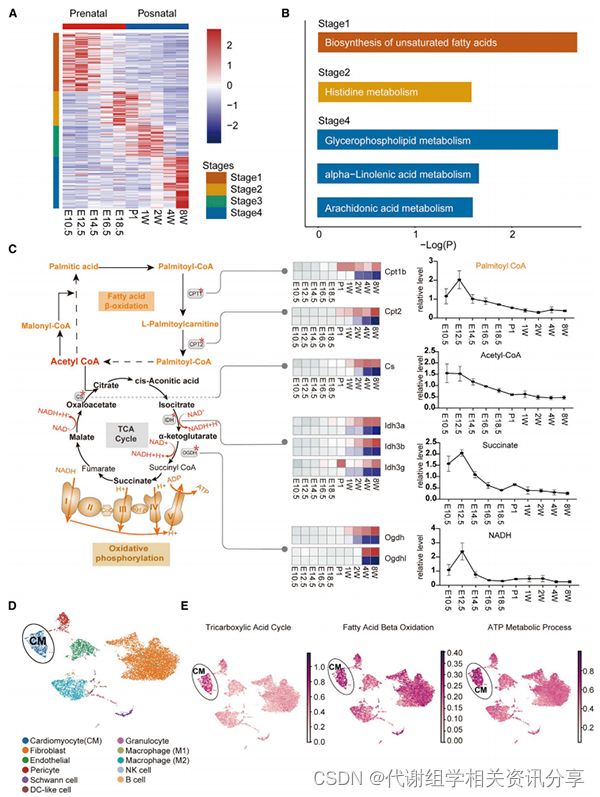
5成熟小鼠心脏TCA循环和脂质代谢途径
图5. 心脏发育过程中TCA循环和脂质的代谢途径
基于KEGG富集分析的时间代谢组谱清楚地显示,在心脏发育过程中,代谢产物的数量发生了显著变化,主要在TCA循环和心脏的脂质代谢途径中富集(图5A和5B)。图5C质谱中可以看出脂肪酸b氧化(FAO)和TCA循环中的代谢底物被消耗,而关键限速酶被高度表达。代谢组学分享,此外,单细胞转录谱显示,成熟CM是参与TCA和FAO代谢的主要细胞亚群,表明这两种代谢途径是心肌收缩的主要能量来源(图5D和5E)。
6MHC-II+原住型巨噬细胞中花生四烯酸代谢促进传出细胞增生引起的凋亡细胞吞噬
图6. 成年小鼠心脏MHC-II+原住型巨噬细胞中花生四烯酸的特异性代谢
花生四烯酸(AA)在心脏中也表现出代谢水平的上升(图5A、5B和6B)。AA合成基因在早期的表达很高,而AA合成基因在成年小鼠心脏中高度表达则表明在后期阶段AA基因具有很高的生物活性(图6A–6C)。
单细胞测序结果表明前列腺素内过氧化物合成酶1(Ptgs1)是将AA转化为前列腺素E2(PGE2)的限速步骤,在成年小鼠心脏的巨噬细胞中特异性表达(图6D)。代谢组学分享,根据CCR2的表达和依赖性将巨噬细胞分为三个不同的簇,Ptgs1主要在某些MHC-II+原住型巨噬细胞中表达(图6E和6F)。横主动脉收缩(TAC)术后MHC-II+原住型巨噬细胞的Ptgs1+细胞比例显著增加(图6G)。这表明Ptgs1通过促进MHC-II+原住型巨噬细胞的成熟而发挥心脏保护作用。有趣的是,在进一步对Ptgs1高表达细胞中的上调基因进行通路分析中发现关键传出细胞受体/酶、CX3C趋化因子受体1(Cx3cr1)和生长抑制特异性6(Gas6)的表达显著高于MHC-II+/Ptgs1–原住型巨噬细胞(图6I)。代谢组学分享,上述数据表明,AA及其代谢产物可能通过凋亡细胞的传出细胞增生在组织修复中发挥潜在作用。
百趣代谢组学分享-研究结论
该团队结合磷酸化蛋白质组学和机器学习方法构建磷酸激酶与底物的互作网络,发现MAPKs和AKTs激酶的平衡激活是心肌细胞分化和增殖能力梯度转换的关键开关;还利用表观组学ATAC-seq和功能组学TFRE技术系统鉴定了心脏发育早期的核心转录因子,类器官及遗传分析均发现上述核心转录因子及其遗传突变在先天性心脏病的发生中发挥重要作用;最后,作者结合代谢组学和单细胞转录组学数据发现花生四烯酸代谢参与心脏MHC-II+原住型巨噬细胞对凋亡心肌细胞的胞葬作用。
该研究为心脏发育和成熟提供了全面的分子描述,显著丰富了现有的数据集,它们一起揭示了支撑心脏发育和成熟的复杂但协调的分子机制。代谢组学分享,该方法提供了一个通用框架的示例,该框架能够对不同器官或组织发育的多层次控制进行新的理解,并为验证致病性突变、告知疾病机制提供功能注释。