阿尔茨海默症中的人类连接体——与生物标志物和遗传学的关系
阿尔茨海默症(Alzheimer disease, AD)的病理破坏了大脑结构和功能网络,导致了患者的认知障碍。最近的连接组学研究结果将AD的结构和功能网络组织的变化与淀粉样β蛋白和tau蛋白的积累和传播模式联系起来,为该疾病的神经生物学机制提供了深入见解。此外,检测基因相关的连接体改变可能有助于AD的早期诊断,并有助于制定在疾病谱系早期的有效个性化治疗策略。本文阐述了AD不同亚型和阶段的连接体改变与淀粉样β蛋白和tau蛋白病理以及分子遗传学之间的关系。我们还强调了连接组衍生的计算模型在复制实验结果和跟踪、预测生物标志物指示的AD病理生理学进展方面的实用性。本文发表在Nature Reviews Neurology杂志。
1.引言
阿尔茨海默症(Alzheimer disease, AD)是一种普遍的、致残的神经退行性疾病,其特征是进行性神经元和突触丧失以及伴随的神经元连接下降。这些病理特征破坏了大脑的结构和功能网络,导致严重的认知和行为障碍。临床上,早期AD的典型特征是由内侧颞叶神经退行性变引起的记忆障碍。随着疾病的发展,神经退行性变逐渐扩散到颞叶和顶叶皮质,最终扩散到大部分皮质。AD相关的障碍也见于其他认知领域,如语言、视觉空间能力、注意力和执行功能。例如,患者可能会记不住人名或物体的名字,不能在开车时导航,或不能做出财务或其他重要决定。生物学上,AD由两个主要的神经病理特征定义:细胞内含有淀粉样β蛋白(Aβ)斑块的异常累积和细胞外含有tau蛋白的神经原纤维缠结。越来越多的证据表明,Aβ最初积聚在内侧额叶皮层和内侧顶叶皮层,这两个都是默认网络(default-mode network, DMN)的组成部分。相反,tau最初沉积在内侧颞叶记忆系统,从内嗅皮层扩散到海马和海马旁皮层,然后再扩散到大脑其他区域。Aβ和tau可通过脑脊液(cerebrospinal fluid, CSF)分析或PET在人体内检测。此外,基于血液的AD病理生理学分析已经开发出来;这些检测方法比CSF和PET方法侵入性更小,成本更低。神经退行性变或神经损伤的生物标志物可通过一系列技术检测,包括PET (葡萄糖代谢)、MRI (结构、功能和扩散)、EEG和脑磁图(magnetoencephalography, MEG)。值得注意的是,AD生物标志物的变化是在一系列阶段之后发生的,在AD症状出现的几十年前,Aβ和tau在没有认知障碍的个体中开始积累(临床前AD, preclinical AD)。前驱性AD (Prodromal AD)的定义是最初出现轻微的认知症状,通常伴有生物标志物的变化,包括指示神经变性的标志物。最后,AD痴呆的定义是存在认知障碍,并伴有日常生活中工具性活动能力的下降。A/T(N)框架是一个基于特定生物标志物(框1)的实用研究分析方案,为AD的脑网络机制研究提供了明确的生物学基础。
框1 | AT(N)研究框架
AD可根据遗传变异、发病年龄和临床表型分为家族性(或常染色体显性) AD和散发性AD。在散发性AD患者中,晚发型(发病≥65岁)是常见的,但也有小部分人早发型(发病<65岁)。常染色体显性AD的特征是三个基因中的一个发生单基因突变:APP (编码淀粉样前体蛋白)、PSEN1和PSEN2 (分别编码早老素1和2)。与常染色体显性AD相比,散发性晚发AD是AD最常见的形式,被认为是一种多基因疾病,与至少50个基因的变异有关,其中载脂蛋白E (apolipoprotein E, APOE) ε4等位基因是最强的危险因素。晚发性AD患者通常表现为发作性记忆障碍。相比之下,早发性AD患者进展更快,Aβ和tau负荷更高,葡萄糖代谢更高,认知表型更多样化(例如语言、视觉空间能力、注意力、执行功能和失用症损伤)。AD的三种不同亚型在Aβ和tau病理和神经退行性变方面有共同的属性;然而,其他潜在的神经生物学机制可能有所不同。正常的认知功能需要在功能专一的大脑区域的分布神经元群之间进行有效的信息传递;这种信息传递障碍会导致包括AD在内的多种神经系统疾病的认知功能障碍。Aβ斑块和tau神经纤维缠结的神经病理学导致进行性神经元丢失和萎缩,并伴有特定皮层和皮层下脑区突触损伤,提示AD可被描述为“失连接综合症”。最近的人类连接组研究提供了一个理论框架,出现了新的定量分析工具和计算网络模型,以更好地理解大脑网络的结构和功能。在这里,我们探究了人类连接体在AD中的实证研究和建模研究,并探究了这些研究如何进一步阐明连接体与AD病理(Aβ和tau)、亚型(常染色体显性AD、晚发AD和早发AD)、遗传变异(APOE ε4和其他基因)的关系,最终可能导致网络水平的诊断生物标志物。
2.人类连接体的构建
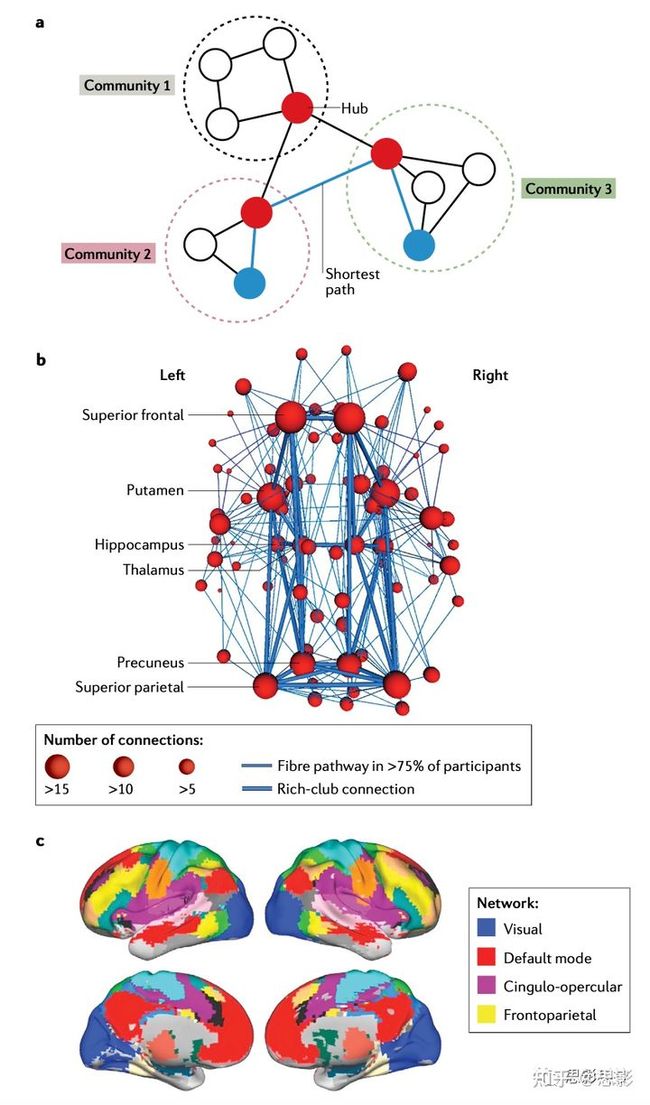
可以使用多种神经成像和神经生理学技术来构建表征人类连接体的大规模脑网络。本文概述了基于功能性MRI (functional MRI, fMRI)、EEG和MEG的功能连接体,以及基于结构和扩散MRI的结构连接体。连接体内的网络由节点(或边)和连接组成。EEG和MEG测量振荡神经元活动,利用这些技术,单个信号源在多个记录点(EEG电极或MEG传感器)产生信号,这种效应被称为容积效应。这种容积效应可能导致对大脑各区域功能连接的错误估计。因此,EEG和MEG的连通性和网络研究通常将传感器空间的神经元活动投射回潜在的源,即所谓的源空间。因此,网络节点可以定义为传感器空间的EEG或MEG电极和源空间的源重构脑区。在MRI研究中,节点是由基于细胞结构、解剖标志或连接模式的脑区划分定义的。连接由四种类型的大脑连接定义:结构连接、结构协方差、功能连接和效应性连接(或有向信息流)。利用扩散(或扩散张量) MRI来研究大脑结构的连通性,扩散MRI利用水分子的扩散特性来评估局部脑组织的微观结构,并通过白质束来反映各区域的物理连接。结构协方差是通过两个或多个脑区的形态学测量(如脑体积、皮层厚度和表面积)的协方差或相关性来测量的。功能连接是指不同脑区神经元活动时间序列的统计依赖性,它是间接从fMRI或直接从EEG和MEG中建立的。效应性连接,被定义为一个大脑区域对另一个大脑区域的直接因果影响,本文不讨论。结构或功能连接体可以表示为连接矩阵。在这个矩阵中,每一行或每一列对应一个节点(或结构或功能连接体中的脑区),矩阵元素对应两个节点之间的连接(结构或功能连接)。在这篇综述中,我们关注的是由神经影像学数据构建的连接体,其中包含的连接通常是无向的或对称的。根据感兴趣的科学问题,连通性矩阵可以被分析为加权图或进一步二值化为非加权矩阵,在非加权矩阵中每个元素要么是1 (如果两个节点之间有连接),要么是0 (如果没有连接)。然后,通过对加权或二值化连接矩阵计算一系列的图论度量,如聚类系数、路径长度、中心性和模块化(框2),可以表征连接体的拓扑性质。框2 |中枢(hubs)和社区结构HubsHubs可以由网络的许多不同方面来定义,因此提出了许多不同的度量中心性的方法,包括度degree (或加权网络中的强度)、介数betweenness、邻近度closeness、特征向量和PageRank中心性。值得注意的是,由路径长度定义的中心性度量,如betweenness和closeness,在功能网络中不如在结构网络中容易解释。在一些真实的网络中,包括大脑网络,hubs之间的联系比预期的更加紧密,形成了一个富人俱乐部(rich-club)组织。社区结构或模块复杂的网络通常由一些相对独立但又相互连接的集群(clusters)组成,称为社区(communities)或模块(modules)。已经开发了许多算法来识别现实世界网络中的communities,并已在网络神经科学领域得到应用。一组最广泛使用的检测大脑communities的方法被称为模块化最大化方法。这些方法通过最大化模块质量函数将网络节点划分为多个不重叠的modules。然而,模块化最大化经常遇到分辨率限制:相对较小但非常密集的modules在相对较大的modules存在时可能无法检测到。一些研究使用多分辨率技术来避免分辨率限制问题。网络一旦被划分为modules,就可以根据modules内部和modules之间的其他节点的连接情况对网络中的节点进行分类,并通过模块内degree和参与系数进行量化。例如,hubs可分为区域性(provincial,高模块内degree)hubs和连接型(高参与系数)hubs:区域性hubs大多连接同一模块内的节点;连接型hubs连接来自多个模块的节点。在功能性脑网络中,参与系数被认为是一种比节点度更有意义的hub指标,它能够识别在神经信息整合中发挥重要作用的节点。3.健康人中的连接体自2000年以来,对无认知障碍个体的结构和功能脑连接体的研究已经确定了小世界性、富人俱乐部结构和(层次化)模块化组织,这在多个尺度上都很明显。在人脑中,楔前叶和后扣带皮层(posterior cingulate cortex, PCC)是MEG、fMRI、DTI研究中一致确定的两个最大的网络枢纽。证据还表明,海马是人类连接体的关键枢纽,它支持记忆的形成和巩固。同样,内侧颞叶和外侧内嗅皮层在多个物种的连接体网络拓扑中形成假定的中枢。人脑连接体由多个子网络组成,称为模块或社区。脑网络模块(modules)促进神经信息的分离,枢纽(hubs)促进这些信息的整合;这两个过程对于构成认知功能的分布式网络的运行都是必不可少的。特别是,静息态fMRI、任务态fMRI和结构MRI的研究已经在人类大脑中识别出了许多类似的子网络,包括DMN、额顶、突显、背侧/腹侧注意、带状盖、感觉运动、视觉、听觉和皮层下网络(图1)。这些子网络由hubs连接,每个hub在特定的感觉运动和认知领域都有重要作用。重要的是,这些网络属性,特别是网络hubs,已经与健康个体的遗传变异和转录组因子相关。
图1 |网络模型。a.示例网络模型。b. rich-club区域示例。c.人脑功能连接组示例
4.AD的连接体结构和功能网络
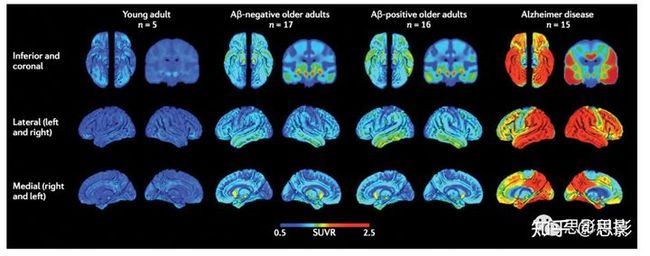
研究表明,与没有认知障碍的老年人相比,AD患者的脑网络特征是小世界特征的丧失(趋向于随机和/或规则的网络拓扑结构),模块结构异常,hub区域(特别是位于DMN和内侧颞叶的hub)改变。值得注意的是,楔前叶/PCC (DMN的一部分)和内嗅皮层(位于内侧颞叶)分别是Aβ和tau蛋白的初始沉积位点(图2)。在没有认知障碍的个体和患有AD痴呆的个体的人类连接体研究中有许多总结。在这里,我们特别讨论了在AD的不同亚型和阶段,Aβ病理学、tau病理学和遗传变异对功能和结构网络组织的影响。
图2 | AD中tau累积的模式
4.1 Aβ相关改变结构连接体。
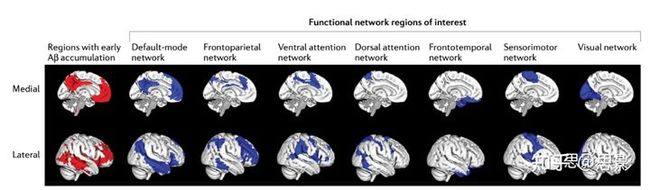
影像学研究结果表明,Aβ病理对不同结构连接体特征具有不同的阶段特异性影响。结构协方差网络(包括灰质网络和皮层厚度网络,由结构MRI数据构建)的拓扑结构与主观认知下降(subjective cognitive decline, SCD;框1)或轻度认知障碍(mild cognitive impairment, MCI)个体中Aβ病理的整体程度相关。特别是,一些灰质网络研究表明,在Aβ阳性的SCD患者中,通过CSF Aβ42和PET成像测得的Aβ病理的严重程度与全局或局部灰质体积无关,但与较低程度的灰质网络小世界性有关,尤其是在DMN的内侧颞叶和hub区(楔前叶和眶额皮层)。这些研究是每个参与者构建一个灰质网络(单参与者连接体),而不是更常见的在群体水平构建灰质网络的做法。其他单参与者灰质网络研究的结果表明,Aβ阳性个体的灰质网络拓扑结构与SCD发展为MCI或AD痴呆的临床风险相关,这有助于预测未来的海马萎缩和认知障碍。值得注意的是,在Aβ阴性的年龄匹配个体中没有观察到这种关联,这表明在AD临床前阶段有Aβ病理的个体中,灰质网络拓扑和海马萎缩之间的关系是特异性的。与灰质网络的研究结果一致,Aβ阳性的无认知障碍个体的皮层厚度网络没有明显的区域性皮层萎缩,但全局效率、模块性和hub程度低于Aβ阴性的无认知障碍个体。这些结构网络的变化先于可检测到的皮质变薄,这表明来自结构协方差网络的指标与Aβ病理的生物标志物相关。在各个研究中,Aβ病理和DTI衍生的结构网络指标之间的相关性是不一致的。一项研究报告了局部结构连通性(由几个加权结构连接体指标量化,包括节点强度、加权局部效率和加权聚类系数)作为疾病阶段的函数,呈降低趋势(无认知障碍> MCI > AD),特别是在双侧额颞区。值得注意的是,这些加权结构连接体指标与皮层Aβ负荷呈负相关,与大脑区域无关。另一项DTI研究调查了无痴呆个体的皮质Aβ负荷与死后结构连接体拓扑结构之间的关系。在这项研究中,Aβ负荷与多个全局(全局效率、度和聚类系数)和局部(PCC节点度和楔前叶聚类系数)连接指标呈负相关,而与高连接的PCC的局部效率呈正相关。局部效率的不一致结果可能是由于使用了不同的图形矩阵(加权或非加权网络)和DTI数据采集(体内或原位)的差异以及两项研究之间数据处理的差异造成的。上述DTI研究提供了证据,表明Aβ病理沿着AD连续体的进展导致了向更规则的网络拓扑的转变和局部结构连接性的弥漫性损失。值得注意的是,在一项弥散MRI研究中,与没有认知障碍的老年人相比,MCI和AD患者DMN后内侧hubs的结构连接减少了;然而,在Aβ阴性的个体中可以观察到白质纤维束的变性,这表明神经退行性改变与Aβ病理无关。DTI衍生的白质完整性测量,例如,各向异性分数和平均扩散系数,是预测临床前AD患者纵向认知能力下降的有用指标。然而,有证据表明,在AD早期,Aβ病理并不影响白质完整性。对这些发现的一种可能解释是,全局和局部结构的脑连接组指标比白质完整性指标对Aβ相关的变化更敏感。进一步研究Aβ病理与DTI衍生的脑结构连接体异常之间的可能联系,可以帮助理解Aβ病理对网络水平神经退行性变的影响及其与认知功能障碍的关系。值得注意的是,2018年发表的一项研究报告称,与没有认知障碍但Aβ混合阳性的AD患者(27% Aβ阳性患者)相比,Aβ阳性患者的上纵束和扣带束发生改变;然而,在结构连接组组织方面,两组间无显著差异。这种不一致性可能是网络阈值问题的结果(框3)。此外,DTI衍生的脑连接组结构研究的结果应该谨慎解释,因为结构连接测量的解剖学准确性和纤维束估计的可靠性仍有待于方法学研究和完善。框3 |图论分析:方法论考虑为了描述网络拓扑结构,通常对结构或功能连接矩阵应用阈值,以去除由低相关性(可能不太可靠的相关性)导致的虚假连接,并生成稀疏连接的邻接矩阵。由于不同的阈值将从相同的数据中产生具有不同连接数(或连接密度)的网络,因此通常使用一系列阈值来探索网络的拓扑特性。多个研究结果表明,大多数网络特性依赖于连接密度;因此,阈值或阈值范围的任意选择会导致网络拓扑估计的偏差。值得注意的是,加权网络分析而不将阈值应用于连通矩阵确实解决了连接密度问题;然而,由于患者组和对照组之间的整体连接强度存在差异,网络比较仍然存在偏差。例如,整体连接强度较低的网络将比其他网络具有较低的聚类系数。因此,患者组和对照组之间网络指标的统计差异可能只是整体连接强度差异的结果,而不是与网络组织中与疾病相关的差异直接相关。使用标准化网络度量可以减少但不能完全消除未加权和加权网络分析中的偏差。已经提出了几种新的网络构造方法(例如,最小生成树和基于一致性的阈值化)和统计方法(例如,多阈值排列校正和混合建模方法)。然而,到目前为止,没有一种方法能够完全解决上述方法学问题,这可能会妨碍患者组和对照组之间网络拓扑结构的可靠和可重复的比较。因此,对这类群体差异的图论分析结果应谨慎解释。功能连接体。功能连接组的研究通常包括静息态大脑活动的fMRI或电磁记录。这些研究的结果表明,在AD患者中,Aβ的积累和异常的脑网络连接在高度连接的hub区域是空间共定位的。在早期AD (包括临床前和前驱AD),使用不同的神经成像模式(如MEG和fMRI)的研究表明,功能性脑网络连接异常的程度与Aβ病理(CSF和PET)的程度有关,而与tau病理(CSF)无关。这些发现表明,与tau病理相反,Aβ病理驱动了AD早期的功能连接体改变。事实上,一项基于fMRI的连接体研究发现,在AD患者中,Aβ倾向于积聚在DMN的皮层hubs,包括PCC/楔前叶、外侧顶叶皮层、外侧颞叶皮层、内侧和外侧前额叶皮层。此外,还观察到显著的Aβ聚集和异常的hub连接性的共定位,伴随着Aβ沉积水平和度中心性之间的强正相关。随后的几项研究发现,Aβ病理和DMN连接(特别是DMN的后内侧成分)减少之间的关联也可在临床前AD、前驱AD和早发AD中被识别。证据还表明,DMN连接的减少介导了Aβ病理和前驱AD中认知障碍之间的关联。一项纵向研究结果显示,在CSF Aβ42和Aβ-PET水平正常,但随后转为异常CSF Aβ42的个体中,Aβ最初在DMN和额顶部分网络中积累;在这些早期阶段,感觉运动和视觉网络显示出最少的Aβ积累(图3)。注意,当CSF Aβ42水平异常时,个体的DMN内部以及DMN与额顶网络之间的连接降低,但没有脑萎缩或葡萄糖代谢降低。这一发现表明,临床前AD中Aβ相关网络的连通性降低先于其他神经退行性变的生物标志物,如脑萎缩和葡萄糖代谢低下。在另一项fMRI研究中,在AD连续体的不同阶段(无认知障碍、SCD、早发MCI、晚发MCI和AD)检查了DMN的连通性。研究结果支持了AD相关网络异常的假设,即在PET成像识别出淀粉样斑块之前,AD相关网络异常开始于DMN的后部,并通过网络hubs扩散到大脑的其他区域。
图3|静息态功能脑网络中早期Aβ积累
几项研究结果表明,在AD的早期和后期,Aβ相关的功能网络连接的异常不仅局限于DMN,还涉及其他大脑网络。在一项MEG研究中,与健康对照组相比,年轻(60.6±5.4岁)AD患者的几个hub区域(位于左海马、DMN后部和枕叶区域)的连通性发生了改变。在AD患者中,这些hubs连接异常的程度与认知障碍的严重程度和Aβ病理有关(CSF Aβ42)。一些fMRI研究已经确认了多个静息态网络中Aβ相关的连通性变化。例如,一项fMRI研究报告了在没有认知障碍的个体中,Aβ病理的区域严重程度与DMN、额顶网络和颞叶皮层之间功能连接的纵向变化呈负相关。一项密集抽样(3年5次观察)的fMRI研究报告了Aβ病理对临床前AD患者DMN和突显网络连通性纵向变化以及认知表现和海马体积纵向变化的类似(效应大小)影响。然而,网络连接的变化与认知表现和海马体积的变化无关,这表明DMN和突显网络的功能网络连接可以用来追踪认知和结构测量无法捕捉到的AD进展。人类内侧颞叶由海马、海马旁皮质、内嗅皮质和周围皮质组成,在情景记忆中发挥重要作用,而情景记忆在AD患者中是典型的障碍。因此,有假设认为AD病理(Aβ和/或tau)导致内侧颞叶与DMN前后成分之间的功能连通性降低,从而导致早期AD的认知功能障碍。与这一观点一致,一项纵向多模态MRI (fMRI和DTI)研究报告了Aβ阳性的无认知障碍个体和MCI患者中,内侧颞叶和DMN之间的Aβ相关功能连接的变化。特别是,与Aβ阴性的无认知障碍个体相比,Aβ阳性的无认知障碍个体的内侧颞叶前部和前DMN之间的功能连接下降,而Aβ阳性的MCI个体的海马和后内侧DMN之间的功能连接下降。值得注意的是,在没有认知障碍但Aβ阳性的个体中,内侧颞叶和前DMN之间的功能连接减退程度与tau病理(通过CSF磷酸化tau (phosphorylated tau, p-tau)测量)和基线记忆障碍相关;低功能连通性和记忆障碍之间的关系在基线和8年的随访中都存在。在Aβ阳性的MCI患者中,内侧颞叶和后DMN之间的功能连接减退程度与内嗅萎缩和海马旁扣带回白质完整性降低相关。这些发现不仅表明临床前AD功能网络异常和/或认知功能障碍由Aβ病理驱动且先于结构改变,同时表明前驱型AD中随后的结构变化与tau病理增加有关,Aβ病理促进了疾病进展。总之,本节讨论的研究提供了一致的证据,表明在AD早期,Aβ病理优先与DMN和内侧颞叶的网络连接下降相关,并且随着疾病进展,这种关联扩展到其他大脑网络。
4.2 Tau相关改变结构连接体。
关于AD中tau蛋白病理进展的一种假设是,tau蛋白从内侧颞叶扩散到其他网络hubs,特别是后内侧DMN。正在进行的研究试图确定tau蛋白病理进展的细胞机制,这可能包括细胞到细胞的“朊病毒样”传播;然而,目前的神经成像技术无法解决这一细节问题。一项里程碑式的多模态(Aβ-PET, tau-PET,以及结构和弥散MRI)纵向成像研究对临床前AD患者的研究结果表明,tau确实通过海马扣带束从内侧颞叶的海马扩散到后内侧DMN,特别是PCC。该研究报告了海马扣带束扩散率和PCC中tau蛋白积累之间的关联,在淀粉样蛋白积累水平较高的情况下这种关联更强,提供了Aβ病理促进tau蛋白传播的证据。此外,海马扣带束扩散率预测了Aβ阳性、PCC中tau蛋白高水平积累的个体的进行性记忆障碍,提供了Aβ和tau蛋白病理促进记忆障碍的证据。在另一项多模态研究中,在遗忘型MCI和轻度AD个体中,tau积累水平和结构连接性之间的关系因Aβ状态而不同。例如,在没有认知障碍的Aβ阴性个体中,内侧颞叶和整个大脑的tau沉积水平与结构连接呈正相关。相反,在那些Aβ阳性且伴有遗忘型MCI或轻度AD的个体中,tau沉积与同一内侧颞叶区域、整个大脑以及一些DMN中枢(包括前后扣带回皮质和楔前叶)的结构连接呈负相关。这些结果表明,随着AD的发展,tau蛋白和结构连接之间的关系以Aβ依赖的方式改变。关于tau蛋白病理对结构连接体组织的影响的数据,目前还没有,这些数据是通过传统的基于结构MRI的测量(如灰质体积和皮层厚度)来估计的。然而,相当多的研究发现,在AD连续体的不同阶段,tau负荷升高与皮质萎缩以及灰质病变之间存在前瞻性和回顾性的关系。由于结构协方差网络测量在捕捉Aβ病理对AD进展的影响方面显示出了比传统结构测量更优越的敏感性,未来的研究将需要探究tau是否在塑造AD中发生的结构协方差网络组织的变化中具有额外或独特的作用。
功能连接体。
Tau病理已被假设对人类功能连接体有特定的影响,取决于和/或独立于Aβ病理。早期研究探讨了功能网络连接和tau病理(CSF p-tau水平)之间的关系。例如,在MEG和fMRI研究中,临床前AD (没有认知障碍和/或MCI)患者CSF p-tau水平升高和CSF Aβ42水平降低与DMN前后(PCC) hubs和内侧颞叶功能连接的减少呈独立相关。随着体内tau-PET示踪剂的发展,最近更多的研究集中在检查tau病理和功能性脑连接体组织之间的空间关联。迄今为止,这些研究大多使用的数据来自Aβ阳性或Aβ混合状态(Aβ阳性和阴性)的个体。一项静息态fMRI研究提供了证据,表明在Aβ阳性且无认知障碍的个体中,颞下皮层tau蛋白的高积累与DMN和突显网络(Aβ优先沉积的地方)的较低功能连接有关。这一结果表明在AD早期Aβ阳性的个体中,tau蛋白和功能连接之间的关系可能受到Aβ病理的调节。此外,最近一项无认知障碍且Aβ混合态个体的任务态fMRI的结果表明,内侧颞叶记忆系统中tau负荷的异常累积与内侧颞叶和DMN后内侧hubs的神经激活增加有关。值得注意的是,尽管tau和Aβ的初始沉积在大脑的不同位置,但它们与AD临床前阶段的认知表现呈负相关。事实上,一项针对老年人和没有认知障碍的年轻人的fMRI研究结果表明,tau蛋白的病理在健康衰老过程中使海马与内侧颞叶的其他部分连接断开,导致记忆力下降。当前驱型AD发展为AD痴呆时,Aβ病理在大脑皮层广泛分布。因此,如果Aβ病理促进了Aβ阳性AD痴呆中tau病理和功能连接之间的联系,那么在该疾病的这个阶段,tau病理将会影响多个脑网络和全局网络属性。事实上,最近的静息态研究报道,在Aβ阳性的AD痴呆中,tau蛋白负担和功能连接之间的联系似乎并不只针对DMN,也会影响其他静息态网络。特别是,一项静息态fMRI研究结果表明,在Aβ阳性AD痴呆中,tau积累的协方差与多个静息态网络(包括DMN、额顶网络、边缘网络、背侧/腹侧注意网络、视觉和感觉运动网络)内部和/或之间的功能连接呈正相关(图4)。这项研究还发现,功能网络连通性以及基线tau积累水平可以准确预测未来tau积累,进一步支持AD中tau通过功能连接传播的假设。此外,一项针对AD痴呆个体的fMRI研究结果表明,来自多个静息态网络的hub区域比非hub区域的tau蛋白积累更多。Tau在hub的积累与局部连接的减少有关,这可以通过加权度和局部效率(度和局部效率可以在没有阈值的加权脑网络中计算;框3)来量化,支持tau病理影响AD痴呆网络hubs的假设。
图4 | tau-PET变化中功能连通性与协方差之间的关联
一种假设是Aβ和tau病理影响不同的静息态网络。该假说还指出,在AD晚期,与认知能力下降和其他AD生物标志物变化相关的是tau病理,而不是Aβ病理。与这一观点一致的是,一些研究报道了Aβ积累模式主要与DMN重叠,而tau积累模式与其他静息态网络(如边缘网络、前颞网络和视觉网络)重叠。在这些研究中,tau蛋白的积累程度还与一些下游生物标志物(包括葡萄糖代谢低下、白质完整性和灰质体积)和多种认知功能相关。因此,在同一研究中整合Aβ和tau成像数据可能有助于我们识别神经变性和认知障碍的具体因素。值得注意的是,上述研究中tau病理和功能连接之间的关联可能受到Aβ病理的影响。事实上,最近的一些研究已经报道了Aβ和tau蛋白对功能连接的交互作用。例如,一项多模态神经成像研究测量了没有认知障碍的老年人的fMRI、Aβ-PET和tau-PET。与Aβ阴性的参与者相比,Aβ阳性和新皮层tau水平低的参与者有更高水平的DMN和突显网络连接,随着时间的推移,这些个体的这些网络连接随着tau水平的增加而下降。然而,另一项fMRI- PET研究发现,在没有认知障碍的老年人中,tau蛋白在颞下皮层聚集与海马活动增加有关,但与Aβ积累无关。因此,为了分离Aβ病理对tau蛋白和功能连接之间关联的影响,需要在Aβ阴性的个体中进行研究。为了支持这一观点,一项fMRI-PET研究报告称,在任何一对给定的大脑区域之间,更高的功能连接与更强的tau协方差相关,特别是在颞下皮层和内侧颞叶。重要的是,tau蛋白和功能连接之间的这种联系在没有Aβ病理检测的情况下也存在:在Aβ阳性或阴性的无认知障碍个体和被诊断为MCI或AD的个体中都可以观察到。事实上,在另一项fMRI-PET研究中,基于内嗅皮层种子的连通性分析证实,内嗅皮层种子和大脑其他区域之间更强的连通性与更高水平的tau蛋白积累有关。此外,尽管Aβ积累增强了tau蛋白和功能连接之间的这种关系,但在Aβ阴性的个体中也存在这种关系。
5.AD亚型中的连接体
5.1晚发型AD
功能连接体。不同的AD亚型,如晚发AD、常染色体显性AD和早发AD,都与不同的遗传变异相关,这就提出了一个问题:这些亚型是否以不同方式改变连接体。APOE ε4对晚发AD患者的神经病理和认知功能障碍有主要影响。因此,对该亚型AD的连接组研究主要集中在APOE ε4携带者和APOE ε4非携带者的比较。一些fMRI研究的一致证据表明,APOE ε4在AD不同阶段的网络连通性变化中具有重要作用,特别是在DMN中。一项早期的fMRI研究报道,在没有异常Aβ积累的情况下,APOE ε4携带者的DMN功能连接水平低于APOE ε4非携带者。随后的fMRI研究结果支持了这一发现,并确定了AD临床前阶段多个静息态网络中APOE ε4相关的功能网络连通性和网络拓扑变化,包括突显、颞叶、视觉、额顶和感觉运动网络。值得注意的是,在一项纵向fMRI研究中,APOE ε4对SCD患者DMN连接的影响随着疾病的进展而持续,无论Aβ积累水平如何。家族史与功能网络连通性的关系也在晚期AD的APOE ε4非携带者中进行了研究。即使在没有APOE ε4的情况下,有晚发性AD家族史的无认知障碍的个体与没有家族史的个体相比,静息态DMN连通性较低。在有晚发性AD家族史的个体中,SCD与较高的静息态DMN连接相关;在这些记忆力下降的个体中,更高的连通性与更好的记忆力、注意力和整体认知能力有关,但随着时间的推移,与更大程度的记忆力下降有关。一种假设是,由于功能网络连接测量似乎与认知和临床表型密切相关,它们可能有助于预测晚发AD患者和已知家族病史个体的疾病进展。事实上,在一项机器学习研究中,DMN、突显网络、边缘网络的功能网络连通性以及灰质体积,能够准确预测晚发性AD患者和已知家族病史个体的发病年龄。结构的连接体。与APOE ε4相关的脑结构连接体的改变与脑功能连接体的改变相似,即涉及DMN和内侧颞叶。特别是,DTI研究报道,与没有认知障碍的APOEε4非携带者的对照组相比,具有临床前晚发性AD的APOEε4携带者具有与年龄相关的局部连通性丧失,其特征是聚类系数、局部效率和介数中心性降低。这种减少同时影响DMN的后部和额部hubs,包括楔前叶、内侧眶额皮质、前扣带皮层和后扣带皮层。在这些DTI研究中,DMN连接异常的程度与情景记忆损害的程度以及注意和执行功能障碍有关。此外,APOE ε4相关的内侧颞叶区域的结构连接中断,例如右侧海马和海马旁回的低效率,已在无认知障碍个体和MCI患者中报道。值得注意的是,一项静息态DTI-fMRI研究发现,APOE ε4相关网络的变化在中年APOE ε4携带者中已经可以检测到。这一观察结果表明,APOE ε4在症状出现前几十年就已影响到连接体组织,可能是早期检测AD的一个有前景的生物标志物。在APOE基因型之外,两项全基因组关联研究报告了结构连接体组织变化与多种AD相关遗传变异之间的具体关联。其中一项研究是一项新的横断面全基因组关联研究,在健康成年双胞胎中发现了基于DTI的结构连接和SPON1变异之间的全连接组、全基因组关联。值得注意的是,SPON1编码Spondin 1 (也称为F-spondin),它在海马中表达,促进海马胚胎神经元的生长。SPON1还与APOE相互作用,调节Aβ积累。重要的是,有SPON1变异的个体比没有变异的个体患痴呆症的严重程度要轻,这与APOE基因型无关,表明SPON1变异在临床前、晚发性AD中具有保护作用。综上所述,这些发现间接提示了SPON1在晚发性AD的结构连接变化中发挥的作用,表明这类AD的结构脑网络变化与多个基因的变异有关,而不仅仅与APOE基因型有关。
5.2常染色体显性AD
与晚发性AD和散发性早发性AD不同,常染色体显性AD是由三个基因(APP、PSEN1和PSEN2)之一的单基因突变引起的。此外,常染色体显性AD患者经常表现出一致的生物标志物变化的时间模式:首先,Aβ (CSF Aβ42和Aβ-PET)增加;第二,tau增加(CSF p-tau和tau-PET);第三,代谢减退;第四,皮质萎缩;最后,临床衰退。常染色体显性AD的发病年龄在家族中也是一致的。因此,与其他AD亚型相比,研究常染色体显性AD个体的大脑连接体变化(在这些个体中,生物标志物的变化和症状的发生是可以预测的),可以更精确地评估已知基因突变和疾病进展的影响。结构连接体。不少研究报道了常染色体显性AD临床前阶段个体灰质萎缩和白质扩散特性改变的证据;然而,关于这种亚型疾病的结构脑连接体的研究仍然很少。在一项全面的纵向研究中,构建了269例常染色体显性AD突变携带者和170例非携带者的结构灰质网络;进行了横断面和纵向分析。在横断面分析中,携带者和非携带者之间最早的差异(约在症状发作前12年左右)是较低的标准化路径长度,尤其是楔前叶。在纵向分析中,两组参与者之间最早的差异(在症状出现前6年)是突变携带者的归一化聚类系数、连接密度和程度的降低。在横断面分析中,更大的Aβ积累、更高水平的神经退行性变生物标志物(葡萄糖代谢低下和楔前叶皮质变薄)和更大的认知衰退与较低的基线小世界系数相关。在纵向分析中,Aβ积累、神经退行性变生物标志物水平和认知能力下降的快速变化与小世界系数随时间的同时下降有关。研究还发现,PSEN1突变携带者的全局网络连通性低于APP或PSEN2突变携带者,这表明不同常染色体显性AD基因的突变会导致相同的连通性变化。功能连接体。迄今为止,常染色体显性AD的功能连接体改变仅通过fMRI进行评估。在一项fMRI研究中,Chhatwal等人评估了无症状常染色体显性AD突变携带者(APP, PSEN1和PSEN2)和来自同一家族的非携带者的DMN功能连通性,发现突变携带者的连通性较低,特别是在PCC/楔前叶和右顶皮层。值得注意的是,随着疾病的进展,突变携带者的DMN连接中断情况恶化。在最近的一项fMRI研究中,常染色体显性AD和晚发AD都与多个静息态网络的功能连通性降低有关,包括DMN,背侧注意网络和带状盖网络(也称突显网络)。与Chhatwal等人的研究结果一致,常染色体显性AD突变携带者比非携带者在这些静息态网络中表现出较低的功能连通性,略早于他们预测的症状发病年龄。这一系列fMRI连通性研究的最新成果发表于2018年,也报告了常染色体显性AD突变在疾病临床前阶段对DMN和背侧注意网络退化的具体影响。这三项fMRI研究的结果表明,APP、PSEN1和PSEN2的突变影响网络水平神经退行性变的速率。利用fMRI技术研究了AD各亚型的功能连接体组织、tau蛋白积累与认知能力下降之间的关系。特别是,一项研究报告了晚发AD患者和常染色体显性AD突变携带者额叶hub区域功能连接水平较高与记忆和整体认知能力受损较慢之间的联系。这种较高的连通性也与tau蛋白对临床前Aβ阳性晚发AD患者认知能力下降的影响较小有关。
5.3早发AD
与晚发性和常染色体显性AD相比,对散发性早发性AD进行的脑连接组研究较少,约占所有AD研究的4-6%。在一项fMRI研究中,与没有认知障碍的个体相比,早期AD患者的全局和局部网络连接发生了改变,其特征是感觉运动区域的聚类系数较低,颞叶的路径长度较长。第二项fMRI研究评估了早发性和晚发性MCI中DMN的连通性,发现与早发性MCI相比,晚发性MCI在DMN的额中线和后中线的功能连通性较低。值得注意的是,在早发MCI组的参与者中,Aβ阳性的个体比Aβ阴性的个体表现出更低的DMN连通性,支持Aβ病理在不同类型AD中的共同作用。一些DTI研究报道,早发性AD与后部脑区的结构连接受损和富人俱乐部(rich-club)属性有关。正如前一节所讨论的,典型的晚发性AD的特征是DMN和海马的功能和结构网络连接中断,而其连接可能在记忆加工中发挥重要作用。因此,与早发性AD相关的后部脑区连通性的改变可能解释了早发性AD患者在视觉空间、注意和执行等多个认知域表现出认知功能障碍的原因。这与晚发性AD的情景记忆丧失形成了鲜明对比。6.病理性蛋白扩散来自人类研究和转基因小鼠模型(框4)的证据表明,与神经退行性疾病相关的错误折叠蛋白(如AD中的Aβ和tau蛋白以及帕金森病中的α-突触核蛋白)表现出典型的时空积累模式。一种假设是,这些模式反映了朊病毒样传播神经元沿结构连接扩散。这一假设得到了许多转基因小鼠模型研究结果的支持。这些研究报告,错误折叠的tau蛋白可通过朊病毒样过程的神经元途径传播,这似乎是由Aβ病理促进的。tau-PET与功能和/或扩散MRI相结合的人类研究也支持tau扩散假说。框4 |来自动物模型的机制见解虽然本文的重点是人类研究,动物模型的研究也提供了连接体和淀粉样蛋白β (Aβ)和tau病理学之间的关系的证据。例如,转基因小鼠模型的证据表明,神经元活动可以调节特定脑区Aβ积累,并可以促进tau的释放和细胞间传播。一项研究使用了tau病理小鼠模型,报告了区域tau积累主要是由解剖连接驱动,而不是由细胞内因子(基因表达谱)驱动。在另一项研究中,向转基因小鼠的海马内注射人tau预制原纤维,可诱导tau扩散,进而影响尾侧内嗅皮层和对侧海马,进一步支持tau扩散和连接体之间的关系。此外,Aβ通过神经元连接促进tau蛋白传播的假说也在小鼠模型中得到了验证。因此,尽管将动物模型直接转化为人类仍然具有挑战性,动物模型的发现可以为AD相关连接体改变的发病机制提供重要的机制见解。另一个主要假设是,这些模式反映了特定大脑区域的选择性神经元异常(或脆弱性)。这一假说来源于观察到在AD过程中,一些神经元在结构和功能上比其他神经元更早出现异常。PET检测到的Aβ和tau积累的初始模式似乎支持这一假设,因为Aβ最初沉积在DMN的内侧hubs (内侧前额叶皮层和PCC/楔前叶),而tau最初沉积在内嗅皮层,这提供了AD中特定hub区域选择性地易受Aβ和tau病理影响的证据。此外,早期Aβ积累的hubs也是高代谢需求的区域。因此,AD中网络hubs的选择性异常可以从代谢的角度来解释。具体来说,研究表明,高度连接的hub区域因氧化葡萄糖代谢需要高代谢能量。此外,一项小鼠连接组研究发现,hub连接是由调节ATP氧化合成和代谢的基因通路驱动的。因此,这些高成本的hubs在代谢压力的情况下将容易显示异常连接。事实上,越来越多的证据表明,在DMN中较高的Aβ积累与DMN和其他功能连接的脑区更强的局部代谢低下有关。在其他研究中,低代谢的空间位置与不同亚型AD (晚发AD、早发AD和常染色体显性AD)中tau蛋白的积累模式密切相关。然而,在AD中tau蛋白相关的低代谢和连接体改变之间的关系尚未被研究。未来,将连接体(基于MRI或MEG)与多模态PET (tau、Aβ和FDG)相结合的研究可能有助于识别连接体、tau、Aβ和葡萄糖代谢低下之间的相互关联。
6.1基于连接组的计算模型
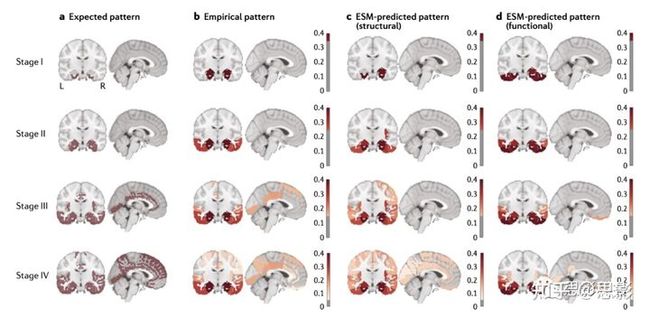
计算模型(框5)提供了一种补充方法来检验理论假设,然后模型结果可以与经验数据进行比较。特别是,计算模型可以用来模拟和复制由PET成像数据识别的Aβ和tau病理模式,验证上文讨论的选择性脆弱性假说和致病性扩散假说。除了重复实验结果,计算模型还可以用于跟踪和预测Aβ和tau进展的轨迹,揭示连接体变化和AD病理之间的动态关系。事实上,hubs对错误折叠蛋白的选择性异常得到了用神经团块模型模拟网络变化的研究结果的支持,这些模型通常建立在由DTI数据估计的解剖网络上,并生成EEG和MEG样数据(框5)。AD的计算模型发现,异常的hub连接是由过度的神经元活动引起的,这导致了网络的退化。在最近的一项计算研究中,神经元活动的病理性增加对功能网络hubs的破坏可能会被神经元兴奋性水平的靶向调节所抵消。一项Aβ-PET和FDG-PET研究报告称,Aβ积累通过人类DMN的hubs传播,导致空间遥远但功能连接的脑区的低代谢,这有助于证明遥远的Aβ积累可以诱发区域代谢异常。在形成Aβ病理但不形成神经纤维缠结(tau病理)的转基因大鼠中重复了这一观察,表明Aβ诱导的hubs连接异常与tau病理无关。综上所述,这些发现强调了网络hubs在维持信息转移的分离和整合之间的最佳平衡的重要性,也表明hubs可以促进AD病理的早期传播。方框5 |网络神经科学中的计算模型一般来说,网络神经科学领域的计算模型使用一组微分方程来描述感兴趣变量的动态演化,这些变量通常与神经元群体有关。这些方程是在描述大规模解剖网络的结构连通性矩阵上计算的。在这里,我们定义了这类模型的三种变体,它们已应用于痴呆。神经团块模型(Neural mass models)神经团块模型由相互连接的节点组成,每个节点代表连接的兴奋性和抑制性神经元的大群体(一个“神经团块”)中的平均神经活动。神经团块模型的特征是平均膜电位(例如,模拟EEG或脑磁图信号)和神经元群的spike密度(或放电率)。模型的局部动力学受到空间遥远的神经元群和大脑区域的结构耦合(解剖路径)的影响。这些耦合可以是互反的,也可以是定向的,这取决于用来定义耦合矩阵的解剖数据,它们通常包含连接权重和依赖于距离的时间延迟。网络扩散模型(Network diffusion models)网络扩散模型模拟了通过结构网络传播的模式。例如,这些模型可以通过网络热方程来模拟蛋白质在结构连接网络中的细胞间扩散,该网络热方程为跨神经元扩散提供了一个解析的、封闭的解。该模型假设一个大脑区域内所有神经元的平均激活信号与发出信号的神经元数量成正比。流行病传播模型(Epidemic spreading models)流行病传播模型模拟一个信号(如毒性淀粉样蛋白β和tau蛋白)在一段时间内从预先选定的中心到不同的大脑区域的流行病扩散过程。在一个结构连接网络上模拟了扩散模式,可以对每个个体拟合几个模型参数,分别表示个体特定的全局生产速率、全局清除率和开始时间。这些参数与区域结构连接模式相结合,决定了传播速度。与网络扩散模型不同,流行病传播模型需要指定生产和/或清除项,并通过随机微分而不是解析方程来实现。在少数研究中,流行病传播模型(epidemic spreading models, ESM) (框5)成功复制了经验数据中确定的Aβ积累和tau传播模式。特别是,一项模拟研究使用ESM来测试tau扩散假说。以内嗅皮层为中心,将ESM应用于未发生认知损伤的年轻个体的DTI结构连接体,并解释了沿着AD连续体的个体中tau-PET信号空间模式<70%的变异(图5)。ESM也适用于功能性连接组和欧氏距离矩阵,但ESM更适用于结构连接组,这表明tau蛋白主要通过结构连接组途径传播,而不是通过功能连接或仅仅在相邻大脑区域之间传播。这项研究的结果也支持这样一种假设:尽管tau蛋白的积累与Aβ病理无关,但更大的Aβ负担促进了tau蛋白的传播。最近的一项tau-PET研究确定了tau传播模式的四种亚型,每一种亚型在空间上都与不同的大脑子网络重叠,即边缘网络、内侧颞叶网络、视觉网络或外侧颞叶网络。值得注意的是,在这项研究中,使用不同预选中心的ESMs (框5)来模拟4种tau传播亚型,表明tau通过不同亚型在不同子网络传播。
图5 |假设的、经验的和预测的tau传播模式网络扩散模型(Network diffusion models, NDNs;框5)也被用来研究AD的病理模式。这些模型表明AD病理弥漫性扩散,并预测了未来的皮质萎缩模式和糖代谢低下模式。
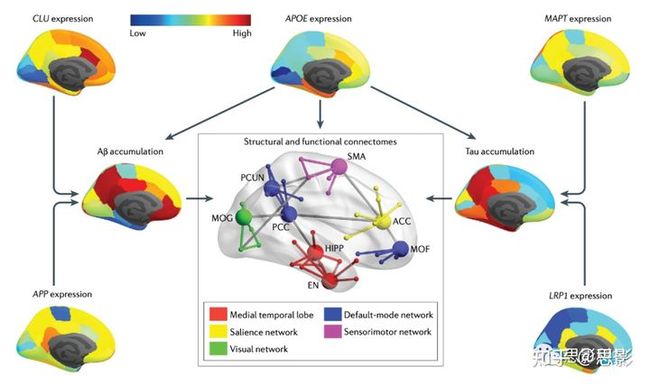
具体来说,有一项研究报道,AD网络hubs的异常连通性可以通过一个线性模型来预测,该模型基于健康大脑中少数AD候选基因(APP、MAPT、PRNP)的区域表达。此外,在线性预测模型中结合NDN和区域基因表达模式,选择内嗅皮层作为种子,提高了模型预测区域萎缩和低代谢模式的能力。这些结果支持大脑连接模式在AD病理传播中的作用,以及网络模型在预测疾病进展方面的重要性,而不仅仅是作为描述大脑结构和功能表征的工具。值得注意的是,NDN和ESM都被用于预测疾病进展,但没有使用相同的连接组数据直接比较两种模型的性能,这可能是一个有趣的未来方向。7.挑战与机遇尽管在AD的脑网络分析方面已经取得了重大进展,但有两个主要问题仍然没有得到解答。首先,在临床前AD中,Aβ最初积聚在DMN中线的额部和后部hubs,而tau首先积聚在内侧颞叶hubs——Aβ和tau的病理在这个疾病阶段影响不同的大脑网络的原因尚不清楚。其次,Aβ和tau如何相互作用,以及它们如何相互作用和/或独立地影响AD连接体的组织,目前尚不清楚。因此,我们需要更好地理解这些AD病理与相关脑网络变化之间的联系,以及不同亚型中观察到的AD生物标志物变化的潜在原因和时间顺序。在未来,多模态神经成像(PET,fMRI和DTI)研究可能会进一步加深我们对独特但相关的Aβ和tau病理学模式的理解(图6)。
图6 |基因表达、AD病理及人类连接体
一些局限性可能会影响本文中讨论的结果的解释。首先,神经元和血管因子随年龄的变化不同,这两种因子都参与了fMRI测量的血氧水平依赖信号。此外,老年患者的脑血管血流动力学障碍与白质高信号相关。因此,年龄相关的神经-血管相互作用的变化可能会影响fMRI和弥散MRI结果的解释。第二个限制是本综述中讨论的大多数数据集是具有欧洲血统的个体。未来的研究应该包括更广泛、更多样化的全球人口样本。总结: 本文回顾了在不同类型和阶段的阿尔茨海默症(AD)中,人类连接体组织与分子和神经病理学标志物的关系。已有数据表明,在临床前AD患者中,选择性中枢(hub)易损性是Aβ优先在默认网络(DMN)内侧hub积累和tau在内侧颞叶hub优先积累的原因。数据还表明,在前驱型AD中,tau蛋白从内侧颞叶向DMN后部hubs的跨细胞扩散假说是最可能的解释。这些假设需要使用多组学研究框架(将经验的多模态神经成像和基因表达数据与计算脑网络模型相结合)进行更直接的研究。未来,纵向研究、机器学习和多变量数据分析可以阐明不同类型AD生物标志物之间的关联,并识别临床和生物学亚型,从而帮助开发有效的治疗方法。
原文:The human connectome in Alzheimer disease — relationship to biomarkers and genetics
如需原文及补充材料请添加思影科技微信:siyingyxf或18983979082获取,如对思影课程及服务感兴趣也可加此微信号咨询。另思影提供免费文献下载服务,如需要也可添加此微信号入群,原文也会在群里发布,如果我们的解读对您的研究有帮助,请给个转发支持以及右下角点击一下在看,是对思影科技莫大的支持,感谢!